波拉霉素发酵工艺的优化
孙正阳,吕广新,孟浩毅,赵晨,杨兆勇,陈静
波拉霉素(图 1)是吸水链霉菌 LP93(Streptomyces hygroscopicusLP93)发酵培养物经酸化、过滤,菌体用溶剂提取、层析等方法分离提取得到的具有很高抗真菌活性的多羟基内酯类新抗生素[1]。该抗生素是由中国医学科学院医药生物技术研究所首次发现的一种新结构天然抗菌化合物,具有广谱抗微生物活性,对酵母菌、丝状真菌、原虫、革兰阳性细菌均有活性,是一类广谱抗真菌抗生素[2]。另外,其产生菌原始菌株的生物学效价已稳定达到 3000 μg/ml,具有较好的应用价值。因此,建立波拉霉素商品化生产的小型中试发酵工艺对于其应用技术的研究是十分关键的。
本研究通过对波拉霉素发酵培养基成分及发酵条件进行优化,以枯草芽孢杆菌为检定菌株进行波拉霉素发酵液活性测定,获得最优的发酵条件,以利于提高其生物学效价,为波拉霉素的应用研究提供物质基础。
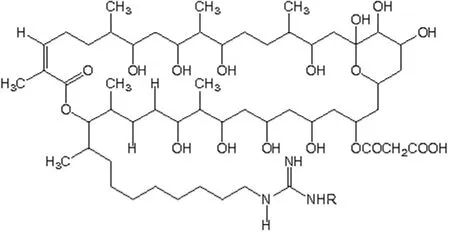
图1 波拉霉素结构图Figure 1 The structure of polaramycin
1 材料与方法
1.1 材料
1.1.1 主要仪器 超净工作台购自苏州汇通空调净化工程有限公司;CR22GIII 型高速离心机购自日本 Hitachi 公司;高压灭菌锅购自日本 Hirayama公司;ZHWY-3212 自控摇床、37 ℃ 和 28 ℃ 培养箱均购自上海智城分析仪器制造有限公司;电子天平购自梅特勒-托利多仪器上海有限公司。
1.1.2 产生菌和培养基 波拉霉素产生菌、枯草芽孢杆菌 63501 由本实验室保存;斜面培养基:天门冬素 0.05%、K2HPO40.05%、葡萄糖 1%、琼脂 1.2%;种子培养基:黄豆饼粉 2% ~ 4%、(NH4)2SO40.3%、CaCO30.15%、葡萄糖 2%;基础培养基 1(用于进行氮源及辅助氮源的优化):葡萄糖 3.5%、KH2PO40.5%、CaCO30.3%;基础培养基 2(用于进行碳源的优化):黄豆饼粉 3.0%、(NH4)2SO40.5%、KH2PO40.5%、CaCO30.3%;发酵培养基(用于进行消泡剂添加及发酵中补料实验):黄豆饼粉 3.0%、葡萄糖 3.5%、(NH4)2SO40.5%、KH2PO40.5%、CaCO30.3%;检定培养基 I(上层):蛋白胨 0.5%、牛肉浸出粉 0.5%、NaCl 0.8%、Na2HPO40.2%、琼脂 1%、pH 7.0;检定培养基 II(下层):蛋白胨 0.5%、牛肉浸出粉 0.5%、NaCl 0.8%、Na2HPO40.2%、琼脂2%,pH 7.0。
1.2 方法
1.2.1 摇瓶发酵方法 取新鲜波拉霉素产生菌斜面,采用挖块法接种于装有 50 ml 种子培养基的250 ml 三角瓶中,于 28 ℃、220 r/min 摇床振荡培养 48 h,再以体积分数 10% 的接种量接入装有50 ml 发酵培养基的 500 ml 三角瓶中,于 25 ℃、220 r/min 摇床振荡培养。
1.2.2 波拉霉素活性测定
1.2.2.1 双碟的制备 取直径约 90 mm、高 16 ~17 mm 的平底双碟,注入加热融化的检定培养基 II 20 ml,使其在碟底均匀摊布,放置水平台上凝固,以此作为底层。另取检定培养基 I 适量加热融化后,放冷至 48 ~ 50 ℃,加入 1% 枯草芽孢杆菌菌悬液,充分摇匀后用灭菌大口吸管在每个双碟中分别加入 5 ml,使其在底层上均匀摊布,作为菌层,放置水平台上冷却后备用。
1.2.2.2 波拉霉素产生菌发酵液的活性测定 精密吸取波拉霉素产生菌发酵液1 ml,加入 1 ml 乙酸乙酯,充分混匀,取乙酸乙酯提取液进行测定。在每一个双碟中以等距离均匀安置不锈钢小管(内径 6.0 mm,高 10.0 mm,外径 7.8 mm)6 个,加入 200 μl 各组乙酸乙酯提取液,置于 37 ℃ 培养18 h,测量抑菌圈直径。
1.2.3 氮源及辅助氮源对波拉霉素发酵的影响 以原发酵培养基中添加黄豆饼粉 3.0% 为对照,分别用黄豆饼粉 3.0% + (NH4)2SO40.5%、花生饼粉 3.0%、黄豆饼粉 3.0% + 玉米浆 1.0%、黄豆饼粉 3.0% + 酵母膏 0.5%、黄豆饼粉 3.0% + 精介蛋白胨 0.5%、鱼粉 2.2% + (NH4)2SO40.5%、黄豆饼粉 3.0% + KNO30.5%、黄豆饼粉 3.0% +NH4NO30.2%、黄豆饼粉 3.0% + NH4Cl 0.5%、芝麻饼粉 3.0%、玉米浆 2.0% + (NH4)2SO40.5% 作为氮源及辅助氮源添加至基础培养基 1 中,进行菌株的发酵,分别于发酵 72 h 及 96 h 取样,测定抑菌活性,确定最适氮源。
1.2.4 碳源对波拉霉素发酵的影响 以原发酵培养基中添加葡萄糖 3.5% 为对照,分别用淀粉3.5%、蔗糖 3.5%、乳糖 3.5%、果糖 3.5%、甘油3.5%、糊精 3.5%、豆油 3.5%、玉米粉 3.5%、淀粉 3.0% + 葡萄糖 0.5% 作为碳源添加至基础培养基 2 中,进行菌株的发酵,分别于发酵 72 h 及96 h 取样,测定抑菌活性,确定最适碳源。
1.2.5 消泡剂对波拉霉素发酵的影响 以发酵过程不添加消泡剂为对照,分别用豆油(0.1%、0.3%、0.5%)、泡敌(0.01%、0.03%、0.05%)及豆油 + 泡敌(0.1% + 0.01%、0.3% + 0.03%、0.5% + 0.05%)作为消泡剂添加至发酵培养基中进行菌株的发酵,分别于发酵 72 h 及 96 h 取样,测定抑菌活性,确定消泡剂对波拉霉素发酵的影响。
1.2.6 波拉霉素发酵的补料实验 在波拉霉素发酵过程中分别在不同发酵时间补加不同的培养基成分,以发酵过程不进行补料为对照,测定抑菌活性,确定波拉霉素中试发酵的最佳补料条件。
1.3 统计学处理
3 次及以上的独立实验数据结果以±s表示。所有数据均采用 ANOVA 分析和t检验,P<0.05 即认为有统计学差异。
2 结果
2.1 不同氮源对波拉霉素发酵的影响
利用发酵液抑菌活性评价 12 种不同氮源及辅助氮源对波拉霉素发酵的影响。结果如图 2 所示,发酵 72 h 时,以花生饼粉 3.0%、黄豆饼粉3.0% + 玉米浆 1.0%、黄豆饼粉 3.0% + NH4NO30.2% 作为氮源效果最佳。而当发酵 96 h 时,以黄豆饼粉 3.0% + (NH4)2SO40.5%、黄豆饼粉 3.0% +NH4Cl 0.5%、芝麻饼粉 3.0%、花生饼粉 3.0%、黄豆饼粉 3.0% + 精介蛋白胨 0.5% 作为混合氮源添加时,波拉霉素产生菌发酵液抑菌活性提高最为明显。
2.2 不同碳源对波拉霉素发酵的影响
由 10 种不同碳源对波拉霉素发酵的影响结果(图 3)可知,无论是 72 h 还是 96 h,波拉霉素发酵的碳源以果糖最佳,葡萄糖次之,豆油最差。
2.3 消泡剂对波拉霉素发酵的影响
结果如图 4 所示,从发酵发展趋势可以看出豆油和泡敌添加量为 0.5% 和 0.05% 时对波拉霉素发酵几乎无影响。
在考虑以上因素进行研究的同时,各组实验均分别在发酵 72 h 和 96 h时取样,对不同发酵时间进行考察,结果发现发酵 96 h 较 72 h 抑菌活性提高明显,因此确定波拉霉素的最佳发酵时间为96 h。
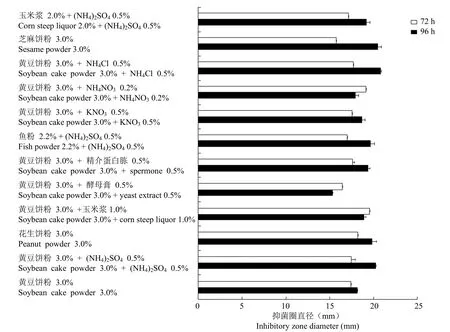
图2 不同氮源对波拉霉素发酵的影响Figure 2 The effect of different nitrogen sources on the fermentation of polaramycin

图3 不同碳源对波拉霉素发酵的影响Figure 3 The effect of different carbon sources on the fermentation of polaramycin
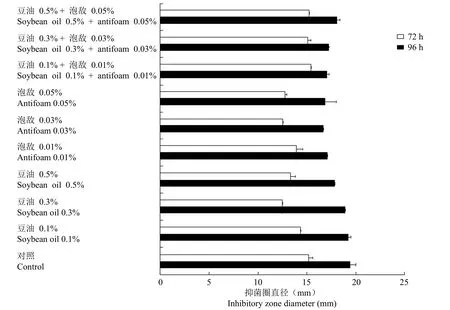
图4 消泡剂的添加对波拉霉素发酵的影响Figure 4 The effect of adding defoamer on the fermentation of polaramycin
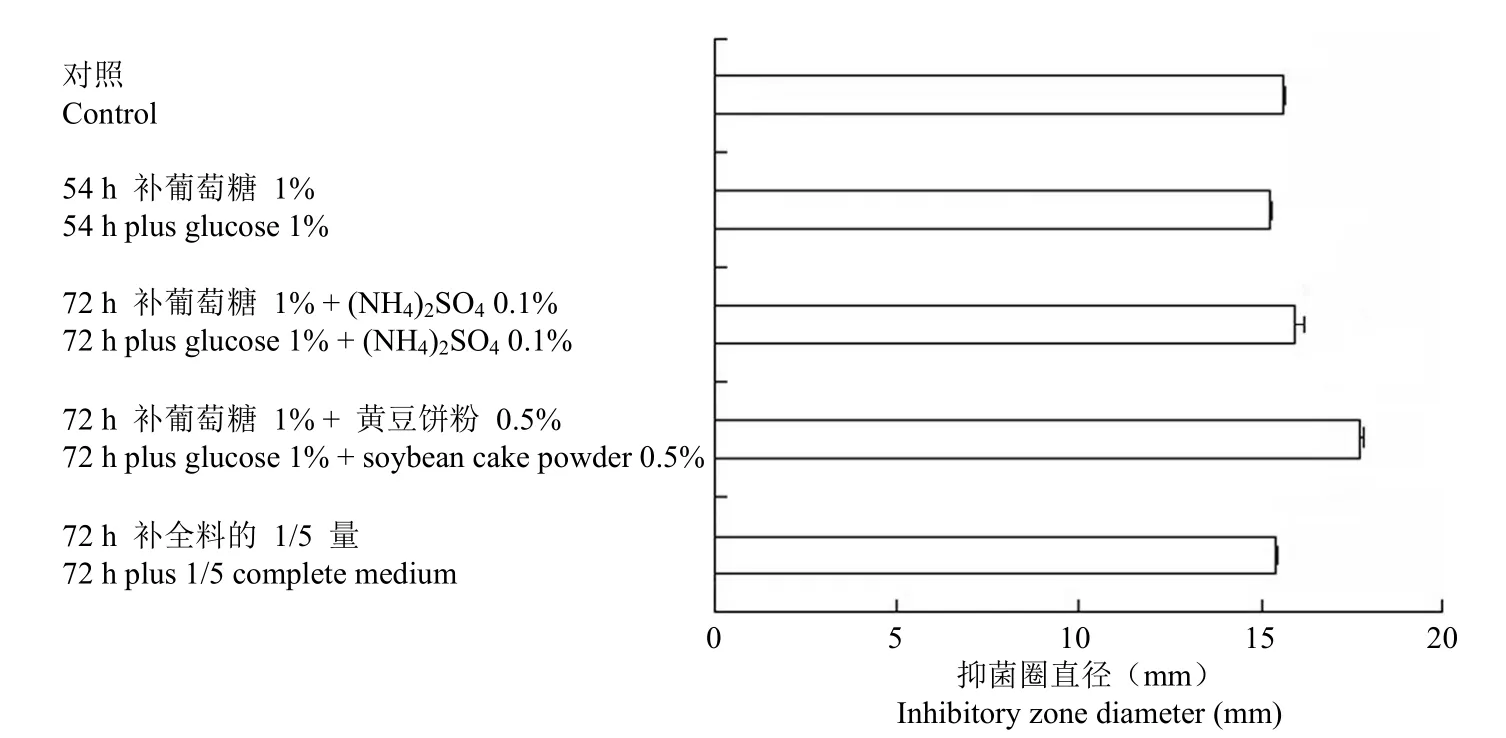
图5 补料方式对波拉霉素发酵的影响Figure 5 The effect of feeding method on the fermentation of polaramycin
2.4 波拉霉素发酵的补料实验
在上述实验基础上对波拉霉素发酵过程中的补料方式进行了探讨,结果如图 5 所示,波拉霉素在发酵 72 h 时补加 1% 葡萄糖和 0.5% 黄豆饼粉效果最佳。
3 讨论
氮源在微生物发酵中起着重要作用,为微生物提供基本的营养物质及生长因子等重要物质,不仅供应菌体生长和维持生命活动,还和代谢产物的生物合成密切相关[3]。黄豆饼粉是初始发酵培养基中的唯一氮源,因此本研究对 12 种不同氮源及辅助氮源进行考察,综合考虑中试发酵成本、稳定性及酸碱性等因素,最终以黄豆饼粉 3.0% + (NH4)2SO40.5% 作为培养基的最佳氮源。
碳源是微生物发酵培养基中最重要的能源物质之一,它能够为微生物的生长及抗生素的合成提供能量及碳元素,因此对于微生物的生长发育具有决定性的作用[4]。因此在上述实验的基础上,考察10 种不同碳源对波拉霉素发酵的影响,综合考虑中试发酵工艺,最终以原培养基中葡萄糖 3.5% 作为波拉霉素发酵的碳源。
在液体发酵过程中,由于通气、搅拌、菌液黏稠度逐渐增大以及培养基中代谢产物积累等原因,发酵液会产生大量的泡沫[5],泡沫严重时,极易造成发酵液漫罐、杂菌污染及代谢异常等不利影响[6]。然而,适当的泡沫形成对抗生素发酵氧传递速率(OTR)的提高有显著作用,因此筛选适合的消泡剂对泡沫适量控制是波拉霉素发酵过程中的重要环节之一[7]。通常消泡的方法包括物理方法(如机械搅拌、静电消泡、冷冻法等)和化学方法[6]。化学方法通过消泡剂的添加来减少或控制泡沫,经济方便且效果好,目前在液体发酵工业生产中得到了广泛应用[8]。化学消泡剂的添加对微生物菌体生长会产生一定影响,可能会降低或抑制发酵微生物的生长和产量[9]。因此本研究考察两种不同消泡剂(豆油和泡敌)及不同添加浓度对波拉霉素发酵的影响,结果表明添加一定量的豆油和泡敌对波拉霉素发酵几乎无影响。
补料培养作为一种介于连续培养和分批培养之间的发酵方式,是指在发酵过程中,连续或间歇补加一种或几种培养基成分,但不同时取出发酵液的发酵方法[10]。其具有提高菌体对氧和营养成分的利用率、缓和培养基底物抑制等特点,从而更有利于目的产物的生成,达到较大幅度提高产量的目的,目前已被广泛应用到各种发酵初级和次级代谢产物的生产中[11-12]。因此本研究对波拉霉素发酵过程中的补料方式进行了探讨,确定了其最佳补料方式。
综上所述,本研究通过对波拉霉素发酵培养基成分及发酵条件进行优化,以枯草芽孢杆菌为检定菌株进行活性测定,确定波拉霉素发酵最优的氮源为黄豆饼粉 3.0% + (NH4)2SO40.5%、最佳碳源为葡萄糖 3.5%、发酵 72 h 时补加 1% 葡萄糖和 0.5%黄豆饼粉、最终发酵 96 h,且豆油和泡敌添加量为0.5% 和 0.05% 时对波拉霉素发酵无影响。本研究为波拉霉素中试发酵条件的确定提供了依据,进而为其应用研究提供物质基础。
[1] Meng W, Jin WZ. Structure determination of new antifungal antibiotics, polaramycins A and B. Acta Pharm Sinica, 1997, 32(5):352-356. (in Chinese)孟伟, 金文藻. 新抗生素波拉霉素A和 B的结构测定. 药学学报,1997, 32(5): 352-356.
[2] Jin WZ, Meng W, Wang YG, et al. Polaramycins A and B, novel antifungal antibiotics from Streptomyces hygroscopicus. Isolation,properties and characterization. Chin J Antibiot, 1997, 22(1):1-7. (in Chinese)金文藻, 孟伟, 王以光, 等. 新抗生素波拉霉素 A、B的分离、性质及鉴别. 中国抗生素杂志, 1997, 22(1):1-7.
[3] Flugel RS, Hwangbo Y, Lambalot RH, et al. Holo-(acyl carrier protein)synthase and phosphopantetheinyl transfer in Escherichia coli. J Biol Chem, 2000, 275(2):959-968.
[4] Wang ZH. Research on the process optimization of erythromycin fermentation. Zhengzhou: Zhengzhou University, 2014. (in Chinese)王智慧. 红霉素发酵工艺优化研究. 郑州: 郑州大学, 2014.
[5] Qin XW, Chen H, Kuang JB, et al. Application of antifoam to baker' s yeast production. Liquor-Making Sci Technol, 2006, (12):87-89. (in Chinese)覃先武, 陈晖, 匡金宝, 等. 消泡剂在面包酵母生产中的应用. 酿酒科技, 2006, (12):87-89.
[6] Ge CC, Wang YS, Yu HW, et al. Study on foam and antifoaming agent.Dev Application Mater, 2010, 25(6):81-84. (in Chinese)葛成灿, 王源升, 余红伟, 等. 泡沫及消泡剂的研究进展. 材料开发与应用, 2010, 25(6):81-84.
[7] Zhou J, Wang JF, Hao YY, et al. Screening for antifoam with high performances based on its physical and physiological effects on the fermentation of biotechmycin. Acta Agric Univ Jiangxiensis, 2008,30(3):543-547. (in Chinese)周建, 王军峰, 郝玉有, 等. 基于必特螺旋霉素发酵过程物理和生理作用的消泡剂筛选. 江西农业大学学报, 2008, 30(3):543-547.
[8] Liu Y, Zhang HR, Zhao L, et al. Screening of the antifoams for fermentation of Sorangium cellulosum. J Qilu Univ Technol, 2014,28(1):5-8. (in Chinese)刘跃, 张红蕊, 赵林, 等. 纤维堆囊菌发酵所用消泡剂的筛选. 齐鲁工业大学学报, 2014, 28(1):5-8.
[9] Ma XM, Wang J, Kuang WF, et al. Effect of organic defoaming agent on conidial spore production of Trichoderma asperellum Trl48c in liquid fermentation process. Chem Bioeng, 2017, 34(3):40-44. (in Chinese)马晓梅, 王军, 旷文丰, 等. 有机消泡剂对棘孢木霉菌株Tr148c液体发酵分生孢子产量的影响. 化学与生物工程, 2017, 34(3):40-44.
[10] Wu Y, Liang XF, Liu HZ, et al. Production of nattokinaseby fed-batch fermentation. Food Fermentation Ind, 2018, 44(1):126-132. (in Chinese)吴燕, 梁向峰, 刘会洲, 等. 纳豆激酶分批补料发酵的研究. 食品与发酵工业, 2018, 44(1):126-132.
[11] Ren A, Li MJ, Shi L, et al. Profiling and quantifying differential gene transcription provide insights into ganoderic acid biosynthesis in Ganoderma lucidum in response to methyl jasmonate. PLoS One,2013, 8(6):e65027.
[12] Zhong JJ, Xu YN, Tan GY, et al. Signal transduction engineering: a powerful platform technology for enhancing secondary metabolite production. New Biotechnol, 2014, (31S):S23-S24.

