脓毒症休克患者行连续肾脏替代疗法的治疗时机探讨
黄巍
桂林医学院附属医院重症医学科,广西桂林 541001
脓毒症患者随着大量炎症介质的释放与组织变质、渗出的加剧,可逐渐发生全身各器官损伤,并进展至感染性休克、多器官功能衰竭[1]。连续肾脏替代疗法(CRRT)是一种连续、缓慢、等渗性清除液体和溶质的治疗技术,作为支持脏器功能和体外循环的血液净化方式,CRRT在脓毒症的治疗中发挥着不可替代的作用[2]。对于脓毒症患者而言,进入休克期前即开展CRRT治疗被认为能够有效提高组织灌注、改善预后质量[3]。此次研究以入院12 h为界限,就早期与非早期CRRT对脓毒症休克患者预后的影响进行观察,旨在为CRRT治疗时机的选择提供参考。
1 资料与方法
1.1 一般资料
回顾性分析2014年3月—2016年6月于我院接受CRRT治疗的96例脓毒症休克患者。患者均按照脓毒症休克国际诊断标准[4]确诊,年龄≥18岁并排除合并恶性肿瘤者、生存时间≤3 d者,以及接受其他肾脏替代治疗者。按照患者CRRT时机,将入院12 h内接受CRRT治疗的51例患者纳入早期CRRT组,将入院12 h后接受CRRT治疗的45例患者纳入非早期CRRT组。两组患者急性生理与慢性健康评分Ⅱ(APACHE Ⅱ)为24.26±3.55vs24.31±3.32,年龄、性别、体温(T)等比较,差异无统计学意义(P>0.05),本临床研究具有可比性。
1.2 治疗方案
两组患者均严格按照脓毒症休克治疗指南[5],接受复苏治疗、抗生素治疗、感染源控制、液体治疗等,同时给予血管加压剂、正性肌力药物、血液制品,并实施机械通气、血糖控制等,复苏目标[6]:平均动脉压(MAP)≥65 mmHg,尿量≥0.5 mg/(kg·h),中心静脉血氧饱和度(ScvO2)≥65%,中心静脉压8~12 mmHg。在此基础上,开展CRRT治疗,两组患者除CRRT时机外,其余治疗参数均相同,按照患者一般状况、每日液体出入量、个体化生理需求,选择合适的超滤量及CRRT清除率并适时调整[7];抗凝方案与文献[8]相同。
1.3 观察指标
比较两组患者治疗前后白细胞计数(WBC)、体温(T)及降钙素原(PCT)、C反应蛋白(CRP)等感染指标、肝肾功能变化,病死率及APACHE Ⅱ评分变化并对比其住院时间和费用。
1.4 统计学分析
对本临床研究的所有数据采用SPSS18.0进行分析,性别、病死率等计数资料以(n/%)表示,并采用χ2检验,年龄、感染指标、炎性指标等计量资料以(x±s)表示,并采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 感染指标
两组患者治疗7 d后WBC、T、PCT 、CRP、ESR、TNF-α、IL-1β、IL-6、IL-10均较治疗前下降,早期CRRT组治疗7 d后上述指标均低于非早期CRRT组,早期CRRT组治疗7 d后IL-6、IL-10均低于非早期CRRT组,差异均有统计学意义(P<0.05)。见表1。
2.2 肝肾功能
早期CRRT组治疗7 d后尿量较治疗前升高,SCr、BUN较治疗前下降;非早期CRRT组治疗7 d后ALT、AST、尿量较治疗前升高,但尿量低于早期CRRT组,差异有统计学意义(P<0.05)。见表2。
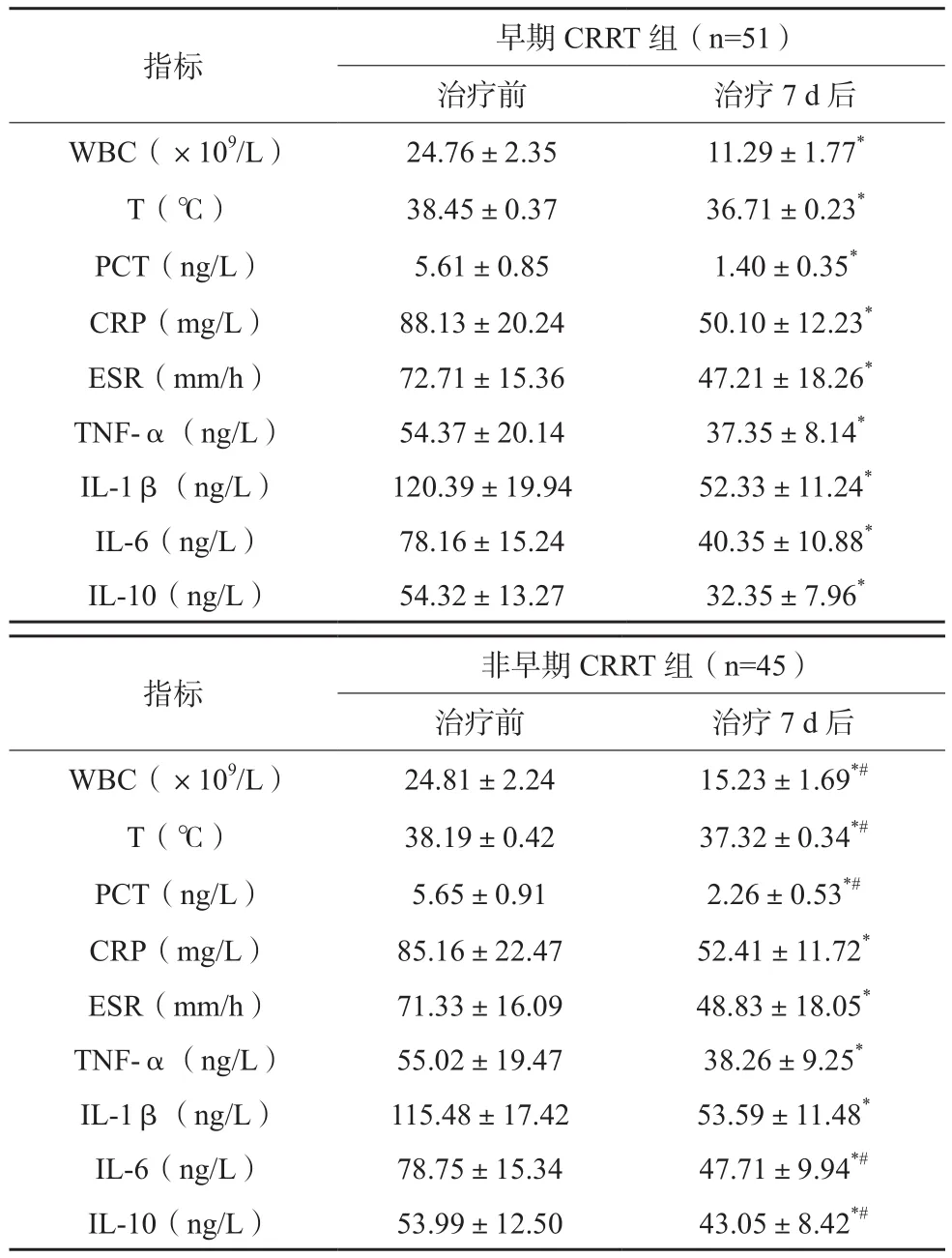
表1 两组患者感染指标变化比较(x±s)
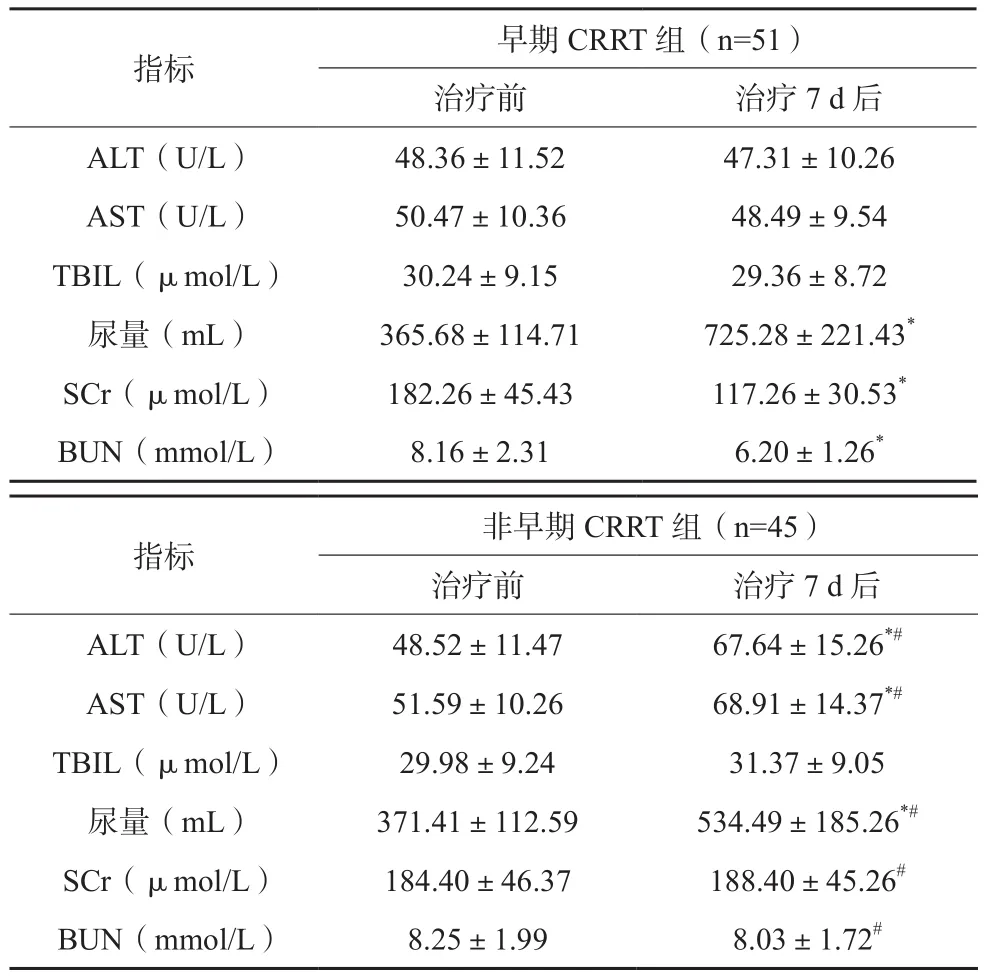
表2 两组患者肝肾功能变化比较(x±s)
2.3 住院情况及预后指标
两组患者治疗7 d后APACHE Ⅱ评分均较治疗前下降,早期CRRT组住院时间、治疗7 d后APACHE Ⅱ评分及病死率均低于非早期CRRT组,差异有统计学意义(P<0.05)。见表3。
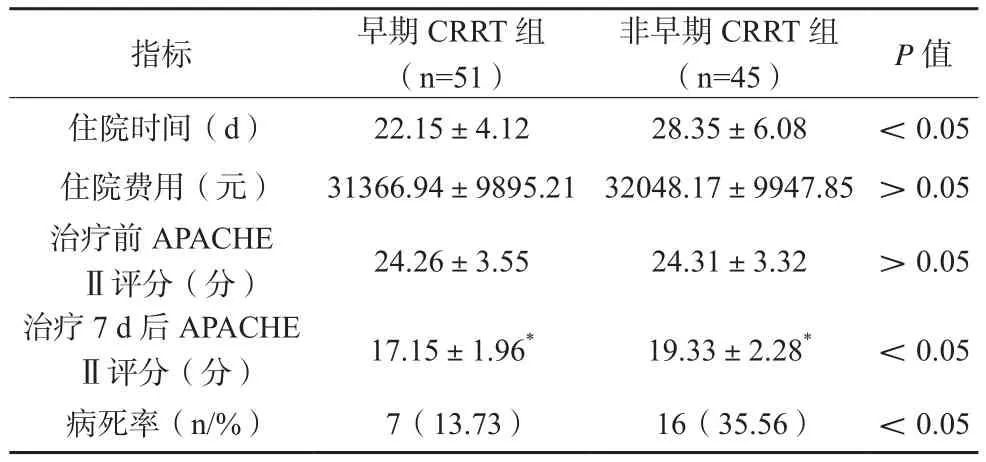
表3 两组患者住院情况及预后指标比较(x±s)
3 讨论
严重脓毒症患者病死率为25%~30%,而脓毒症休克患者病死率高达40%~70%[9]。作为一种体外连续性血液净化技术,CRRT能够有效控制脓毒症所致过度炎症反应和级联式的放大激活,在控制疾病发展、降低患者病死率方面具有重要意义,但目前关于脓毒症休克患者CRRT开展时机的选择尚存在争议,有学者认为,根据患者脏器功能变化、尿量、并发症发生情况判断CRRT时机能够避免能量、微量元素、氨基酸等必要物质的过量流失,减少机体负担[10],但也有学者指出,尽早开展CRRT方为挽救患者生命的关键[11]。
本研究96例患者的结果表明,与入院12 h后接受CRRT治疗的患者相比,入院12 h内行CRRT治疗能够更为明显地改善患者感染指标,并有效促进IL-6、IL-10的控制,说明早期开展CRRT能够有效调节机体细胞与体液免疫功能、控制细菌感染状态,从而减少炎症介质释放,恢复内环境稳态平衡,尽最大限度避免组织损伤的发生与发展,这主要得益于早期CRRT在清除各类炎性介质、内毒素等物质方面发挥的重要作用[12-14]。此外,有研究发现,早期开展CRRT能够使患者血流动力学参数得到更为明显的改善,而血流动力学的稳定对于促进机体各系统功能的维持和恢复有着重要意义[15]。
早期CRRT组治疗后尿量明显升高,SCr、BUN较治疗前下降,而非早期CRRT组治疗7 d后仍见AST、ALT、SCr升高,且尿量改善不及早期CRRT组,说明较晚的CRRT开展时机不仅无法有效改善患者全身炎症反应,而且不利于维持血流动力学稳定、改善组织器官灌注[16-17]。故早期CRRT组住院时间、治疗7 d后APACHE Ⅱ评分及病死率均低于非早期CRRT组。
与血液透析相比,CRRT能够利用吸附原理清除中等分子量的水溶性物质,即大部分炎症因子,因而在脓毒症休克的治疗中更为有效[18],本研究中早期开展CRRT并不会导致危重症患者自身状态的恶化,脓毒症休克患者已处于疾病发展的终末期,此时过度的炎症瀑布样进展是各类损伤反应的导火索,因此,尽早开展CRRT能够显著改善疾病转归。
综上所述,对于脓毒症休克患者而言,入院12 h内早期开展CRRT能够有效发挥抗炎作用、维持内环境稳定、保护全身脏器官功能,其确切的治疗效果与良好的安全性值得肯定。
[1] MISHRA S B, AZIM A, PRASAD N, et al. A pilot randomized controlled trial of comparison between extended daily hemodialysis and continuous veno-venous hemodialysis in patients of acute kidney injury with septic shock[J]. Indian J Crit Care Med, 2017, 21(5): 262.
[2] ULLDEMOLINS M, VAQUER S, LLAURADÓ-SERRA M, et al. Beta-lactam dosing in critically ill patients with septic shock and continuous renal replacement therapy[J]. Crit Care, 2014,18(3): 227.
[3] ZHANG Z, NI H, QIAN Z. Effectiveness of treatment based on PiCCO parameters in critically ill patients with septic shock and/or acute respiratory distress syndrome: a randomized controlled trial[J]. Intensive Care Med, 2015, 41(3): 444.
[4] 高戈, 冯喆, 常志刚,等. 2012国际严重脓毒症及脓毒性休克诊疗指南[J]. 中华危重病急救医学, 2013, 25(8):501-505.
[5] LEEDAHL D D, PERSONETT H A, GAJIC O, et al.Predictors of mortality among bacteremic patients with septic shock receiving appropriate antimicrobial therapy[J]. BMC Anesthesiol, 2014, 14(1): 21.
[6] MICHAUD J M, ZITTER J N, KAPLAN J, et al. Role of continuous renal replacement therapy ultrafiltrate cultures in the microbial diagnosis of sepsis[J]. Diagn Microbiol Infect Dis,2014, 79(4): 481-482.
[7] ULLDEMOLINS M, SOY D, LLAURADO-SERRA M, et al. Meropenem population pharmacokinetics in critically ill patients with septic shock and continuous renal replacement therapy: inf l uence of residual diuresis on dose requirements[J].Antimicrob Agents Chemother, 2015, 59(9): 5520-5528.
[8] 叶声, 方丽, 王迪芬, 等. CRRT对脓毒症急性肾损伤患者肾素活性、血管紧张素Ⅰ及醛固酮水平的影响[J]. 贵阳医学院学报,2016, 41(8): 963-966.
[9] BRUENGER F, KIZNER L, WEILE J, et al. First successful combination of ECMO with cytokine removal therapy in cardiogenic septic shock: a case report[J]. Int J Artif Organs,2015, 38(2): 113-116.
[10] 吴颖, 何再明, 党宗彦,等. 脓毒症患者持续液体正平衡与预后的关系分析[J]. 疑难病杂志, 2016, 15(12):1284-1288.
[11] HONORE P M, JACOBS R, HENDRICKX I, et al. Adjuvant vitamin C treatment in sepsis-how many oranges a day keep(vasopressor-dependent) septic shock away?[J]. J Thorac Dis,2016, 8(9): E993.
[12] CARLIER M, TACCONE F S, BEUMIER M, et al. Population pharmacokinetics and dosing simulations of cefepime in septic shock patients receiving continuous renal replacement therapy[J]. Int J Antimicrob Agents, 2015, 46(4): 413-419.
[13] IWAGAMI M, YASUNAGA H, NOIRI E, et al. Potential survival benef i t of polymyxin B hemoperfusion in septic shock patients on continuous renal replacement therapy: a propensitymatched analysis[J]. Blood Purif, 2016, 42(1): 9-17.
[14] 陈曹杰, 徐驰. 艾司洛尔对脓毒性休克患者血流动力学及炎症反应的影响[J]. 中国临床药理学与治疗学, 2017, 22(11):1274-1277.
[15] HONORE P M, JACOBS R, DE WAELE E, et al. Biomarkers to Detect Sepsis: A “Burning” Issue But Still a Long Way to Go[J].Crit Care Med, 2014, 42(9): 2137-2138.
[16] BRIDGES B C, SELEWSKI D T. The Role of Continuous Renal Replacement Therapy and Therapeutic Plasma Exchange in Sepsis[J]. J Pediatr Infect Dis, 2016, 11(3): 65-71.
[17] ROBERTS J A, ROBERTS D M. Antibiotic dosing in critically ill patients with septic shock and on continuous renal replacement therapy: can we resolve this problem with pharmacokinetic studies and dosing guidelines?[J]. Crit Care,2014, 18(3): 156.
[18] DABROWSKI W, KOTLINSKA-HASIEC E, SCHNEDITZ D, et al. Continuous veno-venous hemof i ltration to adjust fl uid volume excess in septic shock patients reduces intra-abdominal pressure[J]. Clin Nephrol, 2014, 82(1): 41-50.

