FTIR法研究蜜环菌降解前后榛子木材木质纤维素结构及成分的变化*
赵佳,刘雪峰,林海波,白云帆,刘静
(1.东北林业大学 林学院,黑龙江 哈尔滨 150040;2.肇东市林业局,黑龙江 肇东 151100)
近年来,红外光谱已成为有机结构和成分研究的常规手段。每一个化合物都具有特定的官能团,并能够形成特有的红外吸收光谱。根据不同化合物吸收光谱的位置、数目、形状和强度,可以确定某种化合物是否存在,并可以根据吸收峰强弱的变化,判断成分含量的变化[1]。目前,利用红外光谱法研究木材成分变化的研究日渐增多。如利用FTIR法研究出土木材化学结构和化学成分的变化;利用红外光谱法对木材腐朽菌降解材的成分进行研究[2-5]。
榛子(Corylushelerophylla)为榛科(Corylaceae)榛属(Corylus)植物,目前对榛子木材的研究并不多,仅有冯利群等人研究过榛子木材的构造、纤维形态及其化学成分[6]。蜜环菌(Armillariamellea)属伞菌目(Agaricales)蜜环菌属(Armillaria),蜜环菌与中药材天麻(Gastrodiaelata)有着特殊的共生关系[7],因此,蜜环菌及菌材的培养越来越受到人们的重视,蜜环菌对不同树种的利用也变得更加重要。近几年对蜜环菌菌材培养的研究较多,如黄明进等人选用贵州8种树材培养蜜环菌菌材,寻找适合天麻生产的蜜环菌菌材[8];任思竹等人研究蜜环菌对15种不同树种枝条的侵染效果[9],但蜜环菌对木材的降解作用及其对木材成分的影响却鲜有研究。
因蜜环菌多生长在浅山区的榛柴岗上,故又称榛蘑。因此,本文选用榛子木材作为试验原料,利用红外光谱法,研究蜜环菌对榛子木材的降解作用及其对木材成分的影响。本研究为蜜环菌菌材的培养提供依据,也为实现蜜环菌的人工栽培奠定基础。同时,以平茬的榛子木材作为蜜环菌侵染的试验原料和培养蜜环菌的基质,可实现木材资源的合理利用,对实际生产具有重要意义。
1 材料与方法
1.1 材料
采用高卢蜜环菌(Armillariagallica)编号mh,作为侵染榛子木材(后文简称榛材)的腐朽菌,购于黑龙江省科学院微生物研究所。试验榛材来源于大兴安岭加格达奇大黑山林场,3-4年生。
1.2 方法
1.2.1 蜜环菌的培养
蜜环菌易产生菌索,不利于其菌丝的产生,故经筛选发现ZD培养基(配方为蔗糖20g,蛋白胨5g,KH2PO43g,MgSO41.5g,琼脂20g,水1 000mL)对于蜜环菌菌丝的培养较适宜。因此,将蜜环菌接种到ZD培养基上,置25℃恒温培养箱中进行培养,菌丝长满平板后待用。
1.2.2 蜜环菌降解榛材室内试验
将4年生的野生榛子枝条(直径约为3-4mm)用枝剪剪成厚度为0.2cm的小木块(带皮),用高压灭菌锅于121℃灭菌30min后,放入长满蜜环菌菌丝的平板中,置于25℃恒温培养箱中分别培养40d、80d,用流动的水小心去除表面菌丝,放入105℃烘箱中烘至恒重。
1.2.3 蜜环菌降解榛材野外试验
在加格达奇大黑山地区,选择郁闭度适中、无积水的样地,挖长×宽为1.5m×1.6m,深5-10cm的坑窖,将培养好的蜜环菌二级种均匀的铺在坑窖底部,再铺1层榛材枝条,按照这个顺序共铺4层菌种,3层榛材枝条,表面再铺1层阔叶树的落叶。最后,覆土3-5cm,使表面土层略高于周围土层,以避免积水。定期观察菌丝及菌索侵染情况,试验满1年时取样。
1.2.4 榛材的红外光谱分析
将烘干小木块的树皮部分和木质部分别用研钵研磨,呈细粉状时,用傅里叶红外光谱分析仪FTIR(Nicolette 6 700、设备编号12002345、规格7 800-350cm-1),采用压片法进行红外光谱测定,实际测定范围为500-4 000cm-1。用Thermo Nicolet公司的omnic 8.0红外光谱分析软件进行图谱处理,得到最终红外光谱图。
2 结果与分析
2.1 健康榛材样品的FTIR图谱基本特征分析
健康榛材样品木质部(M-mmk)和树皮部分(P-mmk),经FTIR红外扫描后,结果如图1-图2所示。通过参照相关书籍和有关文献[1,10-14],确定该图谱中特征峰及归属,分析结果见表1。
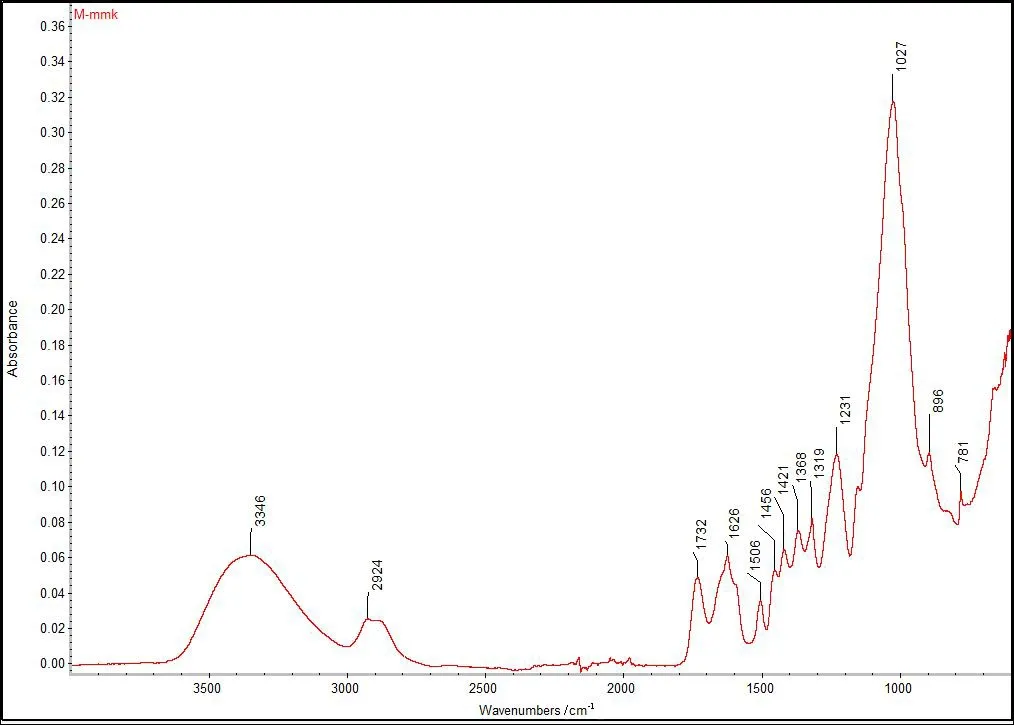
图1 健康榛材木质部样品的FTIR图谱
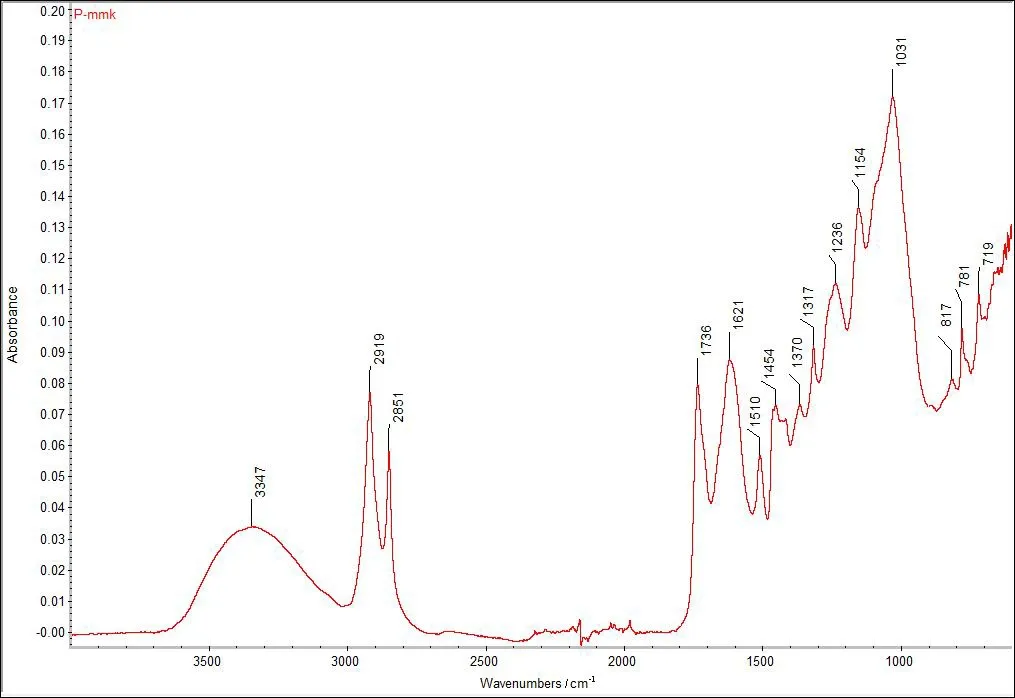
图2 健康榛材树皮部分样品的FTIR图谱
木材中主要成分是木质素、纤维素和半纤维素,后两者统称为综纤维素。微生物可以利用木材主要成分,实现对它的降解与利用[15-18]。在降解利用的过程中,木材的成分及结构发生变化,使其红外吸收光谱的吸收峰强弱和峰位也随之改变[19]。
根据图1和图2可知,在3 500-2 000cm-1区域,木质部有2个强吸收峰,树皮部分有3个强吸收峰,主要是羟基O-H的伸缩振动和亚甲基CH2的伸缩振动吸收峰,这说明榛材木质部和树皮部分中均含有大量的纤维素;1 732cm-1附近是乙酰基和羧基上的C=O伸缩振动,是半纤维素的特异吸收峰。榛材木质部和树皮部分中均存在该吸收峰,但位置不同,且强度也有所差别,说明木质部和树皮部分中的半纤维素的结构和含量不同;1 630-1 410cm-1区域,主要是苯环骨架振动吸收峰,说明榛材含有大量的木质素;1 400-890cm-1区域,主要是纤维素中C-H的弯曲震动,特别是榛材木质部吸收峰的896cm-1处为异头碳(C1)振动峰,是纤维素的特征吸收峰。另外,通过参考草酸钙的吸收光谱图分析可知[20],试验榛材树皮部分1 621cm-1处的强吸收峰和1 317cm-1处的中强吸收峰,以及木质部1 626cm-1处的强吸收峰和1 319cm-1处的中强吸收峰,为一水草酸钙(COM)特征吸收峰。
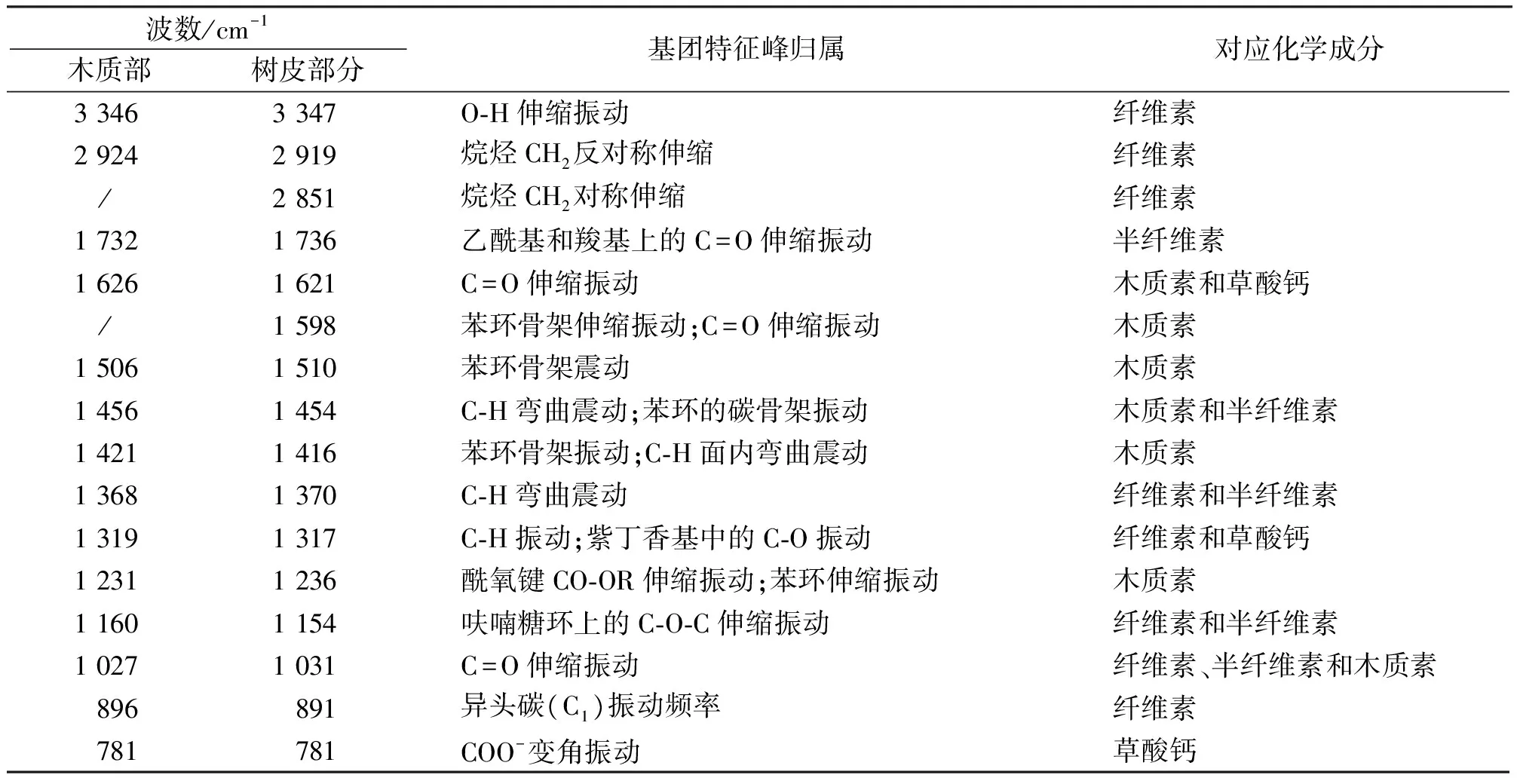
表1 健康木质部和树皮部分原粉样品红外光谱特征峰及归属
2.2 蜜环菌降解榛材的FTIR图谱分析
2.2.1 蜜环菌降解榛材木质部的FTIR图谱分析
随着蜜环菌降解时间的改变,试验榛材各成分吸收峰的强弱发生变化。经蜜环菌降解0d(M-mh0)、降解40d(M-mh40)、降解80d(M-mh80)和降解1年(M-mh1)的榛材木质部样品,经FTIR红外扫描后,对比结果见图3。
从蜜环菌对榛材木质部成分官能团的降解角度分析:榛材木质部经蜜环菌的降解,表征一水草酸钙(COM)的C=O不对称伸缩振动吸收(1 626cm-1)、愈创木基和紫丁香基中的C=O,C-H弯曲振动吸收峰(1 319cm-1)和COO-变角振动吸收峰(781cm-1)发生了明显变化。降解40d时,781cm-1和1 626cm-1处的吸收峰强度明显降低,说明一水草酸钙的官能团被破坏;80d时,781cm-1附近无明显吸收峰,说明一水草酸钙的官能团几乎均被破坏;1年时,1 626cm-1附近吸收峰强度明显强于健康榛材样品的吸收峰,781cm-1和1 319cm-1附近也重新出现了尖峰,说明一水草酸钙被重新合成,且合成量超过健康榛材中一水草酸钙原本的含量。另外,在榛材木质部被降解1年时,表征纤维素的烷烃CH2反对称伸缩吸收峰(2 924cm-1)被分成2个谱峰,说明综纤维素被降解。
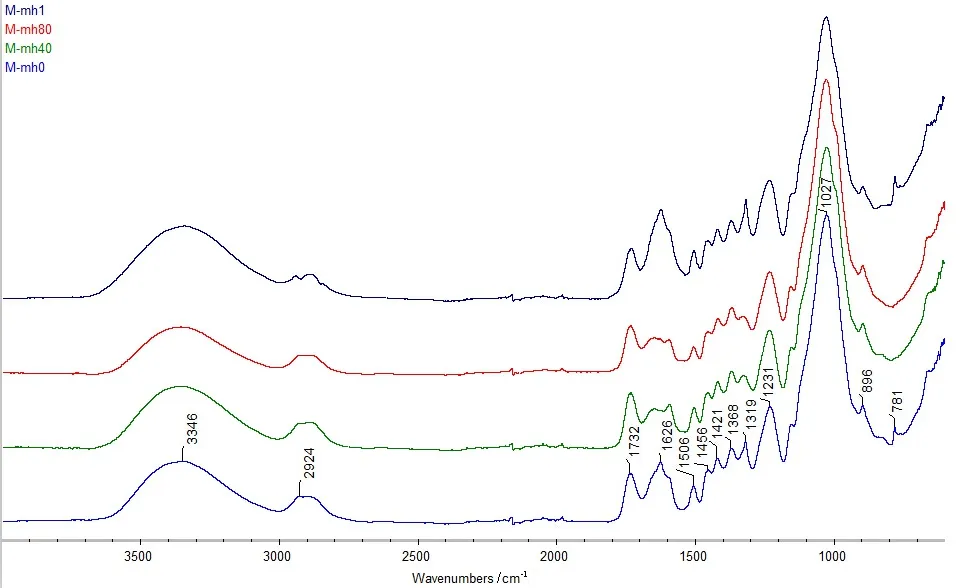
图3 蜜环菌降解材木质部样品的FTIR图谱
从蜜环菌对榛材木质部成分降解规律方面分析:蜜环菌对榛材木质部降解40d时,781cm-1吸收峰基本消失,说明一水草酸钙被破坏严重;80d时,1 319cm-1处吸收峰变弱,该变化可能由综纤维素官能团的改变引起,也可能是由一水草酸钙官能团的改变引起。因综纤维素的其他吸收峰均无明显变化,而一水草酸钙的其他吸收峰发生不明显的减弱,所以,蜜环菌降解80d的榛子木质部中的一水草酸钙继续被降解;1年时,一水草酸钙特征吸收峰明显增强,说明产生了大量草酸钙。木质素相关吸收峰(1 626cm-1、1 506cm-1、1 456cm-1、1 421cm-1和1 231cm-1)略有增强,同时,2 924cm-1被分成2个谱峰,说明综纤维素被降解。
2.2.2 蜜环菌降解榛材树皮部分的FTIR图谱分析
经蜜环菌降解0d(P-mh0)、降解40d(P-mh40)、降解80d(P-mh80)和降解1年(P-mh1)的榛材树皮部分样品,经FTIR红外扫描后,对比结果见图4。
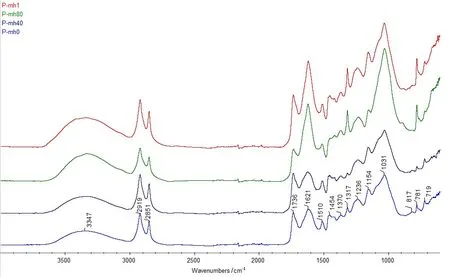
图4 蜜环菌降解材树皮部分样品的FTIR图谱
从蜜环菌对榛材树皮部分成分官能团的降解角度分析,榛材树皮部分经蜜环菌的降解,表征一水草酸钙(COM)的C=O不对称伸缩振动吸收峰(1 621cm-1)、愈创木基和紫丁香基中的C=O,C-H弯曲振动吸收峰(1 317cm-1)和COO-变角振动吸收峰(781cm-1)发生了明显变化。降解40d时,吸收强度减弱,说明其官能团被破坏,一水草酸钙被降解;降解80d和1年时,吸收强度明显高于健康榛材强度,说明其官能团重新合成,产生一水草酸钙,且占比重远超过健康榛材中的比重。在降解80d时,表征纤维素的烷烃CH2反对称伸缩吸收峰(2 919cm-1和2 851cm-1),强度低于其他样品吸收峰强度,说明纤维素被降解。同时,表征木质素和纤维素C=O伸缩振动吸收峰(1 031cm-1)强度明显高于其他降解时间和健康榛材样品的强度,说明木质素所占含量上升。对蜜环菌降解1年与降解80d的榛材树皮部分吸收峰光谱进行比较,发现2 919cm-1和 2 851cm-1附近强度增加,1 621cm-1、1 317cm-1和781cm-1附近峰强度几乎无变化,而1 031cm-1附近强度明显减弱,说明榛材树皮部分受蜜环菌降解1年时,木质素被降解。
从蜜环菌对榛材树皮部分成分降解规律方面分析:蜜环菌对榛材树皮部分降解40d时,一水草酸钙特征吸收峰(1 621cm-1、1 317cm-1和781cm-1)减弱,说明草酸钙含量发生变化。80d时,木质素相关吸收峰(1 621cm-1和1 031cm-1)明显增强,综纤维素相关吸收峰(2 919cm-1、2 851cm-1、1 736cm-1、1 454cm-1和1 154cm-1)减弱,说明综纤维素被大量降解。同时,一水草酸钙特征吸收峰(1 621cm-1、1 317cm-1和781cm-1)明显增强,说明产生了大量草酸钙。1年时,1 031cm-1处吸收峰显著减弱,该变化可能由木质素的降解引起,也可能是由综纤维素的降解引起。但由于综纤维素相关吸收峰2 919cm-1、2 851cm-1、1 736cm-1、1 454cm-1和1 154cm-1处均略有增强。说明降解1年时,木质素被蜜环菌(mh)降解。另外,对蜜环菌降解1年与降解80d榛材树皮部分的吸收峰进行对比,发现一水草酸钙的特征吸收峰无明显变化,说明草酸钙的含量未发生变化。
3 结论与讨论
本研究确定了健康榛材和腐朽榛材的主要成分为木质素、综纤维素和一水草酸钙。蜜环菌在降解过程中,使一水草酸钙(COM)的C=O不对称伸缩振动吸收峰(1 621cm-1)、纤维素的烷烃CH2反对称伸缩吸收峰(2 924cm-1)和木质素C=O伸缩振动吸收峰(1 031cm-1)等官能团遭到破坏。蜜环菌降解时间不同的榛材木质部和树皮部分材料中,各成分的吸收峰强弱不同。并且,随着降解时间的改变,榛子木材成分发生不同程度的变化。整体来看,在蜜环菌对榛材降解的初期,吸收峰1 626cm-1附近的C=O不对称伸缩振动和吸收峰781cm-1附近的COO-变角振动吸收峰逐渐减弱,甚至消失,说明一水草酸钙被蜜环菌破坏程度较大;中期,随吸收峰2 924cm-1附近烷烃CH2反对称伸缩吸收峰强度逐渐减弱,吸收峰1 626cm-1和781cm-1附近重新产生新峰,且新峰的强度明显高于健康榛材中该处吸收峰的强度。说明随着蜜环菌对综纤维素的降解,一水草酸钙重新生成,且生成量超过健康榛材中的含量。后期,在蜜环菌降解1年的榛材树皮部分中,木质素相关峰有部分变化,说明蜜环菌对木质素的降解能力小,且木质素较难降解。
本研究中,受蜜环菌(mh)菌株降解40d、80d的榛材在室内条件下完成,降解1年的榛材在野外环境中进行。相比之下,室内试验环境为其提供了良好的培养条件和营养基质,而野外环境中则存在更多的不可控因素,根据本试验的研究结果,可以看出野外条件下受蜜环菌降解1年的榛材,无论是在树皮部分还是木质部其降解程度都高于室内侵染80d的降解程度,证明了蜜环菌利用榛材栽培的野外试验的可行性。
同时,结合谭燕华等人对草酸钙结晶的研究[20],确定榛材的木质部和树皮部分均含有一水草酸钙,且该成分为蜜环菌对榛材降解利用的重要成分。刘喜明等人在研究巨尾桉(Eucalyptusgrandis×E.urophylla)脱落树皮的化学成分时也曾发现脱落树皮中存在一水草酸钙[21],说明一水草酸钙可能是木材成分中重要的组成部分,也可能是某些微生物对木材利用的重要能源物质。同时,试验中发现,综纤维素大量降解时,也是一水草酸钙大量产生时,说明可能是综纤维素的降解产生了一水草酸钙。在相关腐朽菌降解木材的相关文献中并未提到腐朽菌对一水草酸钙的降解[2,4,12],可能是忽略了该成分,也可能降解草酸钙是蜜环菌的特性,还有待于进一步研究。
参考文献:
[1]翁诗甫.傅里叶变换红外光谱分析[M].北京:化学工业出版社,2010.
[2]池玉杰.6种白腐菌腐朽后的山杨木材和木质素官能团变化的红外光谱分析[J].林业科学,2005,41(2):136-140.
[3]邓启平,李大纲,张金萍.FTIR法研究出土木材化学结构及化学成分的变化[J].西北林学院学报,2008,23(2):149-153.
[4]李改云,黄安民,秦特夫,等.马尾松木材褐腐降解的红外光谱研究[J].光谱学与光谱分析,2010,30(8):2133-2136.
中国小麦土壤氮素丰缺指标与适宜施氮量研究……………………………………… 孙洪仁,张吉萍,冮丽华,吕玉才,王应海(41)
[5]Pandey K K,Pitman A J.FTIR studies of the changes in wood chemistry following decay by brown-rot and white-rot fungi[J].International Biodeterioration & Biodegradation,2003,52(3):151-160.
[6]冯利群,牛耕芜,吴珊.榛子木材的构造、纤维形态及其化学成分的分析研究[J].内蒙古林学院学报,1997,19(3):87-91.
[7]张维经,李碧峰.天麻与蜜环菌的关系[J].植物学报,1980,22(1):57-62.
[8]黄明进,罗春丽,刘红昌,等.贵州8种树材对天麻蜜环菌生长的影响[J].贵州农业科学,2014,42(2):115-118.
[9]任思竹,陈青君,程继鸿.蜜环菌对15种不同树种枝条的侵染效果[J].中国农学通报,2014,30(22):69-73.
[10]赵瑶兴.有机分子结构光谱鉴定[M].北京:科学出版社,2003.
[11]周向葛.波谱分析[M].北京:化学工业出版社,2014.
[13]刘亚娜.基于近红外光谱技术的木材识别初步研究[D].北京:中国林业科学研究院,2014.
[14]庄琳,徐燕红.红豆杉与其他39种木材FT-IR特征的比较[J].湖北农业科学,2015,54(20):5129-5135.
[15]李坚.木材科学[M].哈尔滨:东北林业大学出版社,1994.
[16]张文婷,冀宪领,高绘菊,等.TrametestrogiiWT-1降解欧美杨107杨木质素的初步研究[J].林业科学,2011,47(6):128-132.
[17]Mafia R G,Santos P C,Demuner B J,etal.Eucalyptus wood decay:effects on productivity and quality of cellulose[J].Forest Pathology,2012,42(4):321-329.
[18]Sunardi,Tanabe J,Ishiguri F,etal.Changes in lignocellulolytic enzyme activity during the degradation ofPiceajezoensis,wood by the white-rot fungusPorodaedaleapini[J].International Biodeterioration & Biodegradation,2016,110:108-112.
[19]李坚.木材波谱学[M].北京:科学出版社,2003.
[20]谭燕华,欧阳健明,马洁,等.红外光谱法在草酸钙结石研究中的应用[J].光谱学与光谱分析,2003,23(4):700-704.
[21]刘喜明,陈瑞英,卢景龙,等.人工林巨尾桉脱落树皮化学成分研究[J].福建林学院学报,2011,31(4):372-375.

