八宝丹抑制胃癌细胞转移的作用研究
刘建鑫 ,尚海霞 ,杨 弘 ,魏丽慧 ,2,彭 军 ,2,庄群川 ,2,林久茂 ,2⋆
(1.福建中医药大学中西医结合研究院,福建 福州 350122;2.福建省中西医结合老年性疾病重点实验室,福建 福州 350122)
胃癌是最常见的恶性肿瘤之一,在全球范围内,每年约有100万新诊断患者和约74万胃癌患者死亡[1]。大多数胃癌患者在首诊时已是晚期阶段同时还伴有远端转移或局部浸润[2]。事实上,大部分癌症患者不是因为原位癌而死亡,而是转移癌。转移是恶性肿瘤的典型特征之一,显著增加了癌症相关死亡率[3]。在晚期胃癌患者治疗中,放化疗仍然是首选方法,常见化疗药物包括奥沙利铂、5-FU、司莫司汀等[4]。虽然还有越来越多的新药被研发出来并逐步推广,但胃癌患者的5 a生存率却不容乐观,只有 23%~32%[5],因此,治疗胃癌需要更加有效的药物。
八宝丹源自1555年宫廷秘方,至今已有460余年历史,组方包括麝香、羚羊角、牛黄、蛇胆、三七、珍珠6味名贵中药材[6],具有清利湿热、活血解毒、去黄止痛的功效,兼有辅助抗菌、调节机体免疫功能作用,长期服用可以减轻化疗药物的毒副作用,除肝胆疾病、泌尿系统疾病外,在恶性肿瘤、自身免疫性疾病以及其他疑难杂症的治疗方面也取得了良好的效果[6]。但是八宝丹对胃癌细胞的抑制作用及其分子机制尚不明确,因此,本文通过探讨八宝丹对胃癌细胞迁移能力的影响,为八宝丹的临床应用提供进一步的实验依据。
1 材料
1.1 药物和细胞株 八宝丹购自厦门中药厂股份有限公司(0.3 g/粒;生产批号:150930);人胃癌细胞株AGS和MGC803购自中科院上海细胞生物研究所,保存于福建中医药大学医学实验中心液氮中。
1.2 试剂与耗材 RPMI 1640培养基、胎牛血清(FBS)、双抗(青霉素、链霉素)、0.25%胰蛋白酶(Trypsin)、二甲亚砜(DMSO)购自美国 Gibco 公司;四甲基偶氮唑蓝(MTT)干粉(北京索莱宝科技有限公司公司);磷酸盐缓冲液(PBS)购自美国Hyclone公司。
1.3 仪器 超净工作台(苏州净化设备公司);CO2培养箱、-80℃冰箱(美国 Thermo公司);倒置显微镜系统(德国Leica公司);Countes?全自动细胞计数仪(美国 Life公司);全自动酶标仪(奥地利TECAN公司)。
2 方 法
2.1 BBD溶液制备 将八宝丹粉末,用磷酸盐缓冲液(PBS)配制成 25 mg/mL的溶液,超声溶解后高压灭菌,于4℃贮存备用。
2.2 细胞培养 将胃癌细胞株AGS、MGC803置于含 10%灭活胎牛血清(FBS)、100 U/mL青霉素和100 μg/mL链霉素的RPMI 1640完全培养基中,置于37℃含5%CO2饱和湿度的细胞培养箱中培养,分成对照组(0 mg/mL)、低剂量组(0.25 mg/mL)、中剂量组(0.5mg/mL)、高剂量组(0.75 mg/mL),各组给予相应剂量的BBD干预24 h。
2.3 MTT检测分析 取对数生长期的AGS和MGC803以0.8×105个/mL接于96孔培养板中,每孔 100 μL,置 37℃含 5%CO2培养箱中培养;当细胞汇合度达到50%~60%,吸弃培养液,每孔加入含不同浓度 BBD(0、0.25、0.5、0.75 mg/mL)培养液100 μL;培养 24 h 后每孔加入 MTT(0.5 mg/mL)100 μL继续培养4 h;然后吸弃液体并加入DMSO 100 μL/孔,室温放置 10 min,于全自动酶标仪 570 nm测定各组吸光度值(A值),并计算:
细胞生长抑制率/%=(1-实验组A值/对照组A值)×100%。
2.4 划痕实验分析 取对数生长期的AGS和MGC803细胞以2×105个/mL密度接种于6孔板,置于37℃细胞培养箱中培养过夜,细胞汇合度达到80%~90%时,进行划痕,并于不同时间点(0、6、12、24 h)进行拍照(×100)。不同浓度药物干预24 h后,以细胞划痕的愈合程度来判断BBD对肿瘤细胞迁移能力的影响。
2.5 Transwell实验 取对数生长期的AGS和MGC 803以2×105个/mL接种于6孔板中,每孔2 mL,置37℃含5%CO2培养箱中培养;当细胞汇合度达到50%~60%,吸弃孔内溶液,分别加含有不同浓度 BBD(终浓度分别为 0、0.25、0.5、0.75 mg/mL)的培养基,每孔2 mL;干预24 h后,吸弃各孔溶液,各孔分别进行消化,用不含胎牛血清的培养基重悬细胞;按5×104个/孔接种于Tranwell的上室(内室),下室于实验前2 h加0.7 mL含10%胎牛血清的培养基(置于37℃含5%CO2培养箱中);12 h后用棉签擦去Tranwell内室上层的细胞,其下层用结晶紫染色15 min,最后在倒置显微镜拍照(×100)。
2.6 粘附实验分析 取对数生长期的AGS和MGC803以2×105个/mL接种于6孔板中,每孔2 mL,置37℃含5%CO2培养箱中培养;当细胞汇合度达到50%~60%,吸弃孔内溶液,分别加含有不同浓度 BBD(终浓度分别为 0、0.25、0.5、0.75 mg/mL)的培养基,每孔2 mL;干预24 h后,吸弃各孔溶液,各孔分别进行消化,重悬,调整细胞密度为2×104个/mL,重新接种于6孔板中;培养 4 h后,吸弃各孔溶液,用PBS洗两遍,用0.1%结晶紫染色15 min,最后在倒置显微镜下拍照(×200)。
2.7 统计学方法 采用SPSS 22.0统计软件对数据进行处理。计量资料符合正态分布以(x±s)表示,采用t检验;计数资料采用χ2检验。
3 结 果
3.1 BBD对AGS和MGC803细胞活力的抑制率与对照组比较,BBD具有抑制AGS和MGC803细胞活力的作用,并呈剂量依赖性。见表1。
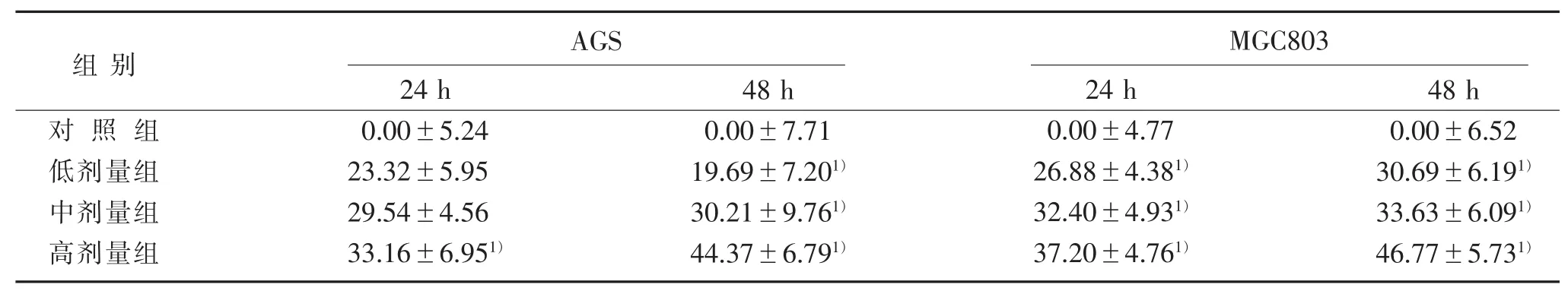
表1 BBD对AGS和MGC803细胞活动的抑制率(x±s)%
3.2 BBD对AGS和MGC803细胞损伤修复能力的影响 划痕结果显示:给药24 h后,对照组划痕距离明显缩短,而不同浓度BBD干预后能抑制划痕距离的缩短,即抑制细胞划痕愈合程度,并呈剂量依赖性。见图1、图2。

图1 BBD对AGS细胞损伤修复能力的影响(×100)
3.3 BBD对AGS和MGC803细胞迁移能力的影响 Transwell实验结果显示:在药物干预24 h后,对照组有较多的细胞穿过小孔膜,而不同浓度BBD干预后穿过小孔的细胞数量逐渐减少,呈剂量依赖性。见图3。
3.4 BBD对AGS和MGC803细胞粘附能力的影响 与对照组比较,不同浓度BBD干预后细胞的数目逐渐较少,并呈剂量依赖性。见图4。
4 讨 论
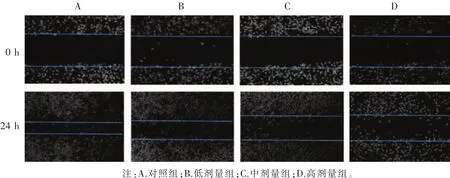
图3 BBD对MGC803细胞损伤修复能力的影响(×100)

图4 BBD对AGS和MGC803细胞迁移能力的影响(×100)

图5 BBD对AGS和MGC803细胞粘附能力的影响(×200)
目前胃癌仍以手术治疗为主,辅以化疗、放疗、生物治疗和中医药治疗等综合治疗[4,5]。但相关研究表明:局部进展期胃癌术后发病率为40%~70%,2次术后的5 a生存率不足25%[7],很多复发患者伴有远端转移和局部浸润,转移显著增加了癌症相关死亡率[2-3]。因此,寻找更加有效防治胃癌复发转移的治疗药物成为亟待解决的重要问题。现代医学治疗胃癌等恶性肿瘤的局限性使得临床疗效确切、毒副作用少的中药复方日益受到国内外研究者的重视。
八宝丹对包括胃癌在内的多种肿瘤具有明显的疗效,与放化疗联合使用可以起到减轻病人疼痛、改善临床症状、降低放化疗的毒副作用,延长患者生存期[8]。另外,基础研究表明八宝丹具有辅助抗菌、抗炎和调节机体免疫功能等作用[6]。但八宝丹对胃癌迁移和侵袭方面的药效作用及其作用机制尚不清楚。
在肿瘤转移的过程中,肿瘤细胞的生长活力、迁移能力、粘附能力等起了至关重要的作用。因此,本文观察八宝丹对肿瘤转移关键环节的影响,来研究八宝丹抑制胃癌细胞转移的作用。研究结果发现BBD能抑制AGS和MGC803细胞的活力,抑制细胞的损伤修复能力,抑制细胞的迁移能力,抑制细胞的粘附能力,并呈现明显的剂量依赖作用,提示BBD具有抑制胃癌细胞转移的作用。本研究为BBD临床治疗胃癌及防治胃癌细胞转移提供新的实验依据。
参考文献:
[1] JEMAL A,BRAY F,CENTER M M,et al.Global Cancer Statistics [J].CA Cancer J Clin,2011,61(2):69-90.
[2] PENG W H,TIEN Y C,HUANG C Y,et al.Fraxinus rhynchophylla ethanol extract attenuates carbon tetrachloride-induced liver fibrosis in rats via down-regulating the expressions of uPA,MMP-2,MMP-9 and TIMP-1 [J].J Ethnopharmacol,2010,127(3):606-613.
[3] MEHLEN P,PUISIEUX A.Metastasis:a question of life or death[J].Nat Rev Cancer,2006,6(6):449-458.
[4] JOTWANI R,ESWARAN S V,MOONGA S,et al.MMP-9/TIMP-1 imbalance induced in human dendritic cells by Porphyromonas gingivalis [J].FEMS IMmunol Med Microbiol,2010,58(3):314-321.
[5] ZHU X,LI J.Gastric carcinoma in China:current status and future perspectives (Review) [J].Oncol Lett,2010,1 (3):407-412.
[6] 柯樱,赵亚红.八宝丹的临床应用研究进展[J].中成药,2017,39(2):386-389.
[7] BANG Y J,KIM Y W,YANG H K,et al.Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy(CLASSIC):a phase 3 open-label,randomised controlled trial[J].Lancet,2012,379(9813):315-321.
[8] 李洪伦,刘瑾瑜,耿军祖,等.八宝丹在恶性肿瘤治疗中的应用探索[J].滨州医学院学报,2016,39(5):383-385.

