度洛西汀对抑郁症大鼠行为及海马和前额叶皮质中S100B基因甲基化的影响
董 娇,冀紫阳,谷景阳,邵秋静,王长虹
(新乡医学院第二附属医院临床精神卫生学教研室,河南 新乡 453002)
随着生活压力的增加,抑郁症发病率越来越高,据统计,到2020年抑郁症将成为全球第2大致残性疾病[1-2],但目前其发病机制尚不明确。研究发现,神经胶质细胞在抑郁症尤其是难治性抑郁症的发病中起到重要作用[3-4],而S100B作为神经胶质细胞的主要标志物,被认为是抑郁症的筛选指标,且是表观遗传的重要基因[5]。表观遗传学是研究在无细胞核DNA序列改变的情况下,基因功能的可逆的、可遗传的改变,DNA甲基化是其最重要的表观遗传修饰方式之一。最近的研究显示,S100B蛋白表达变化可能取决于S100B基因调控区的DNA甲基化程度[6],而关于S100B基因甲基化在抑郁症治疗中的作用尚未见报道。度洛西汀为常用的抗抑郁剂,研究显示,其能够激活抑郁模型大鼠海马和前额叶皮层S100B蛋白活性[7]。本研究通过对大鼠进行慢性不可预见性温和应激(chronic unpredictable mild stress,CUMS)建立抑郁模型,以选择性5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitor,SSRI)度洛西汀为干预药物,从表观遗传学层面探讨S100基因甲基化在度洛西汀治疗抑郁症中的作用。
1 材料与方法
1.1实验动物30只清洁级雄性Sprague-Dawle大鼠,体质量200~300 g,喂养于湿度40%~50%、温度(24±1) ℃的独立通气笼系统,自由摄食、水。大鼠购于北京维通利华实验动物技术有限公司,许可证号:SCXK (京) 2012-0001,质量合格证号:11400700139232。
1.2药物、试剂与仪器盐酸度洛西汀肠溶胶囊(美国礼来亚洲公司,批准文号:H20150287),血液基因组DNA提取试剂盒DP304(北京天根生化科技有限公司),引物合成、SK2072-N聚合酶链反应(polymerase chain reaction,PCR)扩增试剂盒(上海生工生物工程股份有限公司),D5005 DNA甲基化修饰试剂盒(美国Zymo公司),DL500DNA Marke(大连宝生工程科技有限公司);CH20光学显微镜(日本Olympus公司),DM2000图像采集系统(德国徕卡公司),大鼠DBA-2型程控避暗箱(上海软隆科技发展有限公司),ZF-1B紫外透射分析仪(上海嘉鹏科技有限公司)。
1.3实验方法
1.3.1实验分组30只大鼠采用随机数字表法分为对照组、抑郁症组和度洛西汀组,每组10只。
1.3.2抑郁症大鼠模型制作抑郁症组和度洛西汀组大鼠均孤养,并给予42 d CUMS,制备抑郁症模型;对照组大鼠以每笼3只正常环境饲养6周,不给予CUMS。CUMS包括:电击足底(电压60 V,电流1 mA,每次15 s,间隔35 s刺激1次,共20次)、摇晃鼠笼(频率为1次·s-1,10 min)、强迫游泳(水温 4 ℃,水深约35 mm,每次5 min,每日1次)、夹尾(使用大卵圆钳夹住大鼠尾部近体1/3处,每次 2 min)、热应激(大鼠装入狭口瓶置于45 ℃恒温箱5 min)、禁食24 h、禁水24 h、噪音刺激(1 500 Hz,95 dB,每日1 h)、潮湿垫料24 h(将260 mL水加入有锯末的鼠笼)、120 min行为限制(将大鼠的头部置于行为限制筒的开口端,不可影响其呼吸)。以上各种刺激随机排列,每种刺激使用少于3次,且同种刺激不可以连续出现,使大鼠不能预测刺激的发生。
1.3.3药物干预度洛西汀组大鼠于实验第22~42天的7:30给予度洛西汀7.5 mg·kg-1·d-1(溶于1 mL生理盐水中)灌胃,连续治疗21 d。对照组和抑郁症组大鼠不给予任何干预。
1.4观察指标
1.4.1大鼠行为学评估分别于造模前(实验前)、造模后(实验第21天)及药物干预后(实验第42天)对3组大鼠进行体质量测定、旷场实验及避暗实验,评估大鼠行为学变化。(1)体质量。(2)旷场实验:先将大鼠放入场箱正中的方格内,观察并记录5 min内大鼠水平运动和垂直运动评分。大鼠穿越底面方格数为水平运动分数,4只爪均进入同一个方格内计1分,但若大鼠沿着线走,每走10 cm计1分。以大鼠后肢直立次数为垂直运动分数,大鼠2只前爪抬起或抓附箱壁,离开箱底1 cm为准,待大鼠放下前爪才可计1分。旷场实验于8:00~12:00 进行,保持房间安静,每次都由相同的2人观察记录。每只大鼠观测后要打扫干净箱底,才可进行下一只大鼠的观测。(3)避暗实验:大鼠DBA-2型程控避暗箱有2间反应箱,可分为明箱和暗箱,箱间隔板上有1个直径3 cm的圆形洞口,明箱和暗箱底部都装有铜栅,暗箱底部铜栅通36 V的电刺激,明箱底部则不通电,训练时将大鼠放入明室中,先适应环境3 min,然后通电,大鼠因嗜暗性钻入暗室进而遭受到电击,此时大鼠可从暗室自行逃回明室,获得记忆,如此训练5 min;24 h后重新开始测试,测试时先通电,然后将大鼠放入明室,同时开始计时间,记录从大鼠放入明室至第1次进入暗室遭到电击的时间(即为潜伏期)。
1.4.2DNA甲基化的检测(1)标本采集:3组大鼠最后一次行为评估后给予100 g·L-1水合氯醛(3 mL·kg-1)腹腔注射麻醉,将其固定在手术台上,快速断头,取右半球海马和前额叶皮质组织置入收集管中,液氮中保存,备用。(2)提取样品基因组DNA:液氮冰冻研磨组织样品后经反复离心,最后收集溶液于EP管中,提取的DNA样本于-20 ℃保存。(3)基因组DNA的亚硫酸氢盐修饰:将20 μL DNA样品和130 μL CT Conversion reagent添加到PCR管中,充分混匀,98 ℃放置10 min,64 ℃放置2.5 h,添加600 μL的M-结合缓冲液至Zymo-Spin IC柱中,将Zymo-Spin IC柱放入收集管中,充分混合样品,全速(>10 000 r·min-1)离心30 s,除去流出液,添加100 μL的M-洗涤缓冲液(M-Wash Buffer)到Zymo-Spin IC柱中,12 000 r·min-1离心30 s,添加200 μL的M-脱磺化缓冲液至Zymo-Spin IC柱中,室温(20~30 ℃)下放置15~20 min,培养后12 000 r·min-1离心30 s,再重复2次添加 200 μL 的M-洗涤缓冲液到Zymo-Spin IC柱中,12 000 r·min-1离心30 s,最后添加10 μL的M-洗脱缓冲液到Zymo-Spin IC柱基质中,将Zymo-Spin IC柱放置于 1.5 mL 的离心管中,12 000 r·min-1离心30 s洗脱DNA;处理过的DNA 可立即进行分析或-70 ℃冰箱保存待测。(4)甲基化特异性PCR:S100B甲基化特异性引物序列:上游为5′-TTAGTTTTAGTTACGGATAGATGCG-3′,下游为5′-CACAAAAAA-AATACTAAAAATCGAA-3′;S100B非甲基化特异性引物序列:上游为5′-TAGTTTTAGTTATGGATAGATGTGG-3′,下游为5′-CACAAAAAAAATACTAAAAATCAAA-3′。PCR总反应体系为50 μL,Sterilized ddH2O 25 μL,2×PCR Master 22 μL,DNA模板 1 μL,上游引物(10 μmol·L-1) 2 μL,下游引物(10 μmol·L-1) 2 μL。PCR扩增条件:95 ℃预变性5 min;94 ℃ 30 s,58 ℃40 s,72 ℃ 50 s,共35个循环;72 ℃延伸5 min。(5)25 g·L-1琼脂糖凝胶电泳:PCR产物进行琼脂糖凝胶电泳 40 min,经紫外透射分析仪观察电泳结果,DM2000图像采集系统摄取图像,实验重复3次。
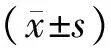
2 结果
2.13组大鼠行为学指标比较结果见表1。造模前3组大鼠行为学指标比较差异均无统计学意义(P>0.05)。对照组大鼠造模前、造模后及干预后旷场实验中水平运动评分、垂直运动评分及避暗实验中潜伏期比较差异均无统计学意义(P>0.05)。与造模前比较,造模后抑郁症组、度洛西汀组大鼠旷场实验中水平运动评分、垂直运动评分减少,避暗实验中潜伏期延长,差异均有统计学意义(P<0.05)。造模后抑郁症组与度洛西汀组大鼠行为学指标比较差异均无统计学意义(P>0.05)。与对照组比较,造模后抑郁症组、度洛西汀组大鼠体质量降低,旷场实验中水平运动评分、垂直运动评分减少,避暗实验中潜伏期延长,差异均有统计学意义(P<0.05)。与造模后比较,干预后度洛西汀组大鼠旷场实验中水平运动评分、垂直运动评分增加,潜伏期缩短,差异均有统计学意义(P<0.05)。与抑郁症组比较,干预后度洛西汀组大鼠体质量及旷场实验中水平运动评分、垂直运动评分增加,潜伏期缩短,差异均有统计学意义(P<0.05)。
表13组大鼠行为学表现比较
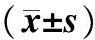
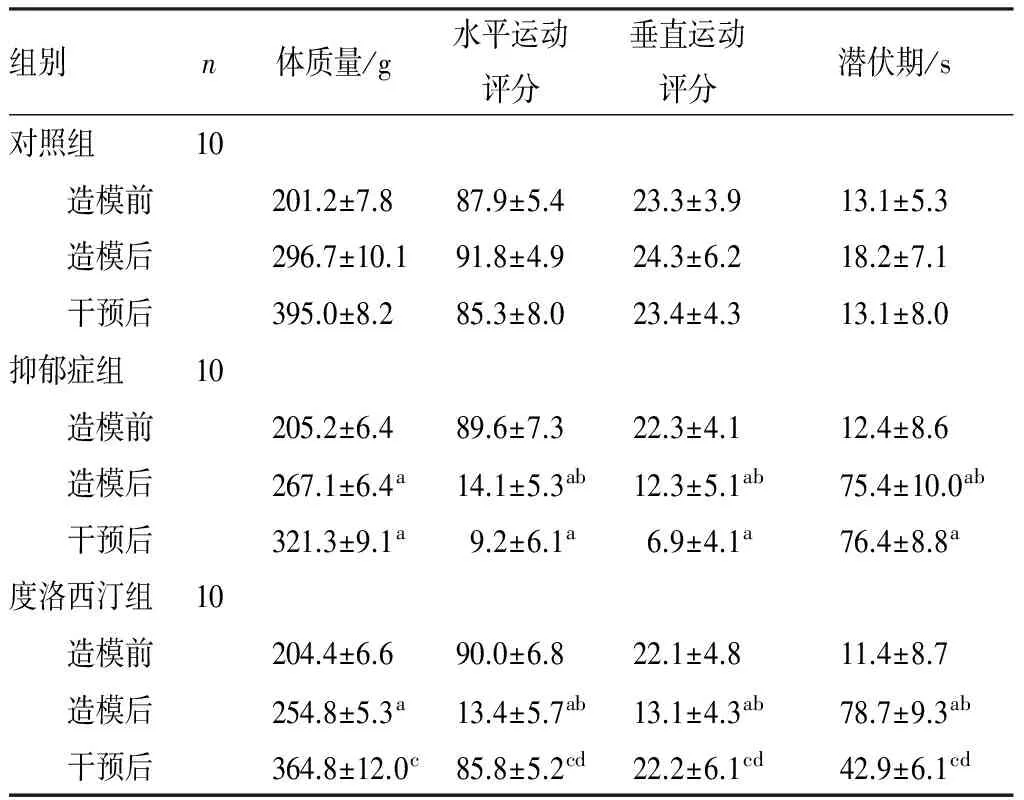
组别n体质量/g水平运动评分垂直运动评分潜伏期/s对照组10 造模前201.2±7.887.9±5.423.3±3.913.1±5.3 造模后296.7±10.191.8±4.924.3±6.218.2±7.1 干预后395.0±8.285.3±8.023.4±4.313.1±8.0抑郁症组10 造模前205.2±6.489.6±7.322.3±4.112.4±8.6 造模后267.1±6.4a14.1±5.3ab12.3±5.1ab75.4±10.0ab 干预后321.3±9.1a9.2±6.1a6.9±4.1a76.4±8.8a度洛西汀组10 造模前204.4±6.690.0±6.822.1±4.811.4±8.7 造模后254.8±5.3a13.4±5.7ab13.1±4.3ab78.7±9.3ab 干预后364.8±12.0c85.8±5.2cd22.2±6.1cd42.9±6.1cd
注:与对照组比较aP<0.05;与造模前比较bP<0.05;与抑郁症组比较cP<0.05;与造模后比较dP<0.05。
2.23组大鼠海马及前额叶皮质中S100B基因甲基化比较结果见图1和图2。3组大鼠海马及前额叶皮质中所提取的S100B基因均未检出甲基化条带。
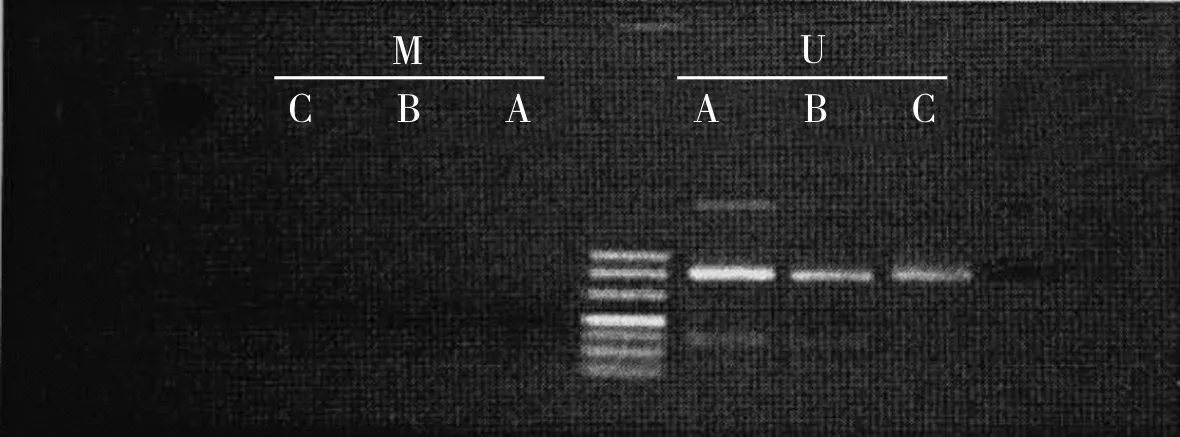
注:M:甲基化;U:非甲基化;A:对照组;B:抑郁症组;C:度洛西汀组。
图13组大鼠海马组织中S100B基因甲基化
Fig.1MethylationofS100Bgeneinthehippocampusofratsinthethreegroups

注:M:甲基化;U:非甲基化;A:对照组;B:抑郁症组;C:度洛西汀组。
图2前额叶皮质中S100B基因甲基化
Fig.2MethylationofS100Bgeneintheprefrontalcortexofratsinthethreegroups
3 讨论
抑郁症的发病机制主要与单胺类神经递质减少、下丘脑-垂体-肾上腺皮质轴功能紊乱、神经营养因子分泌失调、炎症反应等因素有关,但其确切机制尚不明确[8]。研究表明,各种应激性生活事件特别是长期的慢性压力与抑郁症的发生有一定的正相关性[9],而抗抑郁剂可以纠正这种抑郁症状[10]。
目前,国内外广泛应用CUMS制备抑郁症动物模型,使其发病机制与人类抑郁症更加相近[11]。本实验结果显示,CUMS刺激21 d后,大鼠表现出体质量增长缓慢、运动能力下降、学习和记忆能力下降(避暗实验潜伏期延长)等抑郁症表现,表明成功建立了抑郁模型。与抑郁症组比较,度洛西汀组大鼠在造模成功后干预21 d,其运动能力增强,学习和记忆能力提高,表明抑郁症表现得到改善,说明度洛西汀能够改善抑郁模型大鼠的行为学表现。
S100B主要由神经胶质细胞分泌,CUMS可造成神经元损伤并使S100B表达升高,影响海马及前额叶皮层的神经再生及可塑性,这种影响在有利的环境中可增强治疗效果,在恶劣的环境中可增加精神疾病的风险[12]。RONG等[13]研究认为,S100B蛋白可能通过影响星形胶质细胞分泌而在抑郁症发生及抗抑郁剂治疗中发挥重要作用。但有研究者认为,S100B表达升高虽然可能是重度或急性抑郁症的生物学标志物,但其水平可能与抑郁症的严重程度无相关性,治疗后S100B表达水平有相应的波动,但并不能反映治疗的临床疗效变化[14-16]。王国栋等[17]研究认为,抗抑郁剂可以逆转抑郁大鼠海马组织内S100B高表达,但并非其抗抑郁作用机制。

参考文献:
[1] COOPER S L,GRAHAM A W,GOSS C W,etal.Unhealthy and unsafe practices associated with symptoms of depression among injured patients[J].IntJInjContrSafPromot,2011,18(3):243-248.
[2] SONG X,LI N,LIU J,etal.Depression and its influencing factors among mothers of children with birth defects in China[J].MaternChildHealthJ,2012,16(1):1-6.
[3] KIM Y K,NA K S.Role of glutamate receptors and glial cells in the pathophysiology of treatment-resistant depression[J].ProgNeuropsychopharmacolBiolPsychiatry,2016,70:117-126.
[4] RAJEWSKA-RAGER A,PAWLACZYK M.The role of S100B protein as a potential marker in affective disorders[J].PsychiatrPol,2016,50(4):849-857.
[5] GULEN B,SERINKEN M,EKEN C,etal.Serum S100B as a surrogate biomarker in the diagnoses of burnout and depression in emergency medicine residents[J].AcadEmergMed,2016,23(7):786-789.
[7] 杨坤,于雪,王敬兰,等.度洛西汀对早期应激模型大鼠行为及海马和前额皮层星形胶质源性蛋白表达的影响[J].中国慢性病预防与控制,2015,23(5):331-334.
[8] 庞珍珍,詹合琴,陈正跃,等.甜叶菊正丁醇提取物对抑郁小鼠肝脏单一免疫球蛋白白细胞介素1受体相关蛋白和核转录因子κB表达的影响[J].中华实用儿科临床杂志,2016,31(19):1480-1483.
[9] 赵幸福,徐一峰.生活事件和抑郁症[J].上海精神医学,1995,7(3):209-211.
[10] WILLNER P.Validation creteria for animal models of human mental disorders:learned helplessness as a paradigm case[J].ProgNeuropsychopharmalolBiolPsychiatry,1986,10(6):677-690.
[11] 赵利芹,李晏,邵秋静,等.丰富环境对抑郁大鼠行为学及海马组织中丝裂原活化蛋白激酶磷酸酶-1表达的影响[J].新乡医学院学报,2017,34(9):798-802.
[12] BUSEHERT J,HOHOFF C,TOUMA C,etal.S100B overexpression increases behavioral and neural plasticity in response to the social environment during adolescence[J].JPsyehiatrRes,2013,47(11):1791-1799.
[13] RONG H,WANG G,LIU T,etal.Chronic mild stress induces fluoxetinereversible decreases in hippoeampal and cerebruspinal fluid levels of the neurotrophic factor S100B and its specific receptor[J].IntJMolSci,2010,11(12):5310-5322.
[14] FANG Y,XIAO S F,ZHANG S Y,etal.Increased plasma S100B level in patients with major depressive disorder[J].CNSNeurosciTher,2016,22(3):248-250.
[15] TSAI M C,HUANG T L.Increased activities of both superoxide dismutase and catalase were indicators of acute depressive episodes in patients with major depressive disorder[J].PsychiatryRes,2016,235(1):38-42.
[16] AMBRÉE O,BERGINK V,GROSSE L,etal.S100B serum levels predict treatment response in patients with melancholic depression[J].IntJNeuropsychopharmacol,2016,19(3):1-9.
[17] 王国栋,董娇,李晏,等.慢性应激抑郁模型大鼠海马组织S100B表达及氟西汀的干预作用[J].中华行为医学与脑科学杂志,2013,22(11):978-981.
[18] SONG Y,MIYAKI K,SUZUKI T,etal.Altered DNA methylation status of human brain derived neurotrophis factor gene could be useful as biomarker of depression[J].AmJMedGenetBNeuropsychiatrGenet,2014,165(4):357-364.
[19] MALUP T K,KOBZEV V F,ZHDANOVA L G,etal.Methylation of CpG dinucleotides in the promoter region of the gene encoding the S100B protein inBALB/cLacmice[J].DoklBiochemBiophys,2007,412(1):1-3.

