卡托普利对重症急性胰腺炎致肺损伤大鼠的保护机制
杨敏
重症急性胰腺炎(SAP)是因胰蛋白酶异常分泌产生自身消化作用的疾病,发病急骤,死亡率高,在其发生发展的过程中对多器官多系统造成严重损害[1]。据统计,65%的SAP患者死于急性肺损伤所致的急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)[2]。研究表明,SAP致肺损伤的病理表现主要为肺泡壁广泛损伤、大量中性粒细胞浸润和肺间质出血,而血管紧张素转化酶抑制剂对上述病理改变具有一定抑制作用[3]。本研究旨在分析卡托普利对SAP致肺损伤大鼠的保护机制。
一、材料与方法
1.动物与分组:健康SD雄性大鼠54只,购自第二军医大学动物实验中心,许可证号:SYXK(沪)2015-0039SD,体重250~300 g,鼠龄7~8周,根据随机数字表法将其分为假手术组、急性坏死性胰腺炎(ANP)组和干预组,每组18只。
2.试剂:10%水合氯醛溶液购自江莱生物公司;5%牛磺胆酸钠及肿瘤坏死因子-α(TNF-α)试剂盒购自美国Sigma公司;卡托普利注射液购自常州制药厂有限公司。
3.大鼠ANP模型建立:10%水合氯醛溶液(0.5 ml/100 g)腹腔注射麻醉,采用胰管逆行注射5%牛磺胆酸钠0.1 ml/100 g体重的方法制备ANP模型。假手术组注射等容积生理盐水。干预组在造模前20 min腹腔注射卡托普利0.5 mg/100 g体重。造模后6、12、24 h分批处死大鼠,每个时间点随机处死6只。
4.肺组织TNF-α含量检测:取大鼠相同部位肺组织0.5 g,用冰生理盐水冲洗后制备成组织匀浆,3 500 r/min离心20 min,取上清液,通过酶联免疫吸附法检测大鼠肺组织TNF-α含量。
5.肺组织含水量检测:取大鼠相同部位肺组织0.5 g(湿重)置入电热干燥箱内,65℃烘烤12 h后称取干重,肺组织含水量=(肺湿重-肺干重)/肺干重。
6.肺微血管通透性检测:处死大鼠前15 min向其左侧股静脉注射异硫氰酸荧光素标记的血清蛋白(0.5 mg/100 g),将18号血管导管插入气管,用5 ml磷酸盐缓冲液灌洗肺泡腔3次,收集肺泡灌洗液。取大鼠尾静脉血1 ml,经抗凝、离心等处理后获得血清,用荧光分光光度计测量肺泡灌洗液和血清中的荧光值,发射光490 nm,激发光443 nm。肺微血管通透性=肺泡灌洗液荧光值/血清荧光值。
7.肺组织病理学检查及评分:取剩余肺组织,经固定、脱水、透蜡后包埋成蜡块,切片后行HE染色、封片。每张切片随机取5个高倍镜视野,于显微镜下观察其组织形态,根据Kusske等[4]的标准进行肺组织病理评分。0分:无水肿、炎细胞浸润和出血;1分:肺泡壁轻度水肿,肺间质少量白细胞浸润,出血范围<25%;2分:肺泡壁中度水肿,肺间质较多白细胞浸润,出血范围25%~50%;3分:肺泡壁重度水肿,大部分肺间质及肺泡白细胞浸润,出血范围>50%。
二、结果
1.3组肺组织TNF-α含量及含水量比较:随着时间的延长,ANP组和干预组TNF-α含量及含水量均有所升高,同组不同时间点比较差异均有统计学意义(P值均<0.05)。ANP组各时间点大鼠肺组织TNF-α含量及含水量显著高于干预组,干预组又显著高于假手术组,差异均有统计学意义(P值均<0.05,表1、2)。

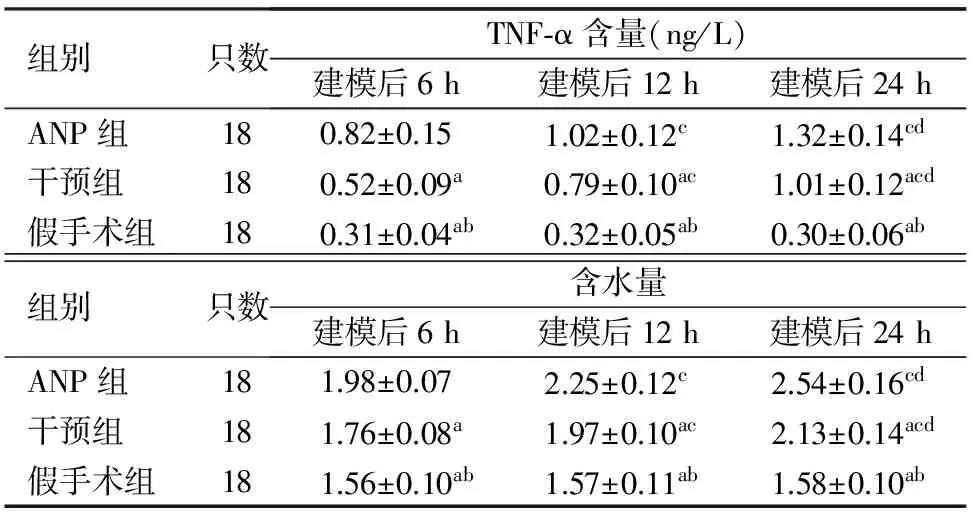
组别只数TNF⁃α含量(ng/L)建模后6h建模后12h建模后24hANP组180.82±0.151.02±0.12c1.32±0.14cd干预组180.52±0.09a0.79±0.10ac1.01±0.12acd假手术组180.31±0.04ab0.32±0.05ab0.30±0.06ab组别只数含水量建模后6h建模后12h建模后24hANP组181.98±0.072.25±0.12c2.54±0.16cd干预组181.76±0.08a1.97±0.10ac2.13±0.14acd假手术组181.56±0.10ab1.57±0.11ab1.58±0.10ab
注:与ANP组比较,aP<0.05;与干预组比较,bP<0.05;与建模后6 h比较,cP<0.05;与建模后12 h比较,dP<0.05
2.3组肺微血管通透性比较:随着时间的延长,ANP组和干预组肺微血管通透性均有所升高,同组不同时间点比较差异均有统计学意义(P值均<0.05)。ANP组各时间点大鼠肺微血管通透性显著高于干预组,干预组又显著高于假手术组,差异均有统计学意义(P值均<0.05,表2)。

表2 3组肺微血管通透性比较
注:与ANP组比较,aP<0.05;与干预组比较,bP<0.05;与建模后6 h比较,cP<0.05;与建模后12 h比较,dP<0.05
3.3组肺组织病理学改变:假手术组肺组织形态完整,结构清晰,肺泡壁边缘光滑,无出血及白细胞浸润;ANP组可见肺组织弥漫性充血水肿,大量白细胞浸润,肺泡壁结构被破坏;干预组肺组织充血水肿程度较ANP组轻,少量白细胞浸润,部分肺泡壁结构被破坏(图1)。ANP组和干预组肺组织病理学评分随着时间的延长均升高,同组不同时间点差异均有统计学意义(P值均<0.05)。ANP组各时间点的大鼠肺组织病理学评分显著高于干预组,干预组又显著高于假手术组,差异均有统计学意义(P值均<0.05,表3)。
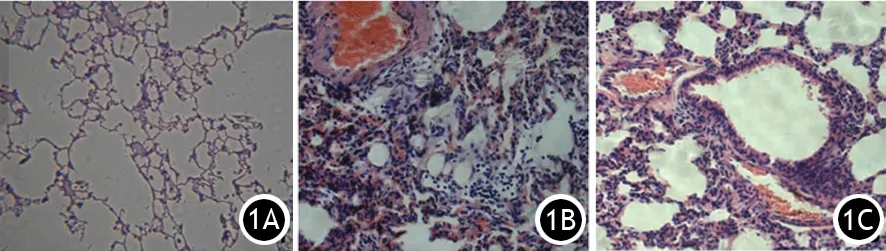
图1 假手术组(1A)、ANP组(1B)、干预组(1C)大鼠肺组织病理学改变(HE ×100)

表3 3组肺组织病理学评分比较
注:与ANP组比较,aP<0.05;与干预组比较,bP<0.05;与建模后6 h比较,cP<0.05;与建模后12 h比较,dP<0.05
讨论SAP是急性胰腺炎(AP)中最为凶险的类型,约占20%左右,病程发展快,预后差,可出现累及多器官多系统的并发症[5]。在各种并发症中,急性肺损伤是最常见的表现,但对其发病机制尚未完全阐明,大多数学者认为与炎症细胞及其分泌的炎症因子产生的“瀑布效应”有关[6]。SAP致肺损伤病理学改变的原因是大量血管内皮细胞在炎性因子的刺激下发生凋亡,因此减少血管内皮细胞损伤对保护肺实质具有重要意义[7]。研究发现,在各种炎性因子中,TNF-α不仅可以直接损伤肺血管内皮细胞,还可通过激活中性粒细胞、抑制肺表面活性物质生成等途径进一步加重肺损伤[8]。
此外,有报道称TNF-α可与IL-1产生协同作用,引起小鼠膈肌麻痹,发生周围性呼吸衰竭[9]。
本研究结果显示,建模后各时间点3组大鼠肺组织含水量、肺微血管通透性及肺组织病理评分差异均有统计学意义,由高到低依次为ANP组、干预组和假手术组,两两比较差异均有统计学意义,与马晓薇和罗永艾[10]的研究一致,证实卡托普利在减轻ANP造成的肺损伤方面有一定效果。建模后各时间点3组大鼠肺组织TNF-α含量差异均有统计学意义,由高到低依次为ANP组、干预组和假手术组,两两比较差异均有统计学意义,推测卡托普利减轻肺损伤的机制可能是通过降低内皮细胞凋亡水平,从而抑制炎症细胞聚集,减少TNF-α分泌,达到保护肺实质的目的。
卡托普利在临床上主要用于降压,具有一定降低循环血容量的作用,而SAP的首要治疗原则为大量补液进行扩容,因此如何把握应用的时间点有待进一步探究。
[1] 杨宝晶,尤胜义,张志远,等.大黄素治疗重症急性胰腺炎肺损伤机制研究[J].中国全科医学,2016,19(24):2943-2947.DOI:10.3969/j.issn.1007-9572.2016.24.015.
[2] 王皓,刘江伟,李之令,等.大鼠重症急性胰腺炎相关性肺损伤模型的建立[J].世界华人消化杂志,2013,21(3):211-219.
[3] 吴燕丽,龚静,刘芳.丹参酮ⅡA对重症胰腺炎肺损伤大鼠的保护作用研究[J].中国中医急症,2016,25(10):1870-1873.DOI:10.3969/j.issn.1004-745X.2016.10.011.
[4] Kusske AM,Rongione AJ,Ashley SW,et al. Interleukin-10 prevents death in lethal necrotizing pancreatitis in mice[J]. Surgery, 1996,120(2):284-288.
[5] 田孝军,朱峰.急性肺损伤/急性呼吸窘迫综合征大鼠肾素血管紧张素系统的变化及其干预的实验研究[J].长江大学学报(自然科学版)医学,2012,9(9):5-8,12.
[6] 徐文会,杨敏.丹参注射液对急性坏死性胰腺炎大鼠肺组织ICAM-1表达的影响[J].中华胰腺病杂志,2016,16(5):340-342.DOI:10.3760/cma.j.issn.1674-1935.2016.05.012.
[7] 洗慧仪,卢心鹏,曹志,等.急性胰腺炎相关性肺损伤小鼠肺组织蛋白组学初步研究[J].广东药学院学报,2016,32(3):374-378.DOI:10.16809/j.cnki.1006-8783.2016041402.
[8] 刘红梅.卡托普利对急性肺损伤大鼠TNF-α、IL-8的影响研究[J].河北北方学院学报(自然科学版),2014,30(6):100,102.
[9] 张卫中,辛栋轶,张丹婷,等.白介素-6反式信号通路抑制剂改善大鼠急性胰腺炎肺损伤[J].中华胰腺病杂志,2016,16(3):198-199.DOI:10.3760/cma.j.issn.1674-1935.2016.03.014.
[10] 马晓薇,罗永艾.牛磺酸联合血管紧张素转化酶抑制剂对大鼠急性肺损伤的保护作用[J].中国老年学杂志,2013,33(3):588-592.DOI:10.3969/j.issn.1005-9202.2013.03.043.

