虎杖对COPD模型大鼠肺组织MMP-9、TIMP-1表达的干预研究
石亚莉 楼黎明 陈素珍 王世强 胡丹丹 黄冉冉 徐一凯
慢性阻塞性肺疾病(chronic obstructive pulmo- nary disease,COPD)是一种以气流受限和呼吸系统症状持续存在为特征的常见疾病[1]。但目前为止COPD发病机制仍未完全明确,较肯定的包括蛋白酶/抗蛋白酶和氧化/抗氧化失衡、气道和肺实质慢性炎症等[2],其中基质金属蛋白酶9(matrix metallopeptidase 9,MMP-9)、基质金属蛋白酶抑制剂-1(tissue inhibitor of metalloproteinase 1,TIMP-1)及其比值的研究较为广泛。已有实验研究证明虎杖提取物白藜芦醇对COPD模型大鼠肺组织发挥抗炎、抗氧化作用,对肺组织具有保护作用[3]。本研究采用熏烟和气管内滴入脂多糖(LPS)的方法创建大鼠COPD模型,以观察虎杖对COPD大鼠模型肺组织MMP-9和TIMP-1表达的影响,进一步探索其可能作用机制。
1 实验材料
1.1动 物 健康雄性SD大鼠40只,清洁级,体质量240~257g,周龄4周左右,来源于上海西普尔必凯实验动物有限公司,许可证号:SCXK(沪)2013-0016,由浙江中医药大学动物实验中心饲养(温度23~25℃,湿度约 70%)。
1.2药物与试剂 虎杖煎剂:杭州华东中药饮片有限公司生产,批号161020,由浙江省中山医院中药房煎至成1mg/mL备用。强的松:规格5mg/片,浙江仙琚制药股份有限公司生产,批号160693。脂多糖:规格 10mg/支,美国 Sigma公司,批号 L-2880。RNAiso Plus试剂盒(日本 Takara公司,批号 9109);Prime-Script RT reagent Kit with gDNA Eraser(Perfect Real Time)反转录试剂盒(日本Takara公司,批号RR047A);SYBR Premix Ex Taq II(Tli RNaseH Plus)(日本 Takara公司,批号 RR820A)。
2 实验方法
2.1分组及模型制备 雄性SD大鼠40只随机分成正常对照组、COPD模型组、强的松组、虎杖组,每组10只。除正常对照组外,COPD模型组、强的松组、虎杖组采用烟熏+气管内注入脂多糖方法建立大鼠COPD模型[4]。将大鼠放入定制的有机玻璃烟熏箱内被动吸烟,1次20支香烟,持续1h,1天2次,每次熏烟间隔4h,熏烟8周。在烟熏的第1、14、28天用10%水合氯醛(10mL/kg)麻醉大鼠,经气管滴入LPS的生理盐水溶液(200μL)。
2.2给药方法 正常对照组、COPD模型组予6mL/kg生理盐水灌胃,强的松组予强的松6mg/kg灌胃,虎杖组予虎杖煎剂6g/kg灌胃,在熏烟的第29天开始药物干预,每天熏烟前30min给予大鼠灌胃,给药28天。
2.3标本采集 在给药第28天,大鼠予水合氯醛腹腔注射麻醉,经腹主动脉采血处死。取左肺组织固定于福尔马林中备用;右肺组织经液氮速冻后,于-80摄氏度冰箱保存,待用RT-PCR检测。
2.4肺组织病理改变 左肺组织用梯度酒精脱水、浸蜡和包埋,制成石蜡块,用苏木素染色,盐酸酒精分化及自来水返蓝,之后伊红染色,再次脱水、透明、封片,于显微镜下观察炎症细胞浸润,光学显微镜下进行肺组织病理观察。
2.5Real-Time PCR法检测肺组织MMP-9、TIMP-1 mRNA表达水平 从液氮速冻右肺组织中提取细胞,按照RNAiso Plus Total RNA Reagent试剂盒步骤进行RNA的提取、洗涤、溶解,RNA浓度测定,再按照PrimeScript RT regent Kit With gDNA Eraser反转录试剂盒步骤进行cDNA的合成。最后将样品cDNA 稀释 5~20倍,选取内参基因(GAPDH)。采用SYBR试剂法,对所得的样品进行表达分析。放入LightCycler 480 Real-time PCR仪中进行扩增。荧光定量 PCR 反应程序:95℃,30s;95℃,5s,60℃,30s,40个循环;95℃,5s,60℃,1min,用于检测溶解曲线。采用2-△△CT法分析样品间的相对表达量。使用Primer5.0软件,分别设计目标基因和内参基因的QPCR引物(表1),引物由杭州华安生物技术有限公司合成。
2.6统计学方法 所有数据应用SPSS17.0统计软件进行数据处理,计量资料用均数±标准差(x±s) 表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
3 实验结果
3.1各组大鼠肺组织超微结构变化 对照组大鼠肺组织气道结构基本正常,上皮细胞完整,气道周围和血管周围组织未见炎症细胞浸润;肺泡形态正常,肺泡间隔未增厚;与正常对照组相比,COPD三组大鼠,肺组织大量上皮细胞脱落,黏膜上皮增生,炎性细胞浸润,肺泡间隔增厚,肺泡缩小,甚至出现肺泡实变。强的松组、虎杖干预组肺组织损伤轻于COPD模型组,见图 1(封底)。

表1 目标基因引物序列及产物长度
3.2各组大鼠肺组织MMP-9、TIMP-1 mRNA表达比较 与正常对照组比较,其余三组大鼠肺组织MMP-9和TIMP-1 mRNA表达水平均明显升高(P<0.05);与COPD模型组比较,强的松组、虎杖组大鼠肺组织MMP-9和TIMP-1 mRNA表达水平均明显降低(P<0.05),见表 2。
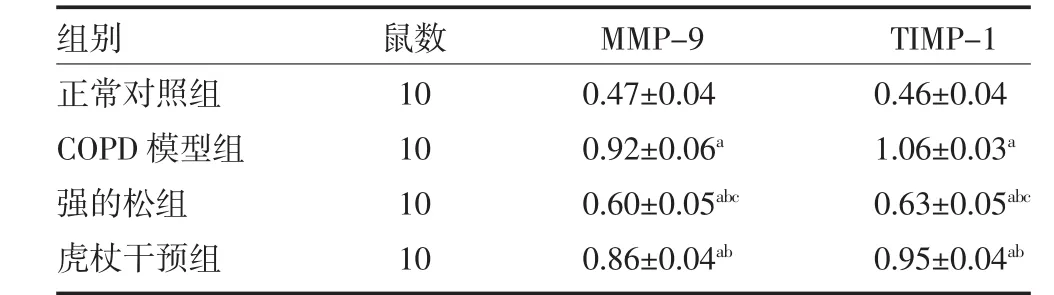
表2 各组大鼠肺组织MMP-9、TIMP-1 mRNA相对表达量比较(x±s)
4 讨论
慢阻肺病理改变表现为气道、肺实质和肺血管的慢性炎症,炎症反应导致实质破坏、黏液高分泌,增加细支气管周围和间质纤维化,促进小气道气流受限的发生,而持续气流受限的重要因素之一为气道重塑[5]。诱发气道重塑的原因之一是细胞外基质(ECM)的异常降解和沉积,在ECM降解过程中,蛋白酶主要通过降解基质中的弹性蛋白,破坏弹性蛋白保持小气道通畅和肺泡壁弹性的作用,引起气道及实质的破坏,这种破坏是COPD肺气肿特征的重要成因[6]。此后新合成的弹性蛋白,不能完全形成链即ECM,发挥结构支撑的作用,这也可能是气道重塑的机理之一。
基质金属蛋白酶(MMPs)家族在已知的二十多个成员中MMP-9是最主要的弹性蛋白水解酶[7]。MMP-9主要来源于肺泡巨噬细胞、中性粒细胞,降解气道、肺泡基底膜及ECM中弹性蛋白,促进液体渗出、炎症介质释放,加剧黏液分泌和气道炎症反应[8];弹性蛋白的降解,进而导致COPD肺泡基质及肺泡结构破坏,从而MMP-9参与气道重塑,导致持续性气流受限和炎症反应。TIMP-1是一种能特异性抑制MMP-9活性的金属蛋白酶组织抑制剂。TIMP-1通过抑制MMP-9的活性减少ECM的降解破坏,并能使肺泡ECM沉积,反映气道纤维化和修复重塑的过程[9]。MMP-9/TIMP-1的平衡是维持ECM正常状态所必须的,一旦平衡打破则出现病理状态。MMP-9、TIMP-1及其比值的平衡是维持基质正常状态所必须的。MMP-9、TIMP-1的表达及其比值升高,表明处于以炎症反应为主的病理状态,以组织破坏为主;表达及比值下降,气道表面以修复为主[10]。
慢阻肺归属中医“肺胀、喘证、咳嗽”,病位在肺、脾、肾三脏,病理因素主要为痰、瘀、虚三者。急性发作期的病机主要为痰热夹瘀,治则以祛痰化瘀,宣肺泄热为主[11]。虎杖始见于《雷公炮炙论》,其性味微寒微苦,归肝、胆、肺经,其主要功能有利湿退黄,散瘀止痛,清热解毒,止咳化痰等。活性成分主要有大黄素、大黄素甲醚、虎杖苷和白藜芦醇[12]。研究[12-13]证实白藜芦醇抑制香烟烟雾(CSM)介导COPD中肺泡巨噬细胞的炎症细胞因子释放,通过减少促炎细胞因子的释放,提高谷胱甘肽的含量,降低肺组织的髓过氧化物酶(MPO)活性,从而减少肺损伤。白藜芦醇亦可通过核转录因子(NF-κB)通路显著抑制基质金属蛋白酶的表达[14],调节蛋白酶/抗蛋白酶平衡。慢阻肺急性加重期中医辨证分型,痰热瘀阻型约占47.3%[15],组方多配伍虎杖归肺经以活血清热、化痰止咳[16]。
本实验发现,虎杖组、强的松组大鼠肺组织切片较COPD模型组结构较完整,此结果与虎杖及糖皮质激素对COPD肺组织具有保护作用的众多研究相符。与正常对照组比较,COPD三组大鼠肺组织MMP-9和TIMP-1mRNA表达水平均明显升高(P<0.05),这与 Higashimoto 等[17]的研究相符,提示MMP-9和TIMP-1参与慢阻肺气流受限及气道重塑的发生发展;经强的松、虎杖干预后,大鼠肺组织MMP-9和TIMP-1mRNA表达水平均明显降低(P<0.05),证明二者均具有抗炎作用。提示虎杖用于COPD大鼠可显著改善MMP-9/TIMP-1失调,可抑制炎症反应、气道重塑,可保护肺组织、改善气流受限。但虎杖组干预作用不及强的松组(P<0.05)。
综上所述,模型组COPD大鼠存在蛋白酶/抗蛋白酶的失衡状态,经虎杖煎剂干预后可改善肺组织MMP-9和TIMP-1mRNA表达水平及其失衡,有利于抑制其炎症反应,保护肺泡基质延缓气道重塑,但目前其机制尚未确定,有待进一步研究[本文受浙江中医药大学附属第三医院院级医药卫生科技计划(No.ZS16ZA01)、浙江中医药大学校级科研基金(No.2013ZR03)资助]。
[1]Vogelmeier CF,Criner GJ,Martinez FJ,et al.Global Strategy for the Diagnosis,Management and Prevention of Chronic Obstructive Lung Disease 2017 Report[J].American Journal of Respiratory&Critical Care Medicine,2017,195(5):557.
[2]高恒兴,温中梅,袁海波,等.慢性阻塞性肺病发病机制研究的最新进展[J].中国老年学杂志,2015,(19):5668-5670.
[3]张明灯,邓毅书,刘世昌,等.白藜芦醇对慢性阻塞性肺疾病大鼠模型的保护作用[J].临床肺科杂志,2013,18(8):1359-1362.
[4]余维巍,黄骁燕,张艳,等.黄芪多糖对慢性阻塞性肺疾病大鼠肺组织内基质金属蛋白酶-9、金属基质蛋白酶抑制剂-1 表达的影响[J].中国医药导报,2012,9(2):25-27.
[5]Yadav RK,Gupta SP,Sharma PK,et al.Recent advances in studies on hydroxamates as matrix metalloproteinase inhibitors:a review[J].Current Medicinal Chemistry,2011,18(11):1704.
[6]Johnson SR.Untangling the protease web in COPD:metalloproteinases in the silent zone[J].Thorax,2016,71(2):105.
[7]Gibbs DF,Shanley TP,Warner RL,et al.Role of matrix metalloproteinases in models of macrophage-dependent acute lung injury.Evidence for alveolar macrophage as source of proteinases[J].American Journal of Respiratory Cell&Molecular Biology,1999,20(6):1145.
[8] Ramadas RA,Wu L,Levine AM.Surfactant protein A enhances production of secretory leukoprotease inhibitor and protects it from cleavage by matrix metalloproteinases[J].Journal of Immunology,2009,182(3):1560-1567.
[9] Schirmer H,Silva LBD,Teixeira PJZ,et al.Matrix metalloproteinase gene polymorphisms:lack of association with chronic obstructive pulmonary disease in a Brazilian population[J].Genetics and Molecular Research,2009,8(3):1028-1034.
[10]Kwiatkowska S,Noweta K,Zieba M,et al.Enhanced exhalation of matrix metalloproteinase-9 and tissue inhibitor of metalloproteinase-1 in patients with COPD exacerbation:a prospective study[J].Respiration,2012,84(3):231-241.
[11]李建生,余学庆,王明航,等.中医治疗慢性阻塞性肺疾病研究的策略与实践[J].中华中医药杂志,2012,(06):1607-1614.
[12] Culpitt S,Rogers D,Fenwick P,et al.Inhibition by red wine extract,resveratrol,of cytokine release by alveolar macrophages in COPD[J].Thorax,2003,58(11):942-946.
[13] Gómezzorita S,Fernándezquintela A,Lasa A,et al.Effects of resveratrol on obesity-related inflammation markers in adipose tissue of genetically obese rats[J].Nutrition,2013,29(11-12):1374-1380.
[14] Russell RE,Thorley A,Culpitt SV,et al.Alveolar macrophage-mediated elastolysis:roles of matrix metalloproteinases,cysteine,and serine proteases[J].American Journal of Physiology Lung Cellular&Molecular Physiology,2002,283(4):L867.
[15]刘娟,齐霁,王蓓蓓.中西医结合治疗慢性阻塞性肺疾病急性加重期痰热瘀阻证临床观察[J].北京中医药,2010,29(4):286-288.
[16]陈昌胜.辨证分型联合西药治疗慢性阻塞性肺病急性加重期随机平行对照研究[J].实用中医内科杂志,2015,29(11):115-117.
[17] Higashimoto Y,Yamagata Y,Iwata T,et al.Increased serum concentrations of tissue inhibitor of metalloproteinase-1 in COPD patients[J].European Respiratory Journal,2005,25(5):885-890.

