IL-6及其受体在胆管癌患者组织中的表达及临床意义
刘亮亮,黄 强,刘臣海,刘 振,齐 灿
胆管癌是一种缺乏早期诊断,胆汁异质性的恶性肿瘤。但是其发病机制仍很大程度上未知。早期胆管癌一般无症状,并且通常在晚期阶段被诊断[1]。白细胞介素6(interleukin-6 , IL-6)是一种多功能的细胞因子, 通过与细胞膜的受体(IL-6R)结合后可作用于多种靶细胞, 近年来研究[2]显示IL-6及IL-6R对肿瘤细胞生长、疾病的病理进程及病情严重程度均有影响。但关于其在胆管癌组织中的表达情况及其与胆管癌的临床病理的关系尚未报道。该研究利用Western blot方法检测两种蛋白在胆管癌中的表达,并对其表达意义进行探讨。
1 材料与方法
1.1病例资料收集安徽医科大学附属省立医院2009年5月~2011年7月手术切除并经病理组织学证实的胆管癌及癌旁的标本40例。所有患者术前未进行放疗、化疗、免疫治疗等抗肿瘤治疗,其中男23例,女17 例,年龄41~80(61.9±8.6) 岁。上段胆管癌(肝门部胆管癌) 24例,中下段胆管癌16 例。经病理检查证实属高分化腺癌14例,中低分化腺癌26例,手术中探查及术后病理切片证实无癌周及远处淋巴结转移者16例,已发生转移者24 例。按照肝外胆管癌TNM 分期进行临床分期,Ⅰ~Ⅱ期15例,Ⅲ~Ⅳ期25例。所有患者行胆管癌根治性手术R0切除。
1.2Westemblot法检测IL-6、IL-6R蛋白表达水平过蛋白酶抑制剂处理胆管癌及癌旁组织提取总蛋白,之后经过上样、电泳、转膜、封闭、孵育后,最终经化学发光、显影、定影后,对胶片进行扫描。通过UVP 凝胶图像处理系统与Abworks 4.6软件分析目的条带与β-actin 条带灰度值之比来表示目的蛋白的相对表达水平。抗 IL-6、IL-6R一抗稀释浓度为1 ∶200;抗-Actin 一抗稀释浓度为1 ∶500; 二抗稀释度为1 ∶5 000。
1.3随访采用电话随访或信访。40例均进行了随访,通过随访获取生存情况后,绘制生存曲线,分析IL-6及IL-6R在胆管癌组织中的表达与预后的关系。
1.4统计学处理采用SPSS 17.0 统计软件进行分析。组间均数比较采用t检验,生存率的计算采用Kaplan-Meier法,并作Log-Rank检验,以P<0.05为差异有统计学意义。
2 结果
2.1IL-6及IL-6R在胆管癌及癌旁组织中的表达通过Western blot法检测40例胆管癌标本中IL-6及IL-6R的表达水平,结果通过Western blot分析,IL-6R的灰度值在胆管癌组织和癌旁组织分别为(0.780±0.120)和(0.158±0.059)(P<0.05);IL-6灰度值在胆管癌组织和癌旁组织分别为(0.480±0.112)和(0.058±0.010),差异有统计学意义(P<0.05)。见图1。

表1 胆管癌组织中IL-6及IL-6R蛋白的表达与临床病理关系±s)
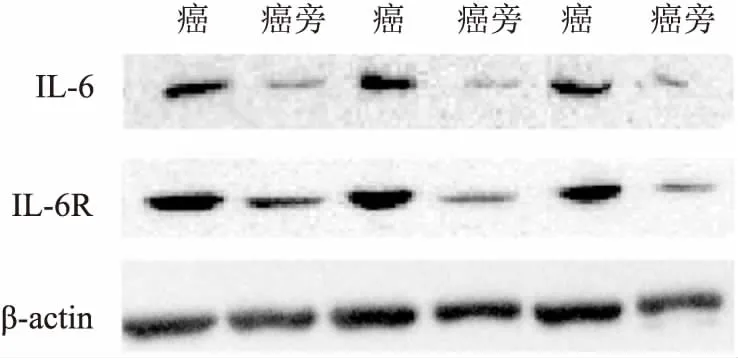
图1 胆管癌组织与癌旁组织中的受体表达情况
2.2胆管癌组织中IL-6及IL-6R表达水平与临床病理特征的关系IL-6及IL-6R表达水平与肿瘤分化程度,TNM分期和淋巴转移相关,且呈正相关性;在低分化组中表达明显高于高中分化组,T1+T2期分组中表达水平要明显低于T3+T4期分组,淋巴转移组表达水平要高于未转移组,差异有统计学意义(P<0.05)。见表1。
2.3IL-6及IL-6R表达水平与胆管癌预后的关系在40例胆管癌患者中IL-6及IL-6R高表达的26例,低表达的14例。Kaplan-Meier 生存分析显示IL-6及IL-6R高表达者的中位生存期为25.30个月,生存率为7.6%,26例患者中仅2例存活;IL-6及IL-6R低表达者的中位生存期为57.00个月,生存率为35.7%,14例患者中5例存活,经Log-Rank检验,显示IL-6及IL-6R高表达者与低表达者生存率相比较,差异有统计学意义(χ2=4.080,P=0.043) ,其中生存分析的截尾时间为60个月。见图2。
3 讨论
胆管癌是一种来源于胆管上皮的恶性肿瘤,癌变的过程中炎症因子在这个过程中发生了重要的作用,同时在临床诊治中硬化性胆管炎被广泛认为是一种癌前病变,增加了胆管癌发生的风险[3]。而白细胞介素在肿瘤的发生发展中发挥了重要的作用[4],本研究探讨的IL-6被认为是与肿瘤的发生发展密切相关的炎症因子,国外多项研究[4]结果显示IL-6能够促进多种肿瘤的侵袭转移以及影响患者的预后,例如食道癌等。然而IL-6 的多种生物学活性是通过IL-6R 介导的,IL-6和IL-6R 形成复合物后发挥其生物学活性。IL-6和IL-6R间有相互协同的作用, 其异常可影响免疫、造血和内分泌系统功能紊乱, 甚至诱发恶性肿瘤。
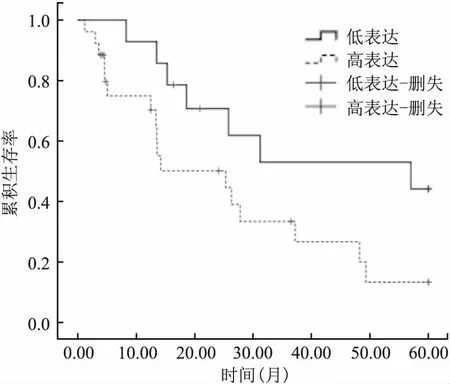
图2 胆管癌组织中表达IL-6及IL-6R表达水平
国外已有文献[5]在血清学水平检测了胃癌患者中血清IL-6水平,显示胃癌患者血清IL-6水平明显增高,并指出IL-6是一种诊断胃癌的潜在指标。本实验通过胆管癌组织学水平研究结果显示IL-6及IL-6R表达水平与肿瘤分化程度,TNM分期和淋巴转移相关,且呈正相关性,推测肿瘤的恶性程度越高,其表达水平越高。40例患者通过手术后,根据随访结果,应用Kaplan-Meier生存分析显示生存分析显示IL-6及IL-6R高表达者生存率明显低于低表达者并且差异有统计学意义;推测IL-6及IL-6R表达水平越高,患者预后越差。同时有国内外研究[6-7]显示IL-6能够通过激JAK/STAT途径来增强其增值,侵袭和迁移的能力。但是IL-6及IL-6R在促进人体胆管癌细胞的侵袭和迁移是否通过该信号通路,也是需要的进一步的组织学实验进行验证及探索。
综上所述,IL-6及IL-6R在恶性肿瘤中的作用可能是一种机体对肿瘤产生反馈,IL-6及IL-6R是促进胆管癌生长作用过程中的重要分子,有望成为诊断及治疗胆管癌的新靶点。
[1] Banales J M, Cardinale V, Carpino G, et al.Expert consensus document: Cholangiocarcinoma: current knowledge and future perspectives consensus statement from the European Network for the Study of Cholangiocarcinoma (ENS-CCA)[J]. Nat Rev Gastroenterol Hepatol,2016,13(5):261-80.
[2] Ibrahim S A, El-Ghonaimy E A, Hassan H,et al.Hormonal-receptor positive breast cancer: IL-6 augments invasion and lymph node metastasisviastimulating cathepsin B expression.[J]. J Ady Res,2016,7(5):661-70.
[3] Ehlken H, Zenouzi R, Schramm C.Risk of cholangiocarcinoma in patients with primary sclerosing cholangitis: diagnosis and surveillance.[J].Curr Opin Gastroenterol,2017,33(2):78-84.
[4] Lukaszewicz-Zajac M,Mroczko B, Kozlowski M, et al. Higher importance of interleukin 6 than classic tumor markers(carcinoembryonic antigen and squamous cell cancer antigen) in the diagnosis of esophageal cancer patients[J].Dis Esophagus, 2012,25(3):242-9.
[5] Sánchez-Zauco N, Torres J, Gómez A,et al.Circulating blood levelsof IL-6, I-FN-γ, and IL-10 as potential diagnostic biomarkers in gastric cancer: a controlled study[J].BMC Cancer,2017,17(1):384.
[6] 瞿 帅,宋 杨,梅金玉,等.IL-17及其受体调控JAK/STAT3信号通路促进喉癌血管生成的作用[J]. 安徽医科大学学报,2015,50(10):1464-7.
[7] Ilamathi M, Prabu P C, Ayyappa K A,et al.Artesunate obliterates experimental hepatocellular carcinoma in rats through suppression of IL-6-JAK-STAT signalling.[J].Biomed Pharmacother,2016,82:72-9.

