低剂量阿司匹林诱导产生的自噬减弱其对人肝癌HepG2细胞系的抑制作用
朱思雅,王梦琳 ,金 娟
肝细胞癌是现如今社会最为常见的恶性肿瘤之一,又因其恶性程度高,且发生发展速度较快,治疗困难,而一直是临床研究的重点和热点之一[1]。阿司匹林是应用最早,最广泛和最常用的非甾体类解热镇痛抗炎风湿药,具有解热、镇痛、抗炎、抗风湿和抗血小板聚集等的众多的药理作用,阿司匹林发挥药效较快且药效稳定,超剂量易于被发现和解决,很少发生变态反应。长期规律使用阿司匹林者和未服用阿司匹林者相比,可有效降低癌症的发生、增殖和转移[2-3]。细胞自噬是细胞在自噬相关基因的调控下利用溶酶体降解自身受损的细胞器和大分子物质的过程,发生应激时,细胞自噬可以阻止致癌的损伤蛋白质和细胞器的累积,阻止细胞的癌变;但是如果肿瘤形成,细胞自噬为癌细胞提供丰富的营养,促进肿瘤生长。因此,在肿瘤进展的过程中,细胞自噬的作用表现出了两面性,细胞自噬与肿瘤的关系十分复杂且目前尚未完全阐明。该研究旨在研究一定浓度的阿司匹林对人肝癌HepG2细胞具有增殖抑制作用,并进一步探讨一定浓度阿司匹林对人肝癌HepG2细胞增殖抑制作用与细胞内自噬的联系。
1 材料与方法
1.1细胞株人肝癌HepG2细胞系购自中国科学院上海细胞库。
1.2主要试剂阿司匹林购自上海阿拉丁生化科技股份有限公司;腺苷酸活化蛋白激酶(the expression of Adenosine 5′-monophosphate (AMP)-activated protein kinase,AMPK)和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抗体购自英国艾美捷科技有限公司;小牛血清和DMEM培养基购自杭州市四季青公司;辣根酶标记的β-actin、辣根酶标记抗兔lgG抗体和辣根酶标记抗鼠lgG抗体购自北京中杉金桥生物有限公司;吖啶橙(acridine orange,AO)染料、四甲基偶氮唑盐(MTT)购自美国西格玛奥德里奇公司。
1.3主要仪器SW-CI-2F超净工作台(中日合资苏州安泰空气技术有限公司);Multiskan Go[赛默飞世尔科技(中国)有限公司];电泳仪(美国Bio-Rad公司);倒置荧光显微镜(日本Olympus公司);立式压力蒸汽灭菌器(上海申安医疗器械厂);超纯水仪(上海力新仪器有限公司)。
1.4方法
1.4.1细胞培养 将人肝癌HepG2细胞从液氮中取出复苏,然后在含10%小牛血清的DMEM培养基中,置于37 ℃和5% CO2的培养箱中培养。
1.4.2MTT法检测人肝癌HepG2细胞的增殖活力 HepG2细胞用含10%小牛血清的DMEM稀释成5×104/ml浓度,接种于96孔培养板内,每孔100 μl,细胞培养过夜。当细胞生长到60%~70%时,加入用DMEM配制的不同浓度阿司匹林,各组的终浓度为:2.5、5、10、20 mmol/L每孔加入100 μl(每组设4个复孔),继续培养24、48 h,每孔加入5 mg/ml浓度的新鲜配制的MTT溶液 20 μl,继续孵育4 h后,弃去各孔中的培养液,每孔加入DMSO 150 μl后室温下在摇床上振荡10 min,酶标仪490 nm波长检测吸光度值。
1.4.3平板克隆实验 取生长对数期的人肝癌HepG2细胞,常规消化离心收集细胞的沉淀,用含有血清的DMEM培养基使其重悬成为单细胞悬液(1×104孔),加入用DMEM配制的含不同浓度阿司匹林(2.5、5、10、20、40 mmol/L)的培养液培养48 h,后撤去含药培养液,换上正常含血清的DMEM培养液。置于37 ℃、5% CO2细胞培养箱中培养3周左右。经常观察,当培养皿中出现肉眼可见的克隆时,终止培养。弃去上清液,用PBS小心浸洗2次。加入5 ml的4%多聚甲醛固定细胞,固定15 min。去除固定液,加入适量GIMSA应用染色液,染色30 min,使用流水缓慢清洗去染色液,空气干燥,倒置。用肉眼直接计数克隆,后计算克隆形成率。克隆形成率(%) =(克隆数/接种细胞数)×100%。
1.4.4AO荧光染色 取生长对数期细胞,常规消化离心,接种于24孔细胞培养板中(2×104/500 μl每孔),待细胞贴壁后弃去原有培养液,换上用DMEM培养液配制的不同浓度阿司匹林(10、20 mmol/L)于37 ℃、5% CO2下孵育,培养液仅含DMSO组作对照组。培养2、4、6 h后每孔加入100 μl AO染液(1 μg/ml)继续孵育40 min,弃上清液,95%乙醇溶液固定5 min,PBS清洗细胞3~4次,每次5 min,倒置荧光显微镜立即观察。
1.4.5Western blot法检测蛋白的表达 取生长对数期的人肝癌HepG2细胞,细胞裂解法冰上裂解细胞提取蛋白,BCA法蛋白定量,变性蛋白加入到SDS-PAGE凝胶进行电泳,恒压将蛋白转至PVDF膜上,脱脂奶粉封闭1 h。一抗(1 ∶1 000)4 ℃孵育过夜,二抗(1 ∶10 000)室温孵育2 h,TBST洗膜,显影。
1.5统计学处理采用SPSS 17.0软件进行分析,组间比较采用One-Way ANOVA检验。以P<0.05为差异有统计学意义。
2 结果
2.1MTT法测定阿司匹林对HepG2细胞增殖活力的影响阿司匹林10 mmol/L作用于人肝癌HepG2细胞24 h后对人肝癌HepG2细胞产生增殖抑制作用,与未加阿司匹林的对照组比较差异有统计学意义(F=24.5,P<0.01)。阿司匹林10 mmol/L作用于细胞48 h后对人肝癌HepG2细胞产生增殖抑制作用,与未加入阿司匹林的对照组比较差异有统计学意义(F=34.3,P<0.01)。40 μmol/L自噬抑制剂氯喹(chloroquine diphosphate salt,CQ)促进10 mmol/L阿司匹林对HepG2细胞的增殖抑制,差异有统计学意义(F=163.8,P<0.01)。10 mmol/L阿司匹林能抑制人肝癌HepG2细胞的增殖活力,合用自噬抑制剂CQ后CQ促进这种增殖抑制。见图1、2。
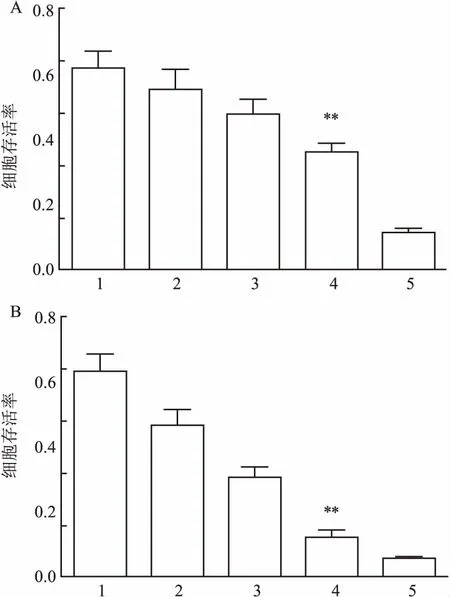
图1 24、48 h阿司匹林对人肝癌HepG2细胞增殖活力的影响
A:阿司匹林作用24 h:B:阿司匹林作用48 h;1:对照组;2、3、4、5:阿司匹林2.5、5、10、20 mmol/L;与对照组比较:**P<0.01
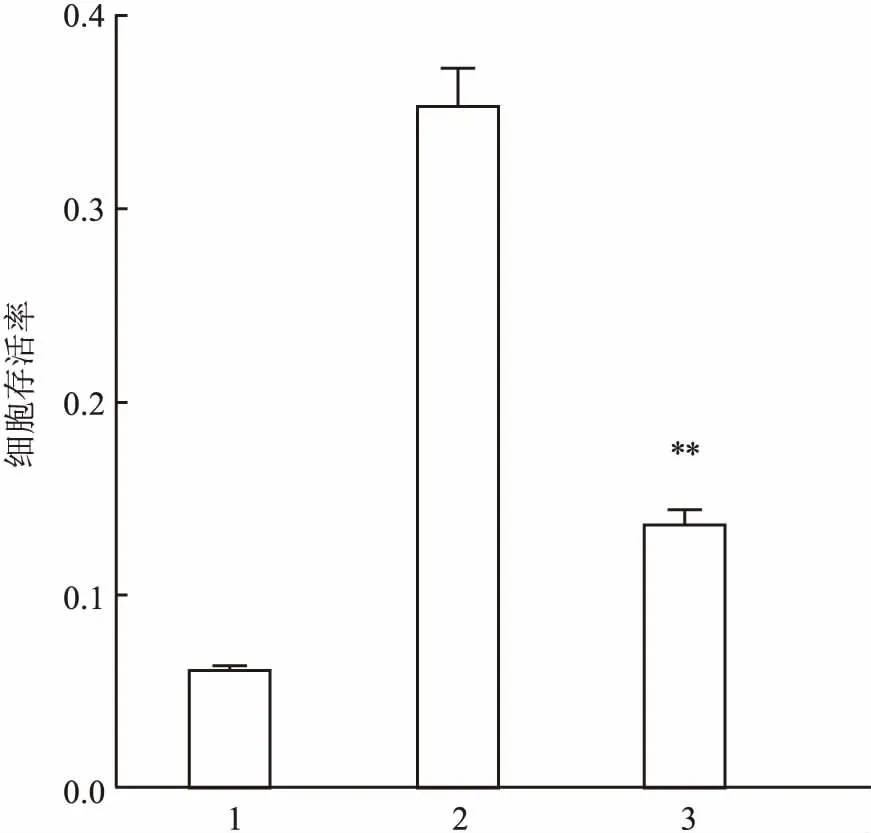
图2 CQ联合阿司匹林对HepG2细胞增殖活力的影响
1:CQ 40 μm;2:阿司匹林 10 mmol/L;3:CQ+阿司匹林;与阿司匹林10 mmol/L组比较:**P<0.01
2.2平板克隆实验细胞克隆形成率表示接种细胞后贴壁的细胞成活并形成克隆的数量,贴壁后的细胞不一定每个都能增殖和形成克隆,而形成克隆的细胞必为贴壁和有增殖活力的细胞,反映细胞群体依赖性和增殖能力。阿司匹林(2.5、5、10、20、40 mmol/L)对HepG2细胞有抑制作用,见图3。
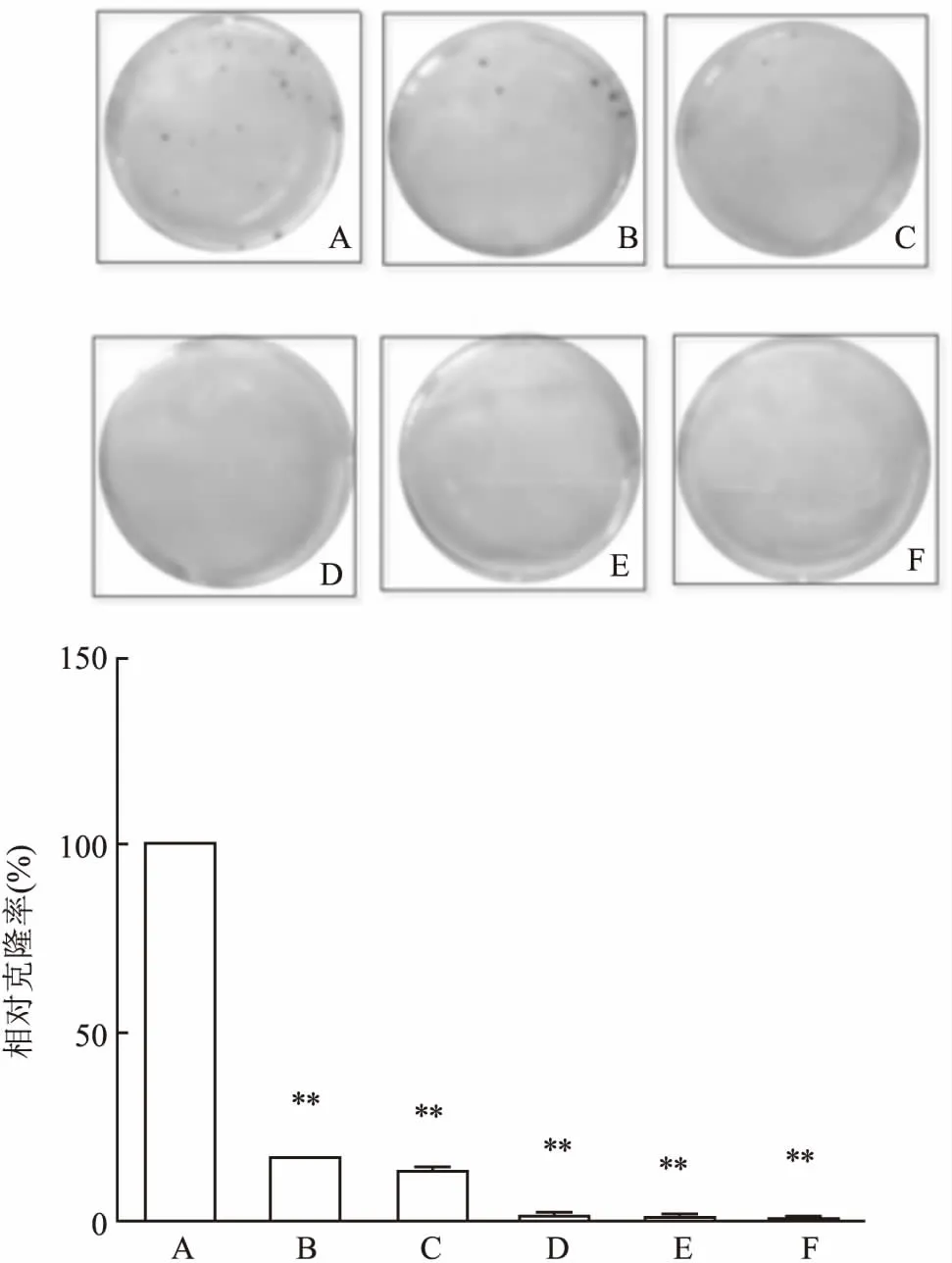
图3 阿司匹林作用后HepG2的相对克隆率
A:对照组;B、C、D、E、F:阿司匹林2.5、5、10、20、40 mmol/L;与对照组比较:**P<0.01
2.3AO荧光染色AO荧光染色法利用对pH敏感标记酸性囊泡细胞器结构,是一种具有细胞渗透性的荧光染色方法,DNA和胞质为亮绿色,若为酸性囊泡AO发出红色荧光,是常用检测细胞自噬的方法之一。10、20 mmol/L浓度的阿司匹林处理后,出现了橘红色的自噬小体。实验结果见图4。
2.4Westernblot法测定AMPK、mTOR蛋白表达阿司匹林(10、20 mmol/L)作用于人肝癌HepG2细胞24 h后,提取细胞内蛋白,检测蛋白表达。与对照组比较,AMPK蛋白表达增加,mTOR蛋白下调。实验结果见图5。
3 讨论
肝细胞癌是世界范围内最常见的实体瘤之一,也是死亡率最高的疾病之一。乙型肝炎病毒(hepadnavividae, HBV)感染是肝细胞癌发生发展的主要病因之一。HBV是一种有包膜病毒,含有一个环状的部分双链结构的DNA基因组,为亲肝细胞性DNA病毒,HBV进入体内可利用由多聚酶编码的DNA多聚酶-逆转录酶复制。病毒特异性T细胞反应可激活其他炎症细胞及干扰素、肿瘤坏死因子等细胞因子释放,从而抑制病毒复制并清除感染细胞。没有足够的病毒特异性T细胞反应,HBV以稳定形式持续存在,其特殊区域复制被认为是导致慢性HBV感染的原因。对HBV持续性的炎症反应即慢性活动性肝炎,可引起肝细胞坏死、肝纤维化、可能导致肝硬化。HBV引起的慢性活动性肝炎和肝硬化是肝细胞癌的主要危险因素。我国人口众多,又是HBV感染的高发国家之一,由乙肝进展所致的HCC给我国医疗资源带来了巨大的的负担。然而,目前尚无预防和治疗HBV相关的抗HCC的有效药物。研究[4]表明非甾体抗炎药阿司匹林能显著减少肝内HBV特异性T细胞和非特异性炎性细胞,阻止HBV相关的HCC的发生和发展。因此,本研究推测阿司匹林可能在HBV相关的HCC预防和治疗中发挥重要作用。自噬是最近研究热点之一,细胞在正常情况下很少发生自噬,除非有诱发因素,且诱发因素众多,也是最近研究热点。细胞在接受到自噬诱导信号之后会在胞质形成一个像“脂质体”样的膜结构,然后不断扩张,呈扁平状,不断延伸,将胞质中的任何成分,全部揽入其中,成为密闭的球状的自噬体。电镜下可观察到。自噬体与溶酶体融合,期间自噬体的内膜和内容物被溶酶体酶降解合为一体,产物(氨基酸、脂肪酸等)被输送到胞质中,供细胞重新利用,残渣被排出细胞外或留在胞质中。AMPK被称为细胞的代谢和能量的感受器。在细胞代谢中起作用,而肿瘤细胞内部代谢紊乱,会引起AMPK活性变化[5-6]。肿瘤抑制因子LKB1作用于其上游,P53和TSC2为其下游底物[7-8]。AMPK既能通过mTOR-TSC2负向调控自噬,又能磷酸化ULK1引发自噬[9-10]。以上都说明AMPK在自噬中起到至关重要的作用。本研究显示,10 mmol/L浓度的阿司匹林对人肝癌HepG2细胞具有增殖抑制作用且和自噬抑制剂CQ合用时此作用会被促进。10 mmol/L浓度阿司匹林作用于人HepG2细胞时会出现自噬小体,并且增加相关蛋白AMPK的表达而降低mTOR蛋白表达。提示10 mmol/L浓度的阿司匹林对人肝癌HepG2细胞增殖抑制作用与自噬有关。
图4阿司匹林作用人肝癌HepG2细胞不同时间后细胞经AO染色×400
A:对照组;B:阿司匹林10 mmol/L;C:阿司匹林20 mmol/L;1:2 h;2:4 h;3:6 h

图5 Western blot法测定相关蛋白表达
与HepG2组AMPK蛋白的表达比较:**P<0.01;与HepG2组mTOR蛋白表达比较:##P<0.01
[1] 范 洁,张 磊,王 啸.人参皂苷Rk3对肝癌HepG2细胞凋亡的影响[J]. 安徽医科大学学报,2016,51(11):1604-8.
[2] Rothwell P M, Wilson M, Price J F,et al. Effect of daily aspirin on risk of cancer metastasis: a study of incident cancers during randomised controlled trials[J]. Lancet, 2012,379(9826):1591-601.
[3] Burn J, Gerdes A M,Macrae F,et al. Long-term effect of aspirin on cancer risk in carriers of hereditary colorectal cancer: an analysis from the CAPP2 randomised controlled trial[J]. Lancet,2011,378(9809):2081-7.
[4] Futakuchi M, Ogawa K, Tamano S,et al. Suppression of metastasis by nuclear factor kappaB inhibitors in aninvivolung metastasis model of chemically induced hepatocellular carcinoma[J]. Cancer Sci,2004, 95(1):18-24.
[5] Hawley S A, Fullerton M D, Ross F A,et al. The ancient drug salicylate directly activates AMP-activated protein kinase[J]. Science,2012,336(6083):918-22.
[6] Din F V, Valanciute A, Houde V P,et al. Aspirin inhibits mTOR signaling, activates AMP-activated protein kinase, and induces autophagy in colorectal cancer cells[J]. Gastroenterology,2012,142 (7):1504-15.
[7] Okoshi R, Ozaki T, Yamamoto H,et al. Activation of AMP-activated protein kinase induces p53-dependent apoptotic cell death in response to energetic stress[J]. J Biol Chem,2008,283(7):3979-87.
[8] Imamura K, Ogura T, Kishimoto A,et al. Cell cycle regulationviap53 phosphorylation by a 5′-AMP activated protein kinase activator, 5-aminoimidazole- 4-carboxamide-1-beta-D-ribofuranoside, in a human hepatocellular carcinoma cell line[J]. Biochem Biophys Res Commun, 2001, 287(2):562-7.
[9] Jones R G, Plas D R, Kubek S,et al. AMP-activated protein kinase induces a p53-dependent metabolic checkpoint[J]. Mol Cell,2005,18(3):283-93.
[10] Gwinn D M, Shackelford D B, Egan D F,et al. AMPK phosphorylation of raptor mediates a metabolic checkpoint[J]. Mol Cell,2008,30(2):214-26.

