脑胶质瘤患者血清miR-720、miR-29c表达及临床意义
周景儒,王栋梁,刘志,武广永, 刘如恩
(北京大学人民医院,北京100044)
脑胶质瘤是最常见的颅内恶性肿瘤,源于神经上皮组织,患者预后较差。微小RNA(miRNA)属于非编码RNA,是长度19~25个核苷酸的小RNA分子,其序列具有高度保守性[1~3]。研究发现,脑胶质瘤组织中存在多种 miRNA异常表达[4,5]。本研究观察了miR-720和miR-29c在脑胶质瘤患者血清中的表达变化,现分析结果,探讨其在脑胶质瘤发生、发展中的作用。
1 资料与方法
1.1临床资料选取2013年1月~2017年1月我院收治的脑胶质瘤患者87例(胶质瘤组),男54例、女33例,年龄37~68(48±9)岁;星形胶质细胞瘤27例,少突胶质细胞瘤32例,少突星形细胞瘤28例;Ⅰ~Ⅱ级58例,Ⅲ~Ⅳ级29例;肿瘤位于额叶32例、颞叶21例、其他部位16例,肿瘤位于多个脑叶18例。纳入标准:手术切除肿瘤,术后经病理诊断证实为脑胶质瘤;术前未接受放疗、化疗;临床病理资料完整;完成12个月的随访。排除标准:合并其他系统恶性肿瘤;合并慢性疾病(如冠心病、高血压、糖尿病等);合并感染性疾病。选择同期体检健康者50例为对照组,男32例、女18例,年龄33~70(52±12)岁。两组性别、年龄具有可比性。
1.2血清miR-720和miR-29c表达检测分别采集胶质瘤组手术前后及对照组清晨空腹肘静脉血10 mL,3 000 r/min离心10 min,收集血清。采用实时荧光定量PCR法检测血清miR-720和miR-29c表达。具体步骤:取血清样本,采用mirVanaTMPARISTM试剂盒(Ambion-560)提取血清总RNA,超微量核酸蛋白测定仪(ND-2000)检测RNA浓度及纯度,DNAase Ⅰ酶去除DNA,TaqMan microRNA RT试剂盒进行反转录,反应体系和反应条件参照试剂盒说明书。引物及探针序列:hsa-miR-720:UCUCGCUGGGGCCUCCA;hsa-miR-29c:TAACCGA-
TTTCAAATGGTGCTA。目标基因探针和内参基因探针均为5′端采用FAM报告荧光标记,3′端采用TAMRA淬灭荧光标记。PCR反应体系:4.5 μL反转录产物,0.5 μL TaqMan microRNA assay (5×),5.0 μL TaqMan Mix。PCR反应条件:95 ℃预热5 min;95 ℃ 15 s,60 ℃ 1 min,循环40次。采用相对定量法(2-ΔΔCt法)计算相对表达量。分别以血清miR-720、miR-29c相对表达量的平均值为界限,≥平均值为高表达,<平均值为低表达。分析血清miR-720、miR-29c表达与脑胶质瘤患者临床病理特征及预后的关系。
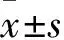
2 结果
2.1两组血清miR-720、miR-29c表达比较胶质瘤组术前、术后血清miR-720相对表达量均高于对照组,血清miR-29c相对表达量均低于对照组。胶质瘤组术后血清miR-720相对表达量低于术前,miR-29c相对表达量高于术前;组间及组内比较P均<0.05。见表1。胶质瘤组miR-720高表达者47例、低表达者40例,miR-29c高表达者42例、低表达者45例。
2.2血清miR-720、miR-29c表达与脑胶质瘤患者临床病理特征的关系脑胶质瘤患者血清miR-720表达与肿瘤分化程度呈负相关,即分化水平越高,血清miR-720相对表达量越低(P<0.05);血清miR-29c表达与肿瘤分化程度呈正相关,即分化水平越高,血清miR-29c相对表达量越高(P<0.05);血清miR-720、miR-29c表达与患者性别、年龄、肿瘤直径、病理类型、肿瘤位置、KPS评分均无关(P均>0.05)。见表2。
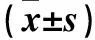
表1 两组血清miR-720、miR-29c相对表达量比较
注:与对照组比较,*P<0.05;与同组术前比较,△P<0.05。
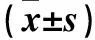
表2 血清miR-720、miR-29c表达与脑胶质瘤患者临床病理参数的关系
2.3血清miR-720、miR-29c表达与胶质瘤患者预后的关系观察组miR-720高表达者与低表达者1年生存率分别为74.37%、92.50%,二者比较χ2=4.924、P=0.026。miR-29c高表达者与低表达者1年生存率分别为92.86%、73.33%,二者比较χ2=5.803、P=0.016。
3 讨论
脑胶质瘤呈浸润性生长、通常与正常脑组织无明显界限,导致常规影像学、血常规等检查手段不能精准地进行诊断和评估病情[6]。
miRNA可与靶基因信使RNA(mRNA)的3′-非翻译区(3′-UTR)特异性结合,抑制蛋白翻译,从而参与细胞分化、增殖等生物过程。研究证实,在脑胶质瘤中存在多种miRNA异常表达[7],如miR-137可靶向EZH2基因,参与脑胶质瘤的增殖和血管形成[8,9]。miR-720不是经典的miRNA,很可能是一种来源于转运RNA(tRNA)的miRNA[9]。在正常生理状态下,miR-720在内皮生长和牙髓细胞分化等过程中发挥作用[10]。研究证实,miR-720在人类肿瘤中表达异常,如在宫颈癌中miR-720表达显著增加,参与宫颈癌的发生发展[11];血清miR-720可以作为人结肠癌[12]和骨髓瘤[13]的血清标志物。本研究结果显示,脑胶质瘤组血清miR-720水平显著高于对照组,术后血清miR-720水平较术前降低,且血清miR-720水平与肿瘤分化程度呈正相关,miR-720高表达患者的近期预后较差;提示miR-720高表达参与并促进了脑胶质瘤的肿瘤形成和恶性进展过程,miR-720可以作为评估脑胶质瘤恶性程度及患者预后的重要参考指标。Li等[14]发现,miR-720在乳腺癌中表达降低,且其低表达与淋巴结转移、患者预后有明显的相关性;与本研究在脑胶质瘤中的研究结果不一致。可能原因为miRNA通过靶向调节不同功能的基因表达,进而发挥完全不同的生物学效应。
miR-29c是miR-29家族的重要成员,在多种肿瘤中处于低表达状态、发挥抑癌基因的功能,如在肝细胞癌中,miR-29c靶向TNFAIP3基因,进而抑制细胞生长和诱导细胞凋亡;在膀胱癌中,miR-29c通过靶向CDK6基因,抑制细胞生长转移、诱导细胞周期阻滞。有研究证实,在脑胶质瘤中miR-29c参与细胞对替莫唑胺的化疗敏感性[15]。Yu等[16]发现miR-29c在胃癌细胞表达水平较低,增加miR-29c表达可抑制NASP基因表达,进而促进细胞凋亡、诱导G1/G0期阻滞。本研究结果发现,与对照组相比,脑胶质瘤组血清miR-29c水平明显降低,术后血清miR-720水平较术前升高,且血清miR-29c水平与肿瘤分化程度呈负相关,miR-29c高表达患者的近期预后较好;提示miR-29c低表达参与并促进了脑胶质瘤的肿瘤形成和恶性进展过程,miR-29c可以作为评估脑胶质瘤恶性程度、患者预后的重要参考指标。
综上所述, miR-720高表达、miR-29c低表达共同促进了脑胶质瘤的发生及发展;血清miR-720、miR-29c具有作为脑胶质瘤生物靶标的潜能。
参考文献:
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[2] Modrek AS, Bayin NS, Placantonakis DG. Brain stem cells as the cell of origin in glioma[J]. World J Stem Cells, 2014,6(1):43-52.
[3] Massillo C, Dalton GN, Farré PL, et al. Implications of microRNA dysregulation in the development of prostate cancer[J]. Reproduction, 2017,154(4):R81-81,R97.
[4] Jiang X, Du L, Duan W, et al. Serum microRNA expression signatures as novel noninvasive biomarkers for prediction and prognosis of muscle-invasive bladder cancer[J]. Oncotarget, 2016,7(24):36733-36742.
[5] Piwecka M, Rolle K, Belter A, et al. Comprehensive analysis of microRNA expression profile in malignant glioma tissues[J]. Mol Oncol, 2015,9(7):1324-1340.
[6] Stummer W. Fluorescein in brain metastasis and glioma surgery[J]. Acta Neurochir (Wien), 2015,157(12):2199-2200.
[7] Beischlag TV, Anderson G, Mazzoccoli G. Glioma: tryptophan catabolite and Melatoninergic pathways link microRNA, 14-3-3, chromosome 4q35, epigenetic processes and other glioma biochemical changes[J]. Curr Pharm Des, 2016,22(8):1033-1048.
[8] Bhat NS, Colden M, Dar AA, et al. MicroRNA-720 regulates E-cadherin-α E-catenin complex and promotes renal cell carcinoma[J]. Mol Cancer Ther, 2017,16(12):2840-2848.
[9] Schopman NC, Heynen S, Haasnoot J, et al. A miRNA-tRNA mix-up: tRNA origin of proposed miRNA[J]. RNA Biol, 2010,7(5):573-576.
[10] Hara ES, Ono M, Eguchi T, et al. miRNA-720 controls stem cell phenotype, proliferation and differentiation of human dental pulp cells[J]. PLoS One, 2013,8(12):e83545.
[11] Lin Y, Zeng Y, Zhang F, et al. Characterization of microRNA expression profiles and the discovery of novel microRNAs involved in cancer during human embryonic development[J]. PLoS One, 2013,8(8):e69230.
[12] Nonaka R, Miyake Y, Hata T, et al. Circulating miR-103 and miR-720 as novel serum biomarkers for patients with colorectal cancer[J]. Int J Oncol, 2015,47(3):1097-1102.
[13] Jones CI, Zabolotskaya MV, King AJ, et al. Identification of circulating microRNAs as diagnostic biomarkers for use in multiple myeloma[J]. Br J Cancer, 2012,107(12):1987-1996.
[14] Li LZ, Zhang CZ, Liu LL, et al. miR-720 inhibits tumor invasion and migration in breast cancer by targeting TWIST1[J]. Carcinogenesis, 2014,35(2):469-478.
[15] Xiao S, Yang Z, Qiu X, et al. miR-29c contribute to glioma cells temozolomide sensitivity by targeting O6-methylguanine-DNA methyltransferases indirectely[J]. Oncotarget, 2016,7(31):50229-50238.
[16] Yu B, Chen X, Li J, et al. microRNA-29c inhibits cell proliferation by targeting NASP in human gastric cancer[J]. BMC Cancer, 2017,17(1):109.

