颈动脉粥样硬化患者外周血Th17、Treg比例及阿托伐他汀对其的影响
钟文津,杨炳昂,景香香,张洁,方小丽,王丹丹,刘丽莉,王可环
(海南省人民医院,海口570311)
越来越多的研究显示在动脉粥样硬化发生、发展过程中存在急慢性炎症反应,炎症细胞和炎症因子的过度活化与动脉粥样硬化进展和斑块破裂密切相关[1]。研究发现,辅助性T淋巴细胞17(Th17)/调节性T细胞(Treg)失衡是造成动脉粥样硬化进展的重要原因[2,3]。阿托伐他汀是治疗动脉粥样硬化的主要药物,效果明确,但其对Th17、Treg的影响研究较少。本研究观察了颈动脉粥样硬化患者外周血Th17、Treg比例变化,探讨阿托伐他汀干预对Th17、Treg的影响。
1 资料与方法
1.1临床资料选取2016年2月~2017年1月我院收治的颈动脉粥样硬化患者80例,男44例、女36例,年龄39~75(57.6 ± 8.1)岁,合并高血压39例、糖尿病29例、高脂血症28例,颈动脉内中膜厚度(IMT)1.3~4.1(2.4±1.1)mm。纳入标准:行颈动脉超声检查证实存在斑块,性质为软斑块(超声呈均质或不规则低回声);IMT>1.2 mm。排除标准:既往有脑梗死、脑出血、急性心肌梗死、不稳定型心绞痛或血管畸形;近4周内服用非甾体抗炎药、激素、免疫抑制剂或他汀类药物;合并严重的心肝肾功能障碍、免疫系统疾病、风湿性疾病或肿瘤;合并感染性疾病或发热;妊娠及哺乳期妇女;不能配合检查者。将患者随机分为阿托伐他汀组和常规治疗组,每组40例。另选同期体检健康者40例作为健康组,其中男20例、女20例,年龄37~75(56.1±9.0)岁。三组年龄、性别均具有可比性。
1.2治疗方法阿托伐他汀组和常规治疗组均积极控制基础疾病,给予降压、控制血糖等常规治疗。在此基础上阿托伐他汀组口服阿托伐他汀钙片40 mg/d。两组均连续治疗3个月。
1.3外周血Th17、Treg检测阿托伐他汀组及常规治疗组分别于治疗前及治疗3个月结束时,健康组于体检时,分别采集空腹静脉血,制备单淋巴细胞悬液,采用流式细胞仪(FACS Aria Ⅲ 型,美国BD公司)检测Th17、Treg,计算Treg/Th17。
1.3.1单淋巴细胞悬液制备取一支15 mL离心管,加入5 mL Ficoll淋巴细胞分离液,吸取5 mL血液标本置于分离液中,500 g离心30 min;吸取第二层的环状乳白色淋巴细胞层,加入到另一15 mL离心管中,加入10 mL PBS缓冲液重悬细胞,混匀后250 g离心10 min,弃上清,加入5 mL PBS缓冲液重悬细胞,250 g离心10 min,弃上清,加入5 mL PBS缓冲液洗涤细胞;将细胞重悬于含有10%二甲基亚砜(DMSO)的FBS中,-80 ℃冰箱内过夜,液氮保存。
1.3.2Th17检测解冻上述淋巴细胞,调整细胞密度为2.0×106个/mL,取200 μL单细胞悬液接种于24孔板,置于37 ℃、5% CO2培养箱中培养4 h;收集细胞,等分为测定管和对照管,各加入20 μL FITC-CD4抗体,避光4 ℃孵育30 min;加入1 mL破膜剂,避光4 ℃孵育45 min;测定管中加入20 μL PE标记的IL-17抗体,对照管中加入同等剂量的同型对照抗体,避光4 ℃孵育30 min;采用流式细胞仪检测Th17,计算比例。
1.3.3Treg检测取200 μL单细胞悬液分别加入到测定管和对照管中,再分别加入20 μL FITC-CD4抗体,测定管中加入5 μL APC-CD25抗体,对照管中加入同等剂量的同型对照抗体,避光4 ℃孵育30 min;加入1 mL破膜剂,避光4 ℃孵育45 min;测定管中加入20 μL PE-Foxp3抗体,对照管中加入同等剂量的同型对照抗体,避光4 ℃孵育30 min;采用流式细胞仪检测Treg,计算比例。
1.4血浆维甲酸受体相关的孤儿受体(ROR-γt)、叉头翼螺旋转录因子(Foxp3)mRNA表达检测采用RT-PCR法。取各组血液样本,采用TRIzol法提取总RNA;合成第一链cDNA;构建荧光定量PCR反应体系。反应条件为95 ℃ 2 min、95 ℃ 20 s、60 ℃ 30 s、68 ℃ 55 s(40个循环)。以GAPDH为内参,采用2-ΔΔCt法计算ROR-γt、Foxp3 mRNA相对表达量。ROR-γt上游引物:CCTGGGCTCCTCGCCTGACC,下游引物:TCTCTCTGCCCTCAGCCTTGCC。Foxp3上游引物:CTGGCAAATGGTGTCTGCAAGT,下游引物:TGGCACCCAGCACAATGAA。
1.5血清IL-17、转化生长因子β(TGF-β)检测取1.4中采集的外周血液样本,离心后取血清,采用ELISA法检测IL-17、TGF-β。具体步骤参照试剂盒(杭州联科生物技术股份有限公司)说明书。
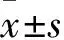
2 结果
2.1三组外周血Th17、Treg比例及Treg/Th17比较见表1。
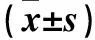
表1 三组外周血Th17、Treg比例及Treg/Th17比较
注:与健康组比较,*P<0.05;与常规治疗组同时间点比较,△P<0.05;与同组治疗前比较,#P<0.05。
2.2三组血浆ROR-γt、Foxp3 mRNA表达比较见表2。
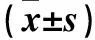
表2 三组血浆ROR-γt、Foxp3 mRNA相对表达量比较
注:与健康组比较,*P<0.05;与常规治疗组同时间点比较,△P<0.05;与同组治疗前比较,#P<0.05。
2.3三组血清IL-17、TGF-β水平比较见表3。

表3 三组血清IL-17、TGF-β水平比较
注:与健康组比较,*P<0.05;与常规治疗组同时间点比较,△P<0.05;与同组治疗前比较,#P<0.05。
3 讨论
Th17和Treg是一组起源相同、分化差异的T细胞亚群,具有互相调节、互相抑制的作用,是除Th1/Th2外的另一组免疫调控细胞。Th17属于效应性T细胞,通过分泌IL-17、TNF-α等炎症因子,促进病理性免疫反应的激活。Treg具有免疫无能和免疫抑制两大特性,能够抑制免疫细胞增殖和免疫活性,抑制炎症反应。研究证实,Th17/Treg失衡在炎症性肠病、多发性硬化、系统性红斑狼疮及部分肿瘤的发生过程中发挥重要作用[4~6]。Gao等[7]研究显示,ApoE-/-小鼠体内Th17比例升高,转录因子ROR-γt和效应分子IL-17表达量也升高,证实Th17比例增加促进动脉粥样硬化斑块的形成。临床研究发现,急性冠脉综合征患者外周血中Th17比例及IL-17表达量增高,说明Th17细胞数量增加与斑块不稳定性相关[8]。
Treg是一种负向调控免疫细胞,具有抑制炎症反应、保持免疫耐受、维持免疫状态平衡等效应,其表达量降低可导致机体免疫稳态遭到破坏,出现炎症反应激活。Treg主要分泌TGF-β和IL-10,抑制和下调IL-6、单核细胞趋化蛋白、细胞间黏附分子等炎症因子表达,减少炎性细胞积聚,延缓动脉粥样硬化形成[9]。Treg还可加快低密度脂蛋白和乳糜微粒的分解,下调胆固醇水平,减轻高血脂对巨噬细胞的刺激,抑制内皮细胞活化和斑块内泡沫细胞增殖[10]。Li等[11]研究显示,外周血Treg比例下降及Th17/Treg失衡是动脉粥样硬化斑块破裂的危险因素。贾宁等[12]研究证实,外周血Treg数量可以反映动脉粥样硬化斑块的稳定性。
本研究80例颈动脉粥样硬化患者颈动脉斑块均为软斑块,与健康组相比,患者外周血Th17比例升高,Treg比例下降,Th17/Treg失衡;对其下游的效应分子进行检测发现,Th17分泌的ROR-γt、IL-17 mRNA表达量升高,Treg分泌的Foxp3、TGF-β mRNA表达量降低。提示颈动脉软斑患者体内存在Th17、Treg失衡。
他汀类药物是治疗动脉粥样硬化的常规药物,但其对Th17、Treg数量影响的研究较少。有研究显示,给予ApoE-/-小鼠辛伐他汀处理后,斑块内Treg数量增加,Foxp3、IL-10和TGF-β mRNA及蛋白表达均增加,血液IL-17水平降低[13]。王治校等[14]研究认为,阿托伐他汀能够增加急性冠脉综合征患者外周血Treg比例并增强其功能。本研究结果显示,应用阿托伐他汀后,阿托伐他汀组外周血Treg比例、Foxp3 mRNA表达量和TGF-β蛋白水平均较用药前升高,Th17及其效应分子表达量降低,提示阿托伐他汀有助于纠正Th17/Treg失衡。阿托伐他汀组术后Th17、Treg比例及其效应分子水平与健康组比较差异仍有统计学意义,提示3个月的阿托伐他汀治疗尚不足以完全纠正Th17/Treg失衡,可能需更长时间的用药,同时也需进一步研究其他改善Th17/Treg失衡的治疗方案。
综上所述,颈动脉粥样硬化患者外周血Th17比例增加,Treg比例降低,存在Th17/Treg失衡;阿托伐他汀治疗有助于纠正Th17/Treg失衡。
参考文献:
[1] Pant S, Deshmukh A, Gurumurthy GS, et al. Inflammation and atherosclerosis--revisited[J]. J Cardiovasc Pharmacol Ther, 2014,19(2):170-178.
[2] Taleb S, Tedgui A, Mallat Z. IL-17 and Th17 cells in atherosclerosis: subtle and contextual roles[J]. Arterioscler Thromb Vasc Biol, 2015,35(2):258-264.
[3] Chistiakov DA, Sobenin IA, Orekhov AN. Regulatory T cells in atherosclerosis and strategies to induce the endogenous atheroprotective immune response[J]. Immunol Lett, 2013,151(1-2):10-22.
[4] Park BV, Pan F. The role of nuclear receptors in regulation of Th17/Treg biology and its implications for diseases[J]. Cell Mol Immunol, 2015,12(5):533-542.
[5] 尤亚红.调节性T淋巴细胞/辅助性T淋巴细胞17失衡在自身免疫性疾病中的研究进展[J].国际输血及血液学杂志,2015,38(6):541-545.
[6] Butcher MJ, Gjurich BN, Phillips T, et al. The IL-17A/IL-17RA axis plays a proatherogenic role via the regulation of aortic myeloid cell recruitment[J]. Circ Re, 2012,110(5):675-687.
[7] Gao Q, Jiang Y, Ma T, et al. A critical function of Th17 proinflammatory cells in the development of atherosclerotic plaque in mice[J]. J Immunol, 2010,185(10):5820-5287.
[8] Li Q, Wang Y, Wang Y, et al. Treg/Th17 ratio acts as a novel indicator for acute coronary syndrome[J]. Cell Biochem Biophys, 2014,70(2):1489-1498.
[9] Ghourbani GS, Andalib A, Hashemi M, et al. CD4+Foxp3+Treg and its ICOS+subsets in patients with myocardial infarction[J]. Iran J Immunol, 2012,9(1):53-60.
[10] Klingenberg R, Gerdes N, Badeau RM, et al. Depletion of FOXP3+regulatory T cells promotes hypercholesterolemia and atherosclerosis[J]. J Clin Invest, 2013,123(3):1323-1334.
[11] Li Q, Wang Y, Wang Y, et al. Distinct different sensitivity of Treg and Th17 cells to Fas-mediated apoptosis signaling in patients with acute coronary syndrome[J]. Int J Clin Exp Pathol, 2013,6(2):297-307.
[12] 贾宁,韩锟,闵连秋.脑梗死患者外周血CD4+CD25+调节性T细胞水平与颈动脉粥样硬化的相关性[J].中国动脉硬化杂志,2014,22(7):715-717.
[13] Meng X, Zhang K, Li J, et al. Statins induce the accumulation of regulatory T cells in atherosclerotic plaque[J]. Mol Med, 2012,9(18):598-605.
[14] 王治校,王洁,何茜,等.急性冠脉综合征患者体内CD4+CD25+Foxp3+调节性T细胞的变化及阿托伐他汀对其影响[J].湖北医药学院学报,2017,36(1):40-44.

