Na3AlF6-K3AlF6-AlF3-LiF-CaF2-MgF2熔体中Al2O3的溶解度
方 钊,程伍丹,辛鹏飞,田忠良,周 亮,张文根,沈 冰,张正英,赖延清
Na3AlF6-K3AlF6-AlF3-LiF-CaF2-MgF2熔体中Al2O3的溶解度
方 钊1,程伍丹1,辛鹏飞2,田忠良2,周 亮3,张文根2,沈 冰3,张正英3,赖延清2
(1. 西安建筑科技大学 冶金工程学院,西安 710055;2. 中南大学 冶金与环境学院,长沙 410083;3. 青海西部水电有限公司,海东 810800)
采用旋转刚玉片−氮氧分析法研究中熔体中K3AlF6、LiF和AlF3含量对其Al2O3溶解度的影响,探讨熔体物相组成、温度及过热度对Al2O3溶解度的影响机制。结果表明:K3AlF6、LiF及AlF3通过影响熔体物相组成对Al2O3溶解度产生影响;K3AlF6的添加有助于提高熔体Al2O3溶解度,但LiF和AlF3的添加会对熔体Al2O3溶解度产生不利影响。在相同熔体温度条件下,与过热度相比较,K3AlF6对Al2O3溶解度的影响较大,且Al2O3溶解度随K3AlF6含量的增加而增加,且增加幅度分别为0.46%和0.16%;LiF含量的增加会使熔体Al2O3溶解度显著减低,降幅最高可达21.64%。在相同温度下,AlF3对熔体Al2O3溶解度影响较小;但在相同过热度条件下,AlF3含量的增加将明显降低Al2O3的溶解度,降幅最高可达8.20%。
铝电解;钾冰晶石;电解质;溶解度;氧化铝
铝是国民经济建设、战略新兴产业和国防科技工业发展不可缺少的重要基础原材料,其生产量、消费量仅次于钢铁。2016年,全球原铝总产量为5989万t,而我国原铝产量自2002年以来,一直位居全球第一,2016年的达3164万t,占全球总产量的52.8%[1]。为了缓和原铝工业快速发展引起的铝土矿资源相对不足的矛盾,国内除进口大量高品质铝土矿资源外,也对产自河南、山西等地富含碱金属元素的中低品位铝土矿资源加以开发利用,导致铝电解用原料Al2O3中的杂质元素Li和K的含量相对较高,并不断在电解槽内得以富集,从而使电解质组成发生改变并形成富含Li、K盐的复杂铝电解质体系Na3AlF6-AlF3-LiF-KF- CaF2-MgF2-Al2O3(据报道,电解质中Li盐和K盐含量二者之和最高可达10%~14%,质量分数)[2−7]。
现行原铝生产工艺一直沿用1886年HALL等[8]提出的Hall-Héroult熔盐电解法,该生产过程顺利进行的关键在于Al2O3能否溶解进入铝电解质中。为此,研究人员不但研究了Al2O3在Na3AlF6-AlF3熔体中的溶解特征,也针对该体系内含有添加剂如CaF2、MgF2以及Li盐和K盐时构成的Na3AlF6-AlF3-CaF2- MgF2-LiF或Na3AlF6-AlF3-CaF2-MgF2-KF体系进行了研究[8−9]。如SKYBAKMOEN等[10]、ØDEGARD等[11]和VASYONINA等[12]针对氟化物Na3AlF6-Li3AlF6- AlF3及添加有CaF2、MgF2的电解质,研究了Al2O3在该熔体中的溶解度。LI等[13]、周传华等[14]和孟庆勇等[15]研究Al2O3在初晶温度为750~900 ℃范围内的氟化物Na3AlF6-K3AlF6-AlF3熔体中的溶解度并获得了经验公式。杨建红等[16−17]通过对Al2O3在NaF-KF-AlF3体系中溶解度的研究,认为体系中添加NaF、LiF、CaF2后,熔体溶解Al2O3的能力降低,其影响顺序为LiF、NaF、CaF2,且电解质中形成了NaCaAlF6和Na3Li3(AlF6)2等复合盐,离子团AlF63−的增加会降低熔体对Al2O3的溶解能力。尽管针对同时富含K-Li盐的Na3AlF6-K3AlF6-AlF3-LiF熔体,黄有国等[18]研究了其溶解Al2O3的能力,但是,该研究采用的熔体组成中,K3AlF6含量(K3AlF6在Na3AlF6+K3AlF6中的含量,下同)为0~40%(质量分数),AlF3含量为20%~24%。显然,这种低NaF与AlF3摩尔比组成的氟化物熔盐体系,与现行铝电解生产中所采用的电解质组成存在较大差异。
因此,针对Al2O3在Li盐和K盐共存的铝电解质Na3AlF6-K3AlF6-LiF-AlF3中溶解行为的研究还不够完善,特别是当电解质中还含有添加剂CaF2、MgF2等时,其基础数据更是缺乏。本文作者以与现行工业电解质相接近的熔体组成Na3AlF6-K3AlF6-AlF3-LiF-KF- CaF2-MgF2为对象,研究Al2O3在该电解质组成中的溶解度以及熔体K3AlF6、LiF和AlF3含量对其溶解度的影响,以期获得电解质组成与Al2O3在熔体中溶解度的关系,为现行铝电解生产技术参数的设计与调整提供基础数据。
1 实验
1.1 实验原料
实验所用原料Na3AlF6、K3AlF6、LiF、CaF2和MgF2均为分析纯试剂;AlF3为工业纯,其在实验室中经蒸馏提纯后使用;本实验中采用旋转刚玉片法[10]测定Al2O3在铝电解质中的溶解度,所使用刚玉片来自上海五联新型陶瓷有限公司,其Al2O3含量大于99%。所有原料使用前均置于180 ℃的真空干燥箱中恒温24 h以上,以消除水份的影响。
1.2 实验过程
实验装置如图1所示。按电解质组份Na3AlF6-K3AlF6-AlF3-LiF-KF-CaF2-MgF2(CaF2和MgF2的含量分别固定为5%和2%,质量分数), Na3AlF6、K3AlF6、AlF3、LiF和KF根据实验所需要的比例称量后进行充分混合,与高纯石墨坩埚一起置于气氛实验电炉中,通入保护性气体N2(避免升温过程电解质组份的氧化)30 min,再开始升温至目标温度。待电解质充分熔化后,将带有刚玉片的不锈钢杆浸入熔体中并以100 r/min速度搅拌;同时,每30 min取电解质样一次,实验结束后分析熔体中的Al2O3浓度。为减小电解质挥发带来的误差,实验过程在盛装熔体的石墨坩埚上盖刚玉片。
1.3 分析检测
由于本实验所采用的电解质中,仅Al2O3为含氧物质,可以通过分析电解质中的氧含量来获得熔体中Al2O3浓度。因此,对所取电解质试样中Al2O3浓度采用红外氮氧分析仪(LECOTC−400)进行分析[9, 17]。电解质物相组成分析是在Rigaku3014衍射仪上进行,Cu靶,石墨单色器,扫描范围为5°~85°,扫描速度为0.04 (°)/min。
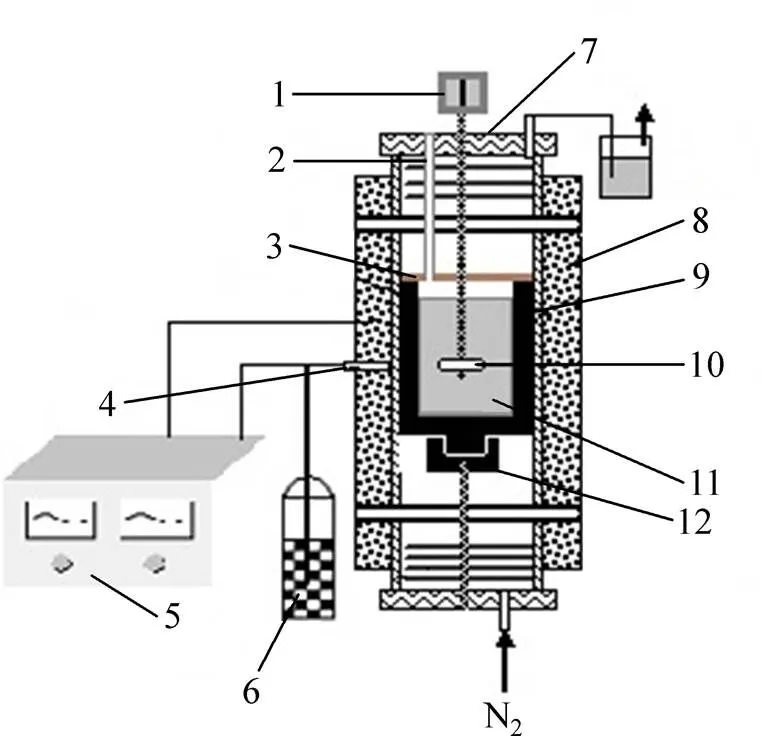
图1 Al2O3溶解度测定装置示意图
2 结果与讨论
2.1 熔体中Al2O3溶解度的确定
图2所示为Al2O3在电解质熔体中浓度与溶解时间的关系。在实验开始的1 h内,熔体中Al2O3浓度增加迅速,随后,增速逐渐放缓。当实验进行3.5 h后,随着实验的继续进行,Al2O3在熔体中的浓度变化很小(浓度变化范围仅为0~0.02%),这表明Al2O3在熔体中的浓度达到饱和,此时的浓度即为该条件下Al2O3在熔体中的溶解度。
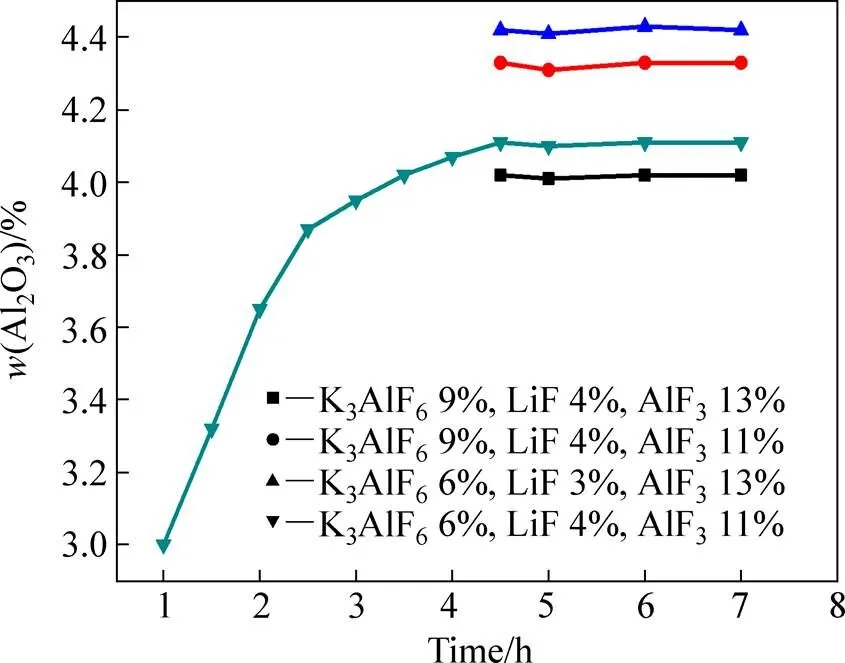
图2 Al2O3溶解浓度与溶解时间关系图
2.2 钾盐对含锂电解质熔体Al2O3溶解度的影响
表1所列为相同熔体温度、不同AlF3含量条件下K3AlF6含量对电解质熔体Al2O3溶解度的影响。从表1中可以看出,随着K3AlF6含量的增大,熔体中Al2O3的溶解度逐渐增加,说明对于含锂工业电解质体系,钾盐同样有助于提高Al2O3在其中的溶解度。在LiF含量为1%、AlF3含量为11%的条件下,当K3AlF6含量从6%增加到9%时,熔体中Al2O3的溶解度将从5.46%增加到5.77%,Al2O3溶解度提高了0.31%;而当K3AlF6含量继续从9%增加到12%时,熔体中Al2O3的溶解度进一步增加到了5.91%,比K3AlF6含量为9%时的溶解度,熔体中Al2O3的溶解度增加了0.14%。
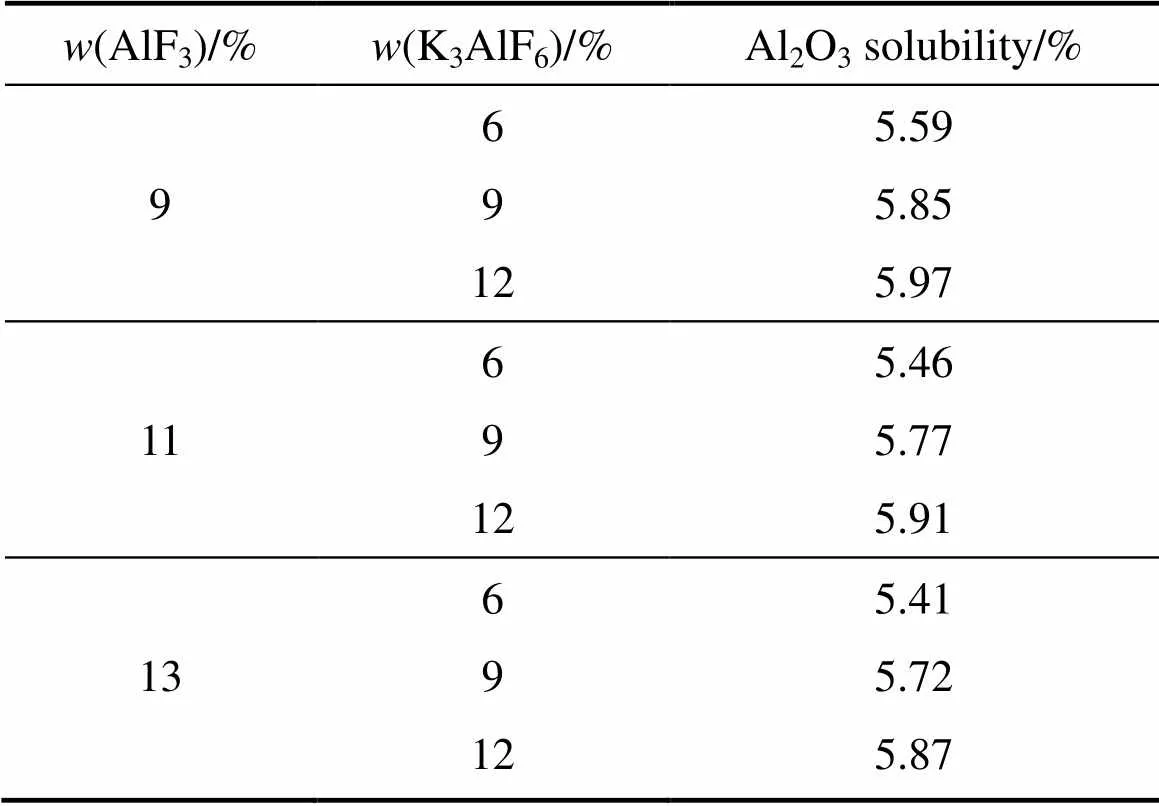
表1 K3AlF6含量对不同AlF3含量电解质熔体Al2O3溶解度的影响
表2所列为LiF含量为3%、熔体温度为925 ℃时不同AlF3含量电解质体系中K3AlF6含量对熔体Al2O3溶解度的影响。从表2中可以看出,在AlF3为13%的条件下,当K3AlF6含量从6%增加到9%时,熔体的Al2O3溶解度从5.16%提高到了5.33%,Al2O3溶解度增加了0.28%。当K3AlF6含量进一步增加到12%时,Al2O3的溶解度比K3AlF6含量为9%时又增加了0.11%。由此可见,在熔体温度相同的条件下,随着K3AlF6含量的提高,Al2O3在熔体中的饱和含量不断提高,说明K3AlF6含量的提高,有助于提高电解质的Al2O3溶解能力。
Al2O3在电解质中的溶解过程伴随着一系列极为复杂的反应,由于高温熔盐的特殊性,对其溶解过程细节尚缺乏具体研究,通过拉曼光谱,研究人员对Al2O3在电解质中的溶解机理有所认识,反应方程式(1)~(5)即说明了Al2O3在电解质中的溶解过程[19−21]:
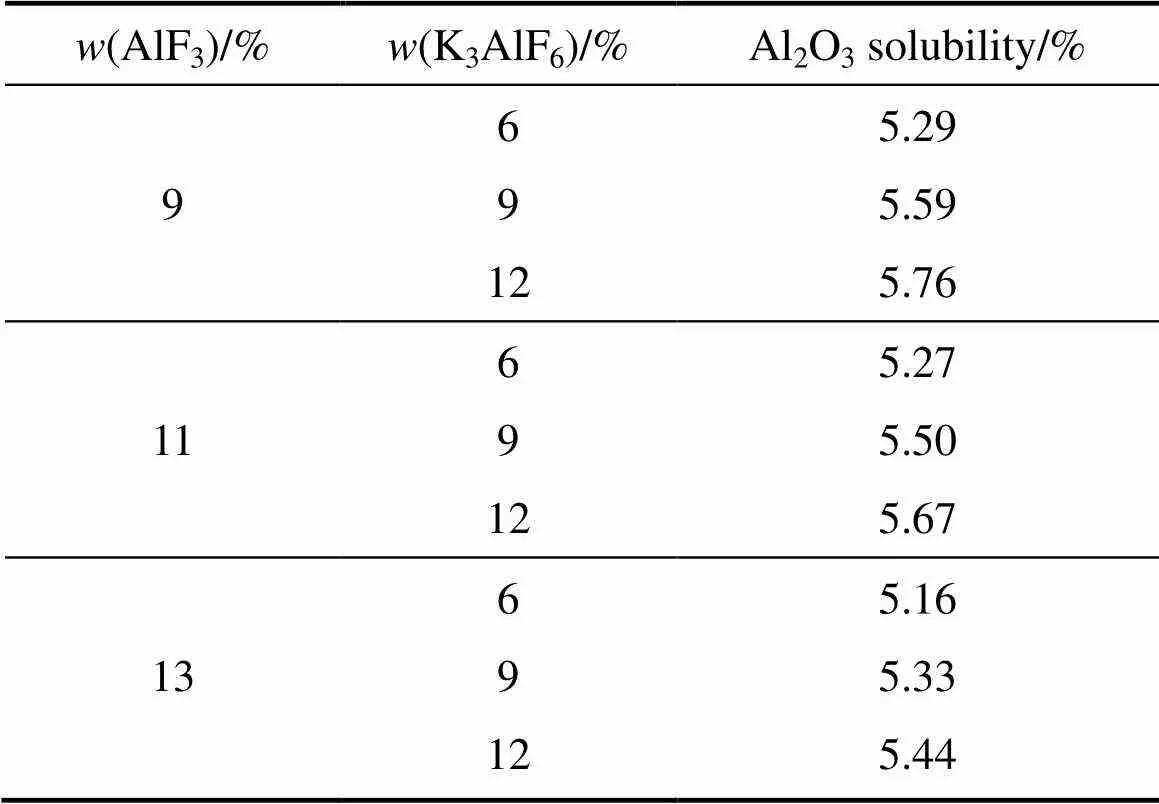
表2 K3AlF6含量对不同AlF3含量电解质Al2O3溶解度的影响


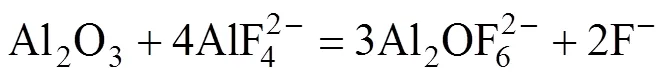

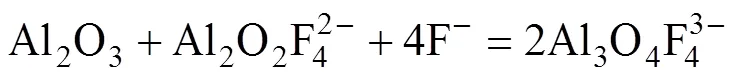
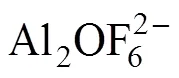
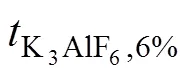

表3 K3AlF6对不同AlF3含量电解质熔体Al2O3溶解度的影响
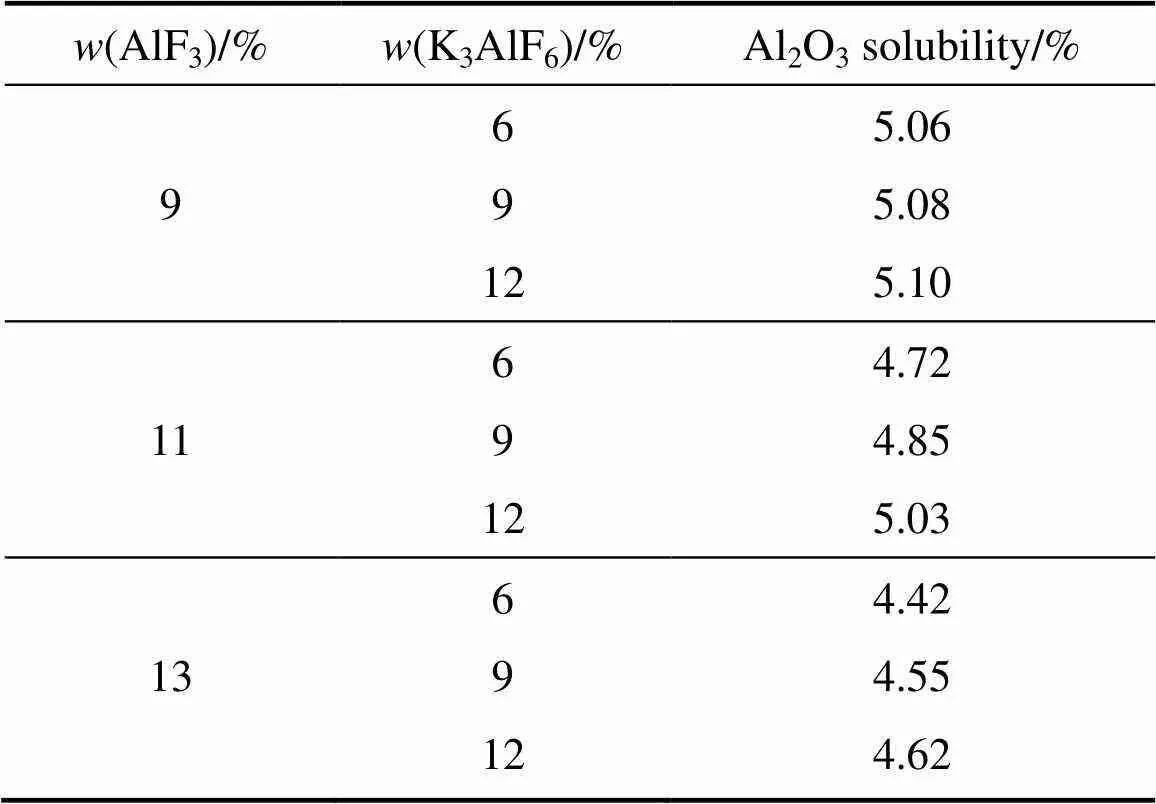
表4 K3AlF6对不同AlF3含量电解质熔体Al2O3溶解度的影响
表5所列为相同熔体温度时不同LiF含量条件下K3AlF6含量对熔体Al2O3溶解度的影响。从表5中可以看出,随着K3AlF6含量的增加,熔体的Al2O3溶解度逐渐增加。在LiF含量为2%的条件下,当K3AlF6含量从6%增加到12%时,K3AlF6含量每增加1%,熔体的Al2O3溶解度平均增加0.09%;而在LiF含量为3%的条件下,当K3AlF6含量从6%增加到12%时,K3AlF6含量每增加1%,熔体的Al2O3溶解度平均增加0.08%。由此可以看出,不同LiF含量条件下,K3AlF6含量的增加所引起的Al2O3溶解度的增幅,基本一致。
表6所列为相同过热度、不同LiF含量条件下K3AlF6含量对熔体Al2O3溶解度的影响。从表6可以看出,在过热度为10 ℃、LiF含量为1%的条件下,当K3AlF6含量从6%增加到12%时,K3AlF6含量每增加1%,熔体Al2O3溶解度平均增加0.02%;而在LiF含量为3%的条件下,当K3AlF6含量从6%增加到12%时,K3AlF6含量每增加1%,熔体Al2O3溶解度平均增加0.05%。由此可以看出,在LiF含量较高的情况下,随着K3AlF6含量的增加,熔体的Al2O3溶解度增幅较大。

表5 K3AlF6含量对不同LiF含量电解质熔体Al2O3溶解度影响
2.3 锂盐对含钾工业铝电解质体系Al2O3溶解度的影响
图3所示为不同AlF3含量条件下熔体中LiF含量对Al2O3溶解度的影响。结果表明,在相同熔体温度或相同过热度的条件下,熔体中LiF的添加均会导致Al2O3溶解度的降低,且降低幅度较大。

表6 K3AlF6对不同LiF含量电解质熔体Al2O3溶解度 影响
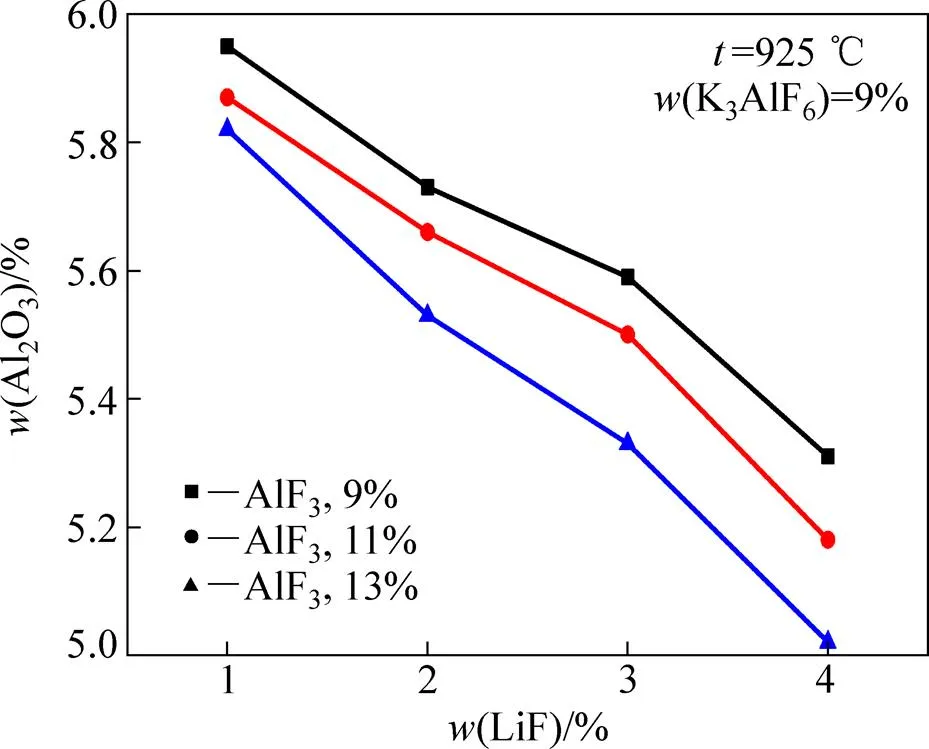
图3 不同AlF3含量条件下熔体LiF含量对Al2O3溶解度的影响
从图3中可以看出,在AlF3含量为11%的条件下,当LiF含量从1%增加到4%时,熔体Al2O3溶解度从5.77%降低到了5.18%,熔体中每添加1%的LiF,Al2O3溶解度的平均降低值为0.20%。通过对比可以看出,熔体中LiF的添加所引起的Al2O3溶解度的降低幅度大于K3AlF6的添加所引起的Al2O3溶解度的提高 幅度。
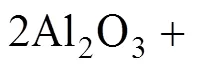
图4所示为相同过热度不同AlF3含量条件下熔体LiF含量对Al2O3溶解度的影响。从图4中可以看出,在熔体AlF3含量为11%的条件下,随着熔体LiF含量的提高,Al2O3溶解度显著降低。同时,从图4中还可以看出,熔体中LiF含量每添加1%,熔体Al2O3溶解度分别降低0.16%、0.38%、0.52%。降幅超过了相同熔体温度条件下LiF对熔体Al2O3溶解度的影响。出现这种现象的主要原因仍归结为Al2O3溶解过程的热效应。在AlF3含量为11%、K3AlF6含量为9%的熔体中,当LiF从1%增加至2%、3%和4%时,熔体的初晶温度将从899.3 ℃分别降低到892.8、887.8和885.1 ℃。在保持过热度相同的情况下,随着初晶温度的降低,熔体温度将随初晶温度的降低而降低。由于Al2O3在溶解过程中,与熔体中的其他离子络合而生成新的更复杂Al—O—F络合离子,而熔体温度的降低不利于新的络合离子生成,从而表现出Al2O3溶解度降低。因此,在温度和LiF的共同作用下,熔体中的Al2O3溶解度的降低幅度显著。
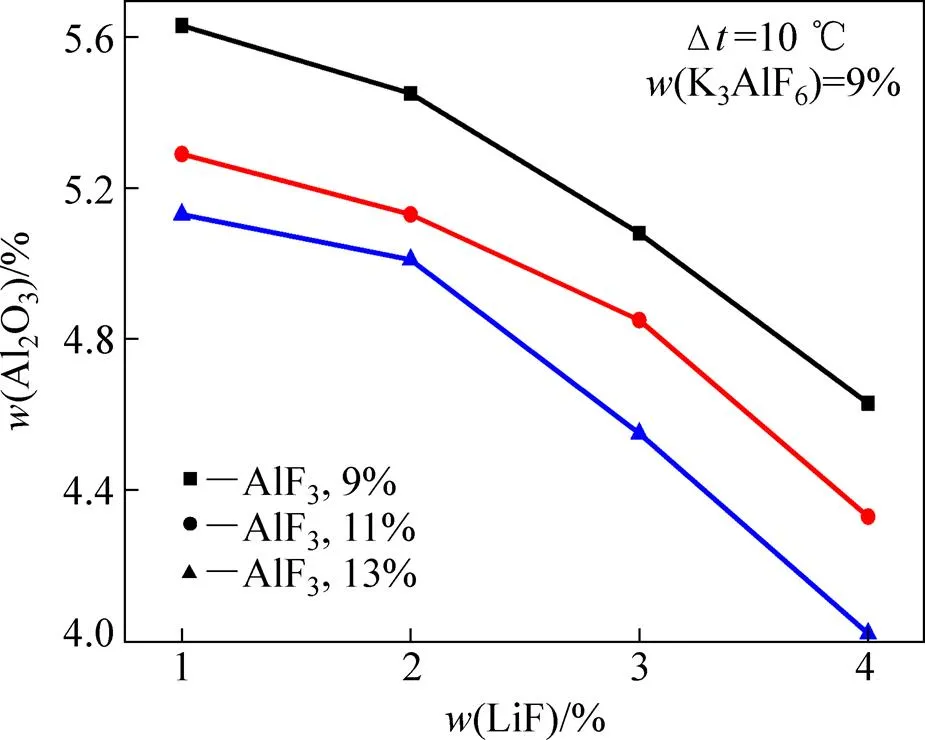
图4 不同AlF3含量条件下LiF含量对熔体Al2O3溶解度的影响
图5所示为相同熔体温度不同K3AlF6含量条件下熔体LiF含量对熔体Al2O3溶解度的影响。从图5中可以看出,在不同K3AlF6含量条件下,随着熔体中LiF含量的增加,熔体中Al2O3的溶解度均呈明显的降低趋势。当K3AlF6含量为6%、LiF含量从1%增加到4%时,熔体Al2O3溶解度从5.46%降低到了5.03%,降低值为0.43%;而当K3AlF6含量为12%、LiF含量从1%增加到4%时,熔体Al2O3溶解度从5.91%降低到5.31%,降低值为0.6%。
已有研究表明[10, 25],在相同熔体温度不含钾盐的电解质体系当中,LiF含量每增加1%,熔体的Al2O3溶解度平均降低0.28%。相比之下,在含钾电解质体系当中,当LiF含量为1%~3%时,LiF对熔体Al2O3溶解度的影响小于不含钾电解质体系中LiF的影响;而当LiF从3%增加到4%时,在含钾电解质体系中,LiF对熔体Al2O3溶解度的影响,相对较大。
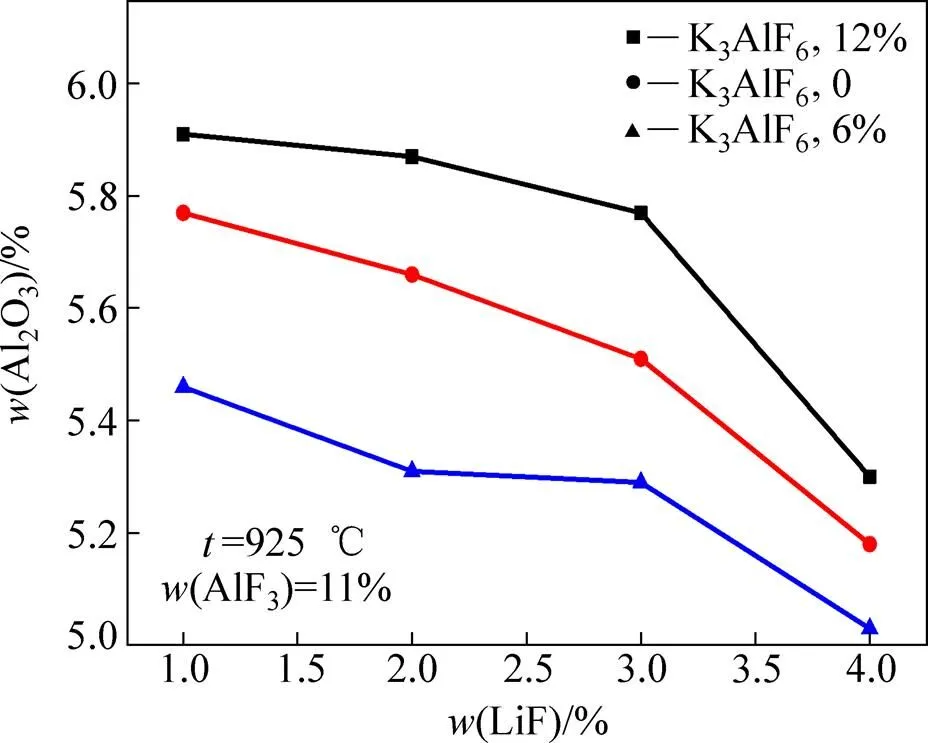
图5 不同K3AlF6含量条件下LiF含量对熔体Al2O3溶解度的影响
图6所示为相同过热度不同K3AlF6含量条件下LiF对熔体Al2O3溶解度的影响。从图6中可以看出,在不同K3AlF6含量条件下,LiF的添加均对熔体的Al2O3溶解度有明显的降低作用。在K3AlF6含量为12%的条件下,当LiF含量从1%增加到2%、3%和4%时,熔体的Al2O3溶解度分别降低了0.15%、0.18%和0.59%。文献[25]中的研究表明,在过热度相同的条件下,在不含钾盐的电解质体系中,当LiF含量从1%增大到2%、3%和4%时,熔体的Al2O3溶解度分别降低了0.63%、0.62%、0.55%。可以看出,在含钾电解质体系当中,当LiF含量为1%~3%时,LiF对熔体Al2O3溶解度的影响小于不含钾电解质体系中其对熔体Al2O3溶解度的影响;而当LiF从3%增加到4%时,在含钾电解质体系中,LiF的影响,相对较大。
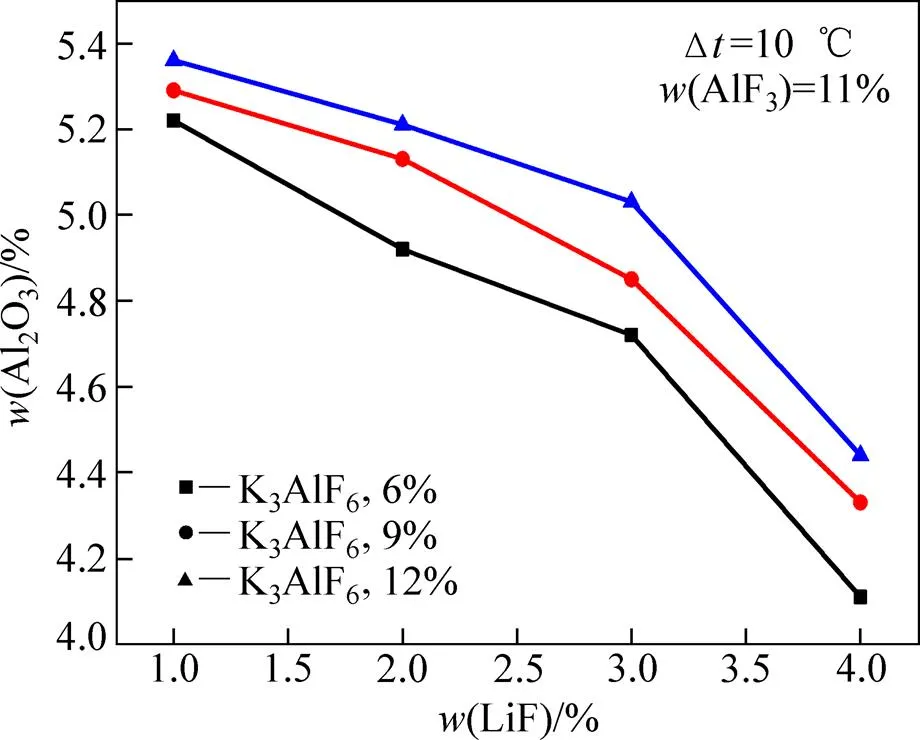
图6 LiF对不同K3AlF6含量电解质熔体Al2O3溶解度的 影响
2.4 AlF3对含钾、锂盐工业铝电解质Al2O3溶解度的影响
表7所示为相同熔体温度不同K3AlF6含量条件下AlF3含量对熔体Al2O3溶解度的影响。从表7中可以看出,随着熔体中AlF3含量的增加,熔体的Al2O3溶解度随之降低。在LiF含量为3%、K3AlF6含量为9%的条件下,当AlF3含量从9%增加到13%时,熔体Al2O3溶解度从5.59%降低到5.33%。
研究表明[27−29],当Al2O3在熔体中的浓度较低时,会发生式(6)和式(7)所示的反应:

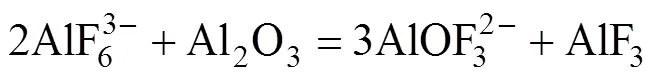
5NaAlF4(s)=Na5Al3F14(s) + 2AlF3(s)
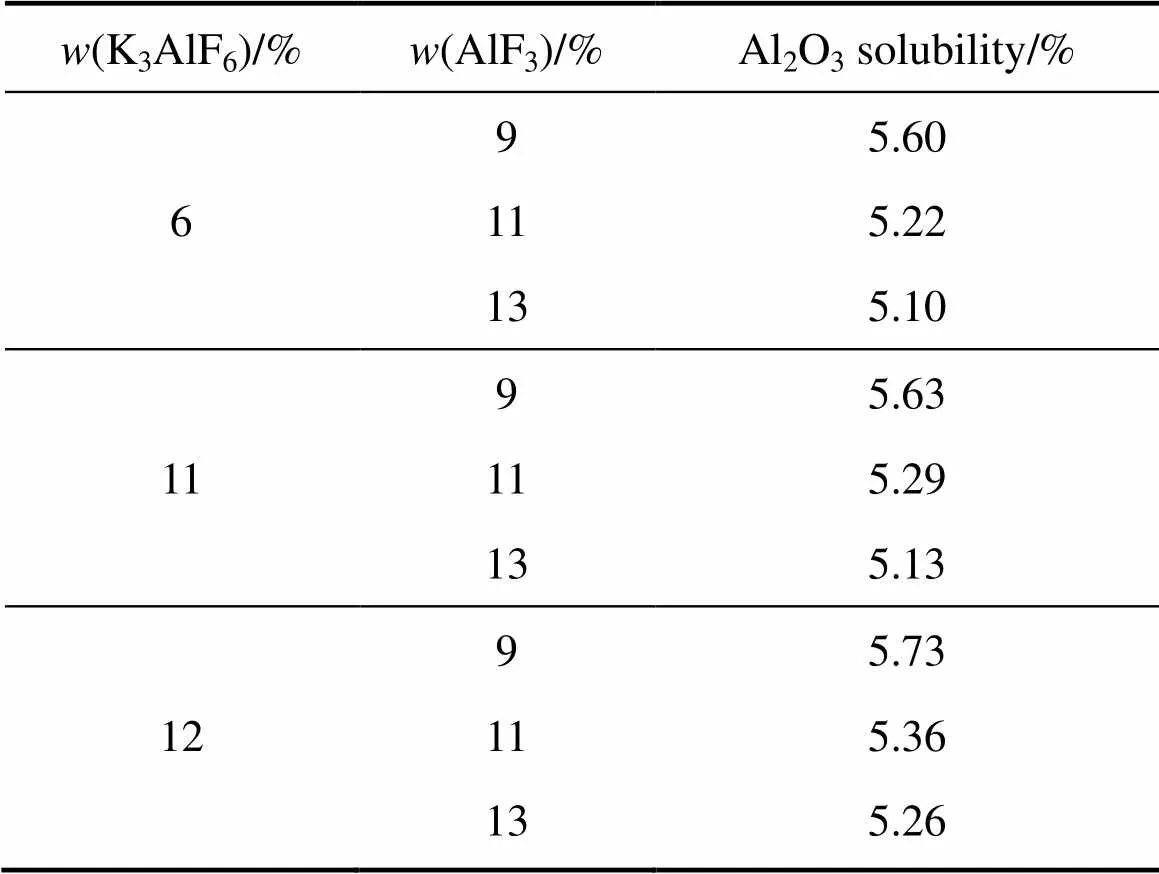
表7 不同K3AlF6含量条件下AlF3含量对熔体Al2O3溶解度的影响
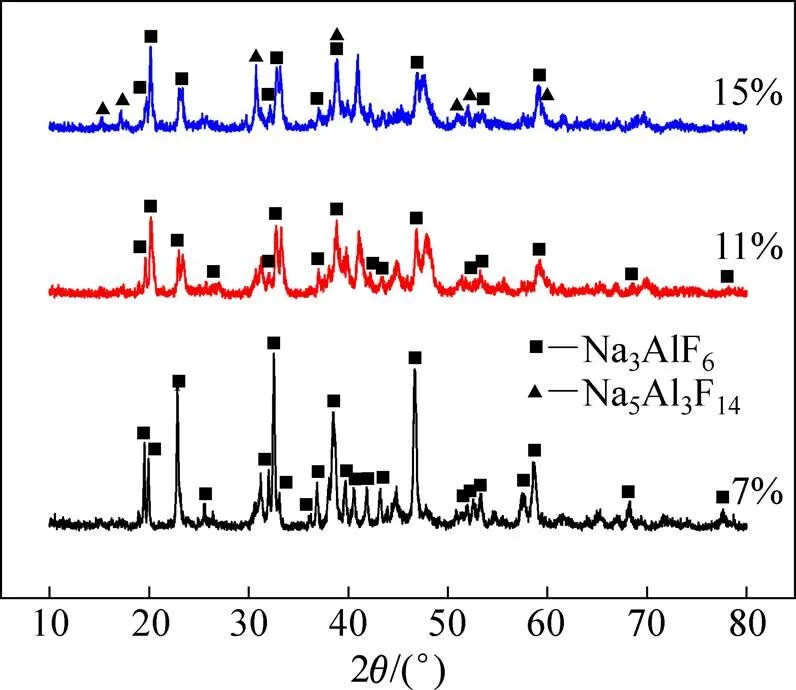
图7 不同AlF3含量电解质淬冷物的物相分析
表8所列为相同过热度不同K3AlF6含量条件下AlF3含量对熔体Al2O3溶解度的影响。从表8中可以看出,随着AlF3含量的增加,熔体Al2O3溶解度均呈现出降低的趋势。且与相同熔体温度条件下AlF3的影响相比,其所导致的熔体Al2O3溶解度的降低,更为显著。
由表8可知,当熔体中AlF3含量从9%增加到13%时,Al2O3在其中的溶解度将从5.08%降低至4.55%。相比之下可以看出,熔体Al2O3溶解度受AlF3的影响大于相同熔体温度条件下AlF3的影响。这主要是由于在相同过热度条件下,熔体Al2O3溶解度的变化受AlF3含量和温度两者的共同影响。
表9所示为相同温度不同LiF含量条件下AlF3对熔体Al2O3溶解度的影响。从表9中可以看出,在LiF含量为1%的条件下,当AlF3含量从9%增加到13%时,熔体的Al2O3溶解度从5.85%降低到5.72%;而在熔体中LiF含量为4%的条件下,当AlF3含量从9%增加到13%时,熔体的Al2O3溶解度将从5.31%降低到5.02%。可见,熔体中LiF的增加将强化AlF3对熔体Al2O3溶解度的降低作用。

表8 AlF3对不同K3AlF6含量电解质熔体Al2O3溶解度的影响
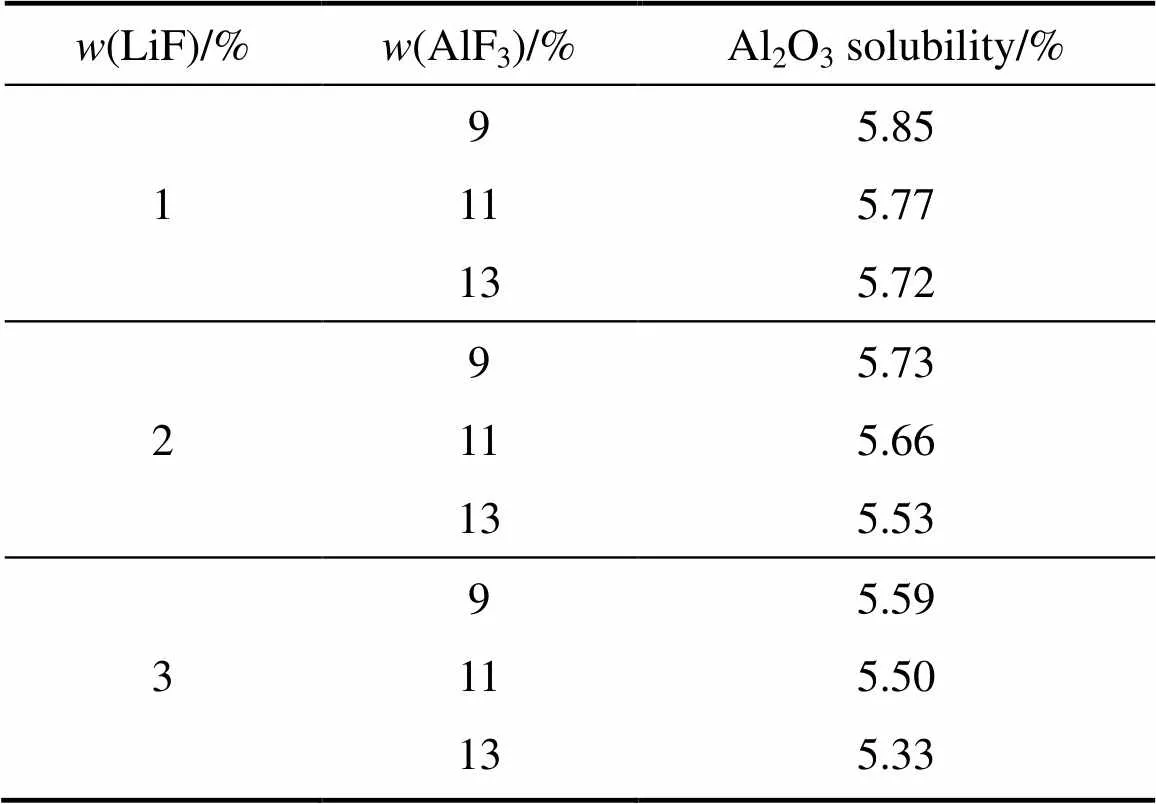
表9 AlF3对不同LiF含量电解质熔体Al2O3溶解度的影响
表10所列为相同过热度不同LiF含量条件下AlF3对熔体Al2O3溶解度的影响。相比之下。由图10可以看出,在相同过热度条件下,AlF3含量对Al2O3溶解度的影响大于相同熔体温度条件下其对熔体Al2O3溶解度的影响。这主要是由于相同过热度条件下,熔体Al2O3溶解度受AlF3含量与熔体温度共同作用的影响。随着熔体中AlF3含量的提高,电解质熔体的初晶温度随之降低,因此,在保持熔体过热度为10 ℃的条件下,增加熔体中AlF3的含量,会导致实际的熔体温度降低;同时,AlF3自身也会对Al2O3在熔体中的溶解过程产生抑制作用。受AlF3和熔体温度两者的共同作用,在相同过热度条件下,AlF3会对熔体的Al2O3溶解度产生更为显著的影响,即熔体中AlF3含量的增加所引起的熔体Al2O3溶解度的降低幅度,更为显著。
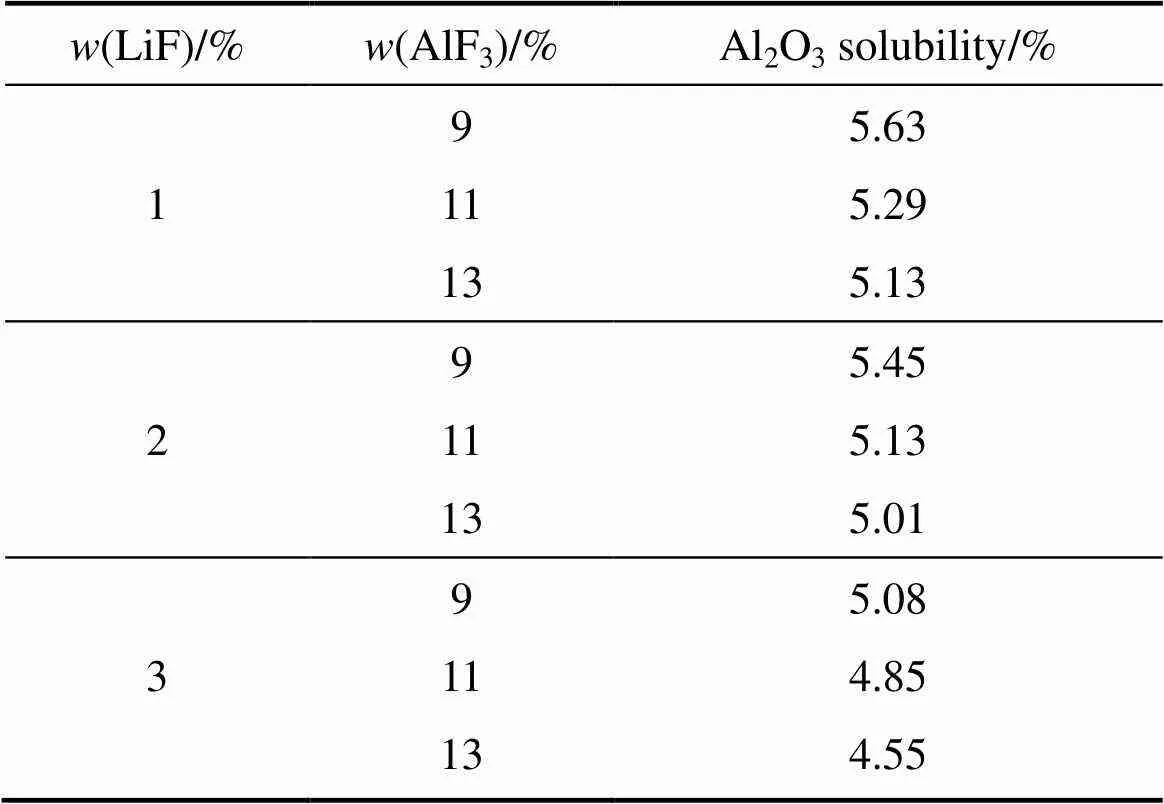
表10 AlF3对不同LiF含量电解质熔体Al2O3溶解度的影响
3 结论
1) 钾冰晶石(K3AlF6)的添加有助于提高含锂熔盐电解质体系中Al2O3的溶解度。在相同熔体温度条件下,K3AlF6含量对熔体Al2O3溶解度的影响大于相同过热度条件下K3AlF6含量对熔体Al2O3溶解度的影响。在熔体温度为925 ℃,当熔体K3AlF6含量从6%增加到12%时,熔体Al2O3溶解度从5.41%增加到5.87%,增幅为0.46%。而在相同条件下,当熔体过热度均为10 ℃时,随着熔体K3AlF6含量的增加,熔体Al2O3的溶解度从5.10%增加到5.26%,增幅仅为0.16%。
2) LiF的添加会导致含钾电解质熔体Al2O3溶解度的降低。在熔体过热度相同的条件下,LiF对熔体Al2O3溶解度的影响比相同熔体温度条件下,其对熔体Al2O3溶解度的影响大。在熔体温度为925 ℃,当熔体LiF含量从1%增加到4%时,熔体Al2O3的溶解度从5.72%降低到5.02%,降幅为12.24%;而在相同条件下,当熔体过热度均为10 ℃时,随着熔体中LiF含量的增加,熔体Al2O3的溶解度将从5.13%降低到4.02%,降幅达到了21.64%。
3) 随着熔体AlF3含量的增加,Al2O3在其中的溶解度均呈降低趋势,且在过热度相同的条件下,AlF3对Al2O3溶解度的影响大于相同熔体温度条件下AlF3的影响。在熔体温度为925 ℃,当AlF3含量从9%增加到13%时,熔体中Al2O3的溶解度将从5.97%降低到5.87%;而在相同条件下,当熔体过热度均为10 ℃时,随着熔体中AlF3含量的增加,熔体中Al2O3的溶解度将从5.73%降低到5.26%。
[1] International aluminum institute. Primary aluminum production[EB/OL]. [2017−10−20]. http://www.world- aluminium.org/statistics/primary-aluminium-production/#data.
[2] 张佰永, 姜跃华, 郭 沈, 周凤禄.中国铝土矿资源变化对世界氧化铝工业格局的影响[J]. 轻金属, 2014(7): 1−5.
ZHANG Bai-yong, JIANG Yue-hua, GUO Shen, ZHOU Feng-lu. The influence of bauxite resource change in china on layout of world alumina industry[J]. Light Metals, 2014(7): 1−5.
[3] FENG Nai-xiang, PENG Jian-ping, WANG Yao-wu, DI Yue-zhong, YOU Jin, LIAO Xian-an.Research and application of energy saving technology for aluminum reduction in china[C]//SUAREZ C E. Light Metals 2012. Drlando, FL: TMS, 2012: 563−568.
[4] 陈富强. 锂盐、钾盐对预焙槽生产的影响[J]. 材料与冶金学报, 2010, 9(S1): 148−150.
CHEN Fu-qiang. Effect of lithium salt and potassium salt on the production of prebake cell[J]. Journal of Materials and Metallurgy, 2010, 9(S1): 148−150.
[5] 程保生. 铝电解质体系中锂盐含量对技术参数的影响[J]. 甘肃冶金, 2012, 34(5): 24−26.
CHENG Bao-sheng. Effect of lithium salt content to technical parameters in the aluminum electrolyte system[J].Gansu Metallurgy, 2012, 34 (5): 24−26.
[6] 刘冬喜. 富锂电解质对铝电解工艺条件的影响及对策[J]. 轻金属, 2014(2): 30−33.
LIU Dong-xi. Influence of the Li rich electrolyte on aluminum reduction process and countermeasures[J]. Light Metals, 2014(2): 30−33.
[7] 李 茂, 白 晓, 李 远, 侯文渊, 高玉婷. 氧化铝颗粒的溶解控制机制及其临界特征[J]. 中国有色金属学报, 2016, 26(2): 455−464.
LI Mao, BAI Xiao, LI Yuan, HOU Wen-yuan, GAO Yu-ting. Control mechanisms and critical characteristics in dissolution of alumina particles[J]. The Chinese Journal of Nonferrous Metals, 2016, 26(2): 455−464.
[8] GRJOTHEIM K, KROHN C, MALINOVSKY M, MALINOVSKY K, THONSTAD J. Aluminum electrolysis fundamentals of the hall-héroult process[M]. Düsseldorf: Aluminum-Verlag, 1982: 56−61.
[9] ROBERT E, OLSEN J E, DANEK V, TIXHON E, ØSTVOLD T, GILBERT B. Structure and thermodynamics of alkali fluoride-aluminum fluoride-alumina melts: Vapor pressure and Raman spectroscopic studies[J]. Journal of Physics and Chemistry B, 1997, 101(46): 9447−9457.
[10] SKYBAKMOEN E, SOLHEIM A, STERTEN A. Alumina solubility in molten salt systems of interest for aluminum electrolysis and related phase diagram data[J]. Metallurgical and Materials Transactions B, 1997, 28(1): 81−86.
[11] ØDEGARD R, STERTEN A, THONSTAD J. On the solubility of aluminum in cryolitic melts[J]. Metallurgical Transactions B, 1988, 19(3): 449−457.
[12] VASYUNINA N V, VASYUNINA I P, MIKHALEV Y G, POLYAKOV P V. Solubility of aluminum in cryolite-alumina electrolytes[J]. Russian Journal of Non-Ferrous Metals, 2011, 52(4): 360−363.
[13] LI Jie, YUAN Chang-fu, TIAN Zhong-liang, WANG Jia-wei, LAI Yan-qing, LIU Ye-xiang. Alumina solubility in Na3AlF6-K3AlF6-AlF3molten salt system prospective for aluminum electrolysis at lower temperature[J]. Chemical Research in Chinese Universities, 2012, 28(1): 142−146.
[14] 周传华, 马淑兰, 李国勋. 新型低温铝电解质体系的研究-氧化铝的溶解度与溶解速度[J]. 有色金属, 1998, 50(2): 81−84.
ZHOU Chuan-hua, MA Shu-lan, LI Guo-xun. Studies on a new low temperature electrolysis system-solubility and dissolution rate of Al2O3[J]. Nonferrous Metals, 1998, 50(2): 81−84.
[15] 孟庆勇, 阚素荣, 卢世刚, 丁海洋,张向军. Na3AlF6-K3AlF6-AlF3体系组成对-Al2O3溶解度和溶解速度的影响[J]. 稀有金属, 2010, 34(6): 431−436.
MENG Qing-yong, KAN Su-rong, LU Shi-gang, DING Hai-yang, ZHANG Xiang-jun. Alumina solubility and dissolution rate of-Al2O3in K3AlF6-Na3AlF6-AlF3system[J]. Chinese Journal of Rare Metals, 2010, 34(6): 431−436.
[16] YAN Heng-wei, YANG Jian-hong, LI Wang-xing, CHEN Sha-zi. Alumina solubility in KF-NaF-AlF3-based low-temperature electrolyte[J]. Metallurgical and Materials Transactions B, 2011, 42(5): 1065−1070.
[17] YANG J H, GRACZYK D G, WUNSCH C, HRYN J N. Alumina solubility in KF-AlF3-based low-temperature electrolyte system[C]//SORLIE M. Light Metals 2007. Orlando, FL: TMS, 2007: 537−541.
[18] 黄有国, 田忠良, 赖延清, 李 劼, 刘业翔. LiF对Na3AlF6-K3AlF6-AlF3熔体初晶温度和Al2O3溶解度的影响[J]. 中国有色金属学报, 2010, 20(5): 903−907.
HUANGYou-guo, TIAN Zhong-liang, LAI Yan-qing, LI Jie, LIU Ye-xiang. Effect of LiF on liquidus temperature and solubility of Al2O3in Na3AlF6-K3AlF6-AlF3melts[J].The Chinese Journal of Nonferrous Metals, 2010, 20(5): 903−907.
[19] GILBERT B, ROBERT E, TIXHON E, OLSEN J E, ØSTVOLD T. Structure and thermodynamics of NaF-AlF3melts with addition of CaF2and MgF2[J]. Inorganic Chemistry, 1996, 35: 4198−4210.
[20] ZHANG Y S, WU X, RAPP R A. Solubility of alumina in cryolite melts: Measurements and modeling at 1300k[J]. Metallurgical and Materials Transactions B, 2003, 34(2): 235−242.
[21] GILBERT B, MATERNE T. Reinvestigation of molten fluoroaluminate Raman spectra: The question of the existence of AlF52−ions[J].Applied Spectroscopy, 1990, 44(2): 299−304.
[22] SANCHEZ S R, PICARD G S. Solubility and diffusion of metallic iron in liquid Bi metal at 450 ℃[J]. Electrochemistry Communications, 2004, 6(9): 944−954.
[23] ODEGARD R, STERTEN A, THONSTAD J. On the solubility of aluminum carbide and electrodeposition of carbon in cryolitic melts[J]. Journal of the Electrochemical Society, 1987, 134(5): 1088−1092.
[24] 邱竹贤. 预焙槽炼铝[M]. 北京: 冶金工业出版社, 2005: 311−314.
QIU Zhu-xian. Smelting aluminum with pre-baking aluminum reduction cell[M]. Beijing: Metallurgical Industry Press, 2005: 311−314.
[25] SKYBAKMOEN E, SOLHEIM A, STERTEN A. Phase diagram data in the system Na3AlF6-Li3AlF6-AlF3-Al2O3part Ⅱ: Alumina Solubility[C]//CHRISTIAN M B. Light Metals1990. Warrendale, PA: TMS, 1990: 317−323.
[26] YOSHIDA K, DEWING E W. The apparent solubility of aluminum in cryolite melts[J]. Metallurgical Transactions, 1972, 3(7): 1817−1821.
[27] SOLHEIM A, ROLSETH S, SKYBAKMOEN E. Liquidus temperature and alumina solubility in the system Na3AlF6-AlF3-LiF-CaF2-MgF2[C]//EVANS J. Light Metals1995. Orlando, FL: TMS, 1995: 451−460.
[28] SLEPPY W C, COCHRAN C N. Bench scale electrolysis of alumina in sodium fluoride-aluminum fluoride melts below 900 ℃[C]//PETERSON W S. Light metals 1979. New Orleans, LA: TMS, 1979: 385−395.
[29] HALVOR K, QIU Z X, YAOK, GRJOTHEIM K. Penetration of bath into the cathode lining of alumina reduction cells[C]//PAUL G C. Light Metals 1989. Warvendale, PA: TMS, 1989: 161−167.
[30] GRJOTHEIM K, KROHN C, MALINOVSKÝ M, MATIAŠOVSKÝ K, THONSTAD J. Aluminum electrolysis: The chemistry of the hall-héroult process[M]. Dussedlorf: Aluminium-Verlag, 1977: 21.
(编辑 李艳红)
Al2O3solubility in Na3AlF6-K3AlF6-AlF3-LiF-CaF2-MgF2molten salts
FANG Zhao1, CHENG Wu-dan1, XIN Peng-fei2, TIAN Zhong-liang2, ZHOU Liang3,ZHANG Wen-gen2, SHEN Bing3, ZHANG Zheng-ying3, LAI Yan-qing2
(1. School of Metallurgical Engineering, Xi’an University of Architecture and Technology, Xi’an 710055, China;2. School of Metallurgy and Environment, Central South University, Changsha 410083, China;3. Qinghai Western Hydropower Company Limited, Haidong 810800, China)
The influences of K3AlF6, LiF and AlF3contents on Al2O3solubility were investigated by rotating conindum tablet. The influencing mechanism of melt composition, temperature and superheat on Al2O3solubility were also discussed. The results show that Al2O3solubility is affected by K3AlF6, LiF and AlF3through altering melt composition. Adding K3AlF6contributes to increase the Al2O3solubility, while LiF and AlF3have negative effects on Al2O3solubility. Under the same melt temperature, the effect of K3AlF6content is a little greater than that when superheat keeps identical, and with the increase of K3AlF6, the growing rate of Al2O3solubility are 0.46% and 0.16%, respectively. The increase of LiF reduces the Al2O3solubility evidently and the largest drop reaches 21.64%. When the temperature keeps identical, the effect of AlF3content on Al2O3solubility is minor. But when superheat keeps identical, the effect of AlF3content is obvious, the largest drop reaches 8.20%.
aluminum electrolysis; potassium cryolite; electrolyte; solubility; aluminum oxide
Project(51574191) supported by the National Natural Science Foundation of China
2017-11-29;
2018-01-28
LAI Yan-qing; Tel: +86-731-88876454; E-mail: laiyanqing@csu.edu.cn
10.19476/j.ysxb.1004.0609.2018.03.22
国家自然科学基金资助项目(51574191)
2017-11-29;
2018-01-28
赖延清,教授,博士;电话:0731-88876454;E-mail:laiyanqing@csu.edu.cn
1004-0609(2018)-03-0618-10
TF821
A

