ICP-MS法和HPLC-HG-AFS法测定婴幼儿配方奶粉中硒质量浓度不确定度的比较
郭金喜,王霞,孙蕾
(新疆维吾尔自治区产品质量监督检验研究院,国家农副产品质量监督检验中心,乌鲁木齐830011)
0 引言
硒是人体必需微量元素之一[1-5],乳粉是婴儿的主要食物,婴儿食用硒含量低的乳粉可能会引起硒缺乏,对婴儿健康有重大影响,特别是对体质量较轻的新生儿,危害会更大[6]。近年来,一些婴幼儿配方奶粉中有强化添加硒的倾向。ICP-M S法和HPLC-HGAFS法具有技术灵敏度高,检出限低等优点,但其原理和灵敏度各不相同,定量限和一定浓度范围内的准确度也存在较大差异[7-10]。本实验尝试在方法学中引入不确定度,对ICP-M S法和HPLC-HG-AFS法测定婴幼儿配方粉中硒含量的不确定度进行分析,比较直观的分析2种检测方法在该情况下所出具检测报告的准确度,以期为检验人员根据实验室条件合理的选择具体的检测方法[11-13]。
1 实验
1.1 材料及试剂
婴幼儿配方奶粉购买国产某品牌婴幼儿配方奶粉及若干批次。
硒标准物质:100m g/L(GBW0 866)(1%盐酸溶液介质);硝酸(优级纯);磷酸二氢铵(优级纯);硼氢化钾(纯度大于等于95%);铁氰化钾(优级纯);公司甲醇(色谱纯);实验用水为超纯水(18.2MΩ/cm);调谐液(7Li,89Y,140Ce,205T l,59Co)为 10μg/L;0.5%KOH+2%KBH4-0.1%K I现配现用。
1.2 仪器与设备
iCAPQ ICP-M S仪;Mars6微波消解仪;HPLCAFS9800高效液相色谱—双道原子荧光分光光度计(配有砷-汞空心阴极灯);M A235F型pH计:比郎超声波清洗仪;Milli–Q Element纯水器;梅特勒-托利多AL204型电子天平;Dionex IonPac AS10阴离子交换柱(250 mm×4 mm i.d,5μm);实验用所有玻璃和聚四氟乙烯器皿均以20%(体积分数)的硝酸浸泡24 h,用去离子水冲洗干净。
实验中所涉及到的仪器配件均为原厂原装,使用的气体均满足实验要求。
1.3 方法
1.3.1 样品前处理
婴幼儿配方奶粉基体复杂,富含蛋白质和油脂,比常规样品难消化彻底,在不影响检测准确度及精密度的情况下,尽量减少样品称样量。准确称取约0.5(精确至0.0001 g)样品于聚四氟乙烯消解罐中,加入硝酸5.0 m L,双氧水1.0 m L,振摇混合均匀,放置2 h,于电热板上180℃预消化约2 h,冷却后补加3 m L硝酸,然后密封好消化管,放入微波消解器,微波消解程序如表1所示。

表1 微波消解程序
消解完毕后,放入石墨消解仪以120℃继续加热至至剩0.5~1.0m L,不可蒸干。冷却后,用去离子水少量多次洗涤定容至10 m L容量瓶摇匀备用。同时做空白实验。
1.3.2 标准系列的配制
标准中间液:准确移取硒单元素溶液标准物质1.00 m L,用体积分数0.5%硝酸(以浓硝酸为基准)稀释并定容至100.0m L容量瓶,质量浓度为10.0μg/m L。
标准工作液:先用体积分数0.5%硝酸将标准中间液稀释成1.00μg/m L,再稀释成质量浓度分别为0.00,10.00,20.00,30.00,40.00,50.00 ng/m L的标准工作液,供ICP-M S法和HPLC-HG-AFS法使用[14]。
1.3.3 ICP-M S工作条件
按照ICP-M S仪器操作手册,调整仪器至最佳工作状态,使用调谐液对仪器进行优化,优化后仪器性能和测定条件,待仪器稳定后。按照表2操作条件,分别测定1.3.1节处理的空白溶液、样品溶液和1.3.2节配制的标准溶液中硒的含量。
实际测定结果证明在不使用内标和反应气的条件下,单用矫正公式来测定以上两个元素结果不理想,故需要进行反应气优化和内标的校正。在此条件选取仪器推荐的78Se和作为测定对象,同位素修正方程采用EPA20018标准干扰方程,82Se:-1.008696*83K r。
1.3.4 HPLC-HG-AFS工作条件

表2 ICP-MS仪操作条件
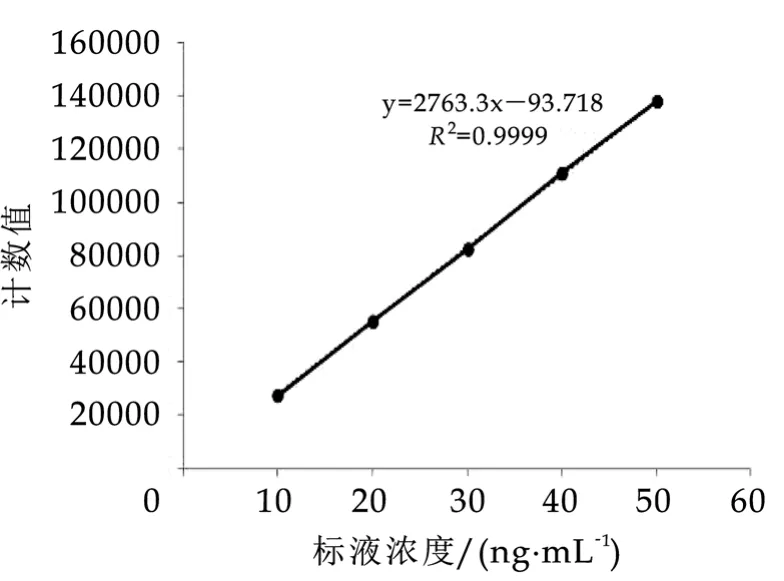
图1 ICP-MS硒标准系列工作曲线
HPLC-HG-AFS联用仪由HPLC、形态分析预处理装置和AFS-9130原子荧光光谱仪3部分组。本研究选用D ionex IonPac AS 10阴离子交换柱(250 mm×4 mm id,5μm)进行了硒的分离条件优化,在离子交换色谱分离中,广泛使用磷酸氢二胺作为流动相。本文考察了不同浓度和pH值条件下磷酸盐缓冲液对50 ng/m L硒标准溶液的分离情况。HPLC-HG-AFS优化后的工作参数如表3所示。
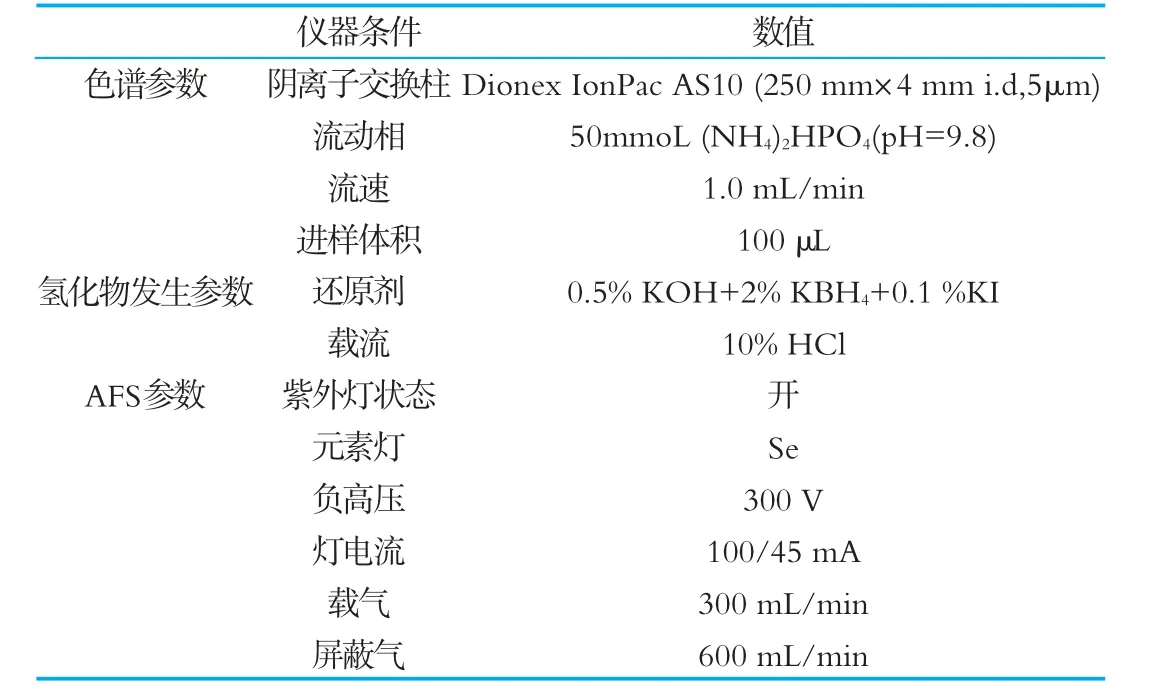
表3 HPLC-HG-AFS工作参数

图2 硒的4种形态等度分离图谱

图3 HPLC-HG-AFS硒标准系列工作曲线
2 结果与分析
2.1 数学模型
不确定度的计算,首先要明确被测值计算的数学模型,从而分析其可能的不确定来源。只有当影响被测值不确定度的基本因素都被考虑在内,所得到的各自的相对不确定度值才可以在整个计算中被采纳[15-17]。本实验中婴幼儿配方奶粉中硒质量浓度计算数学模型为

式中:X试样中硒质量浓度(μg/m L);C试样消化液测定质量浓度(ng/m L);C0为试样空白消化液测定质量浓度(ng/m L);m为试样质量(g);V试样消化液总体积(m L)。
从数学模型看出,各影响参数相互独立,各自的不确定度直接影响被测值X的不确定度。利用相对标准不确定度合成合成标准不确定度,参考JJF 1059-1999可知,合成标准不确定度:

2.2 不确定度分量的主要来源及其分析
根据测定的具体操作过程和数学模型分析,婴幼儿配方奶粉中硒测定的不确定度分量主要来源于以下几个方面[18-20]:样品前处理过程引入的不确定度、测试过程的随机效应(测量重复性)、标准曲线拟合、定标准溶液、容体积、称样质量、测量仪器、试样的均匀性(由于试样是非常细的固体粉末,其均匀性很好,所以试样均匀性引起的不确定度可以忽略)。详见表4。

表4 不确定度来源及类型
2.3 不确定度分量的计算
2.3.1 样品前处理过程引入的不确定度
样品前处理过程较多,每一步操作都会引入误差,要逐步分析其对总不确定度的贡献是相当困难的,可通过加标回收统一评定不确定度。即用回收率平均值的标准偏差评估样品前处理过程引入的标准不确定度,同时根据t检验判断平均回收率是否与1.0有显著性差异若12.71[21],则与1没有显著性差异,此时直接用回收率平均值的标准偏差表示回收率的标准不确定度,否则,乘以回收率校正因子修正计算结果[22]。本实验回收率数据及不确定度评估结果见表5。
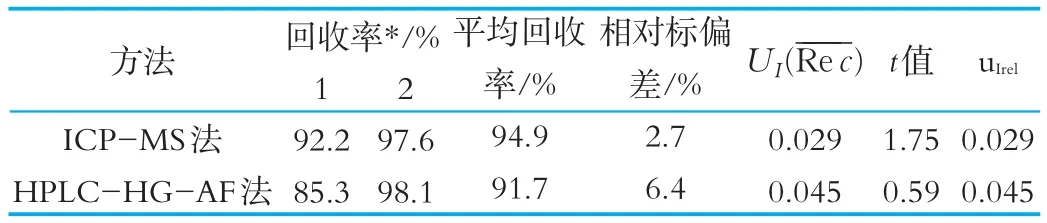
表5 回收率引入的不确定度评估结果
2.3.2 测试过程的随机效应(测量重复性)
随机效应产生于影响量的不可预测的变化。随机效应不确定度主要来自几个方面,即样品代表性、进样的重复性、样品均匀性、体积刻度充满的重复性和仪器测量的重复性等。样品测试过程中,随机效应所导致的不确定度可以通过样品的重复测定进行评定,属于A类评定。实验中对随机抽取的样品进行3次平行测定,对随机效应引入的不确定度进行评定。3次测量的随机效应导致的不确定度根据下式计算:


表6 重复测定测量结果(n=3) mg/kg
2.3.3 标准曲线拟合所引入的拟合不确定度
ICP-M S法和HPLC-HG-AFS法标准溶液的响应值以及采用最小二乘法拟合得到标准曲线的线性回归方程f(x)=a+bx,方程的线性相关系数R2、残余标准误差s和标准不确定度为;ICP-M S法线性回 归 方 程 为 :a=276.33、b=93.718R2=0.9999、S=4718.4、UⅢrel=0.028;HPLC-HG-AFS法线性回归方程为:a=0.8668、b=28.339、R2=0.9998、S=22.25、UⅢrel=0.030。硒标准溶液测量结果如表果7所示。
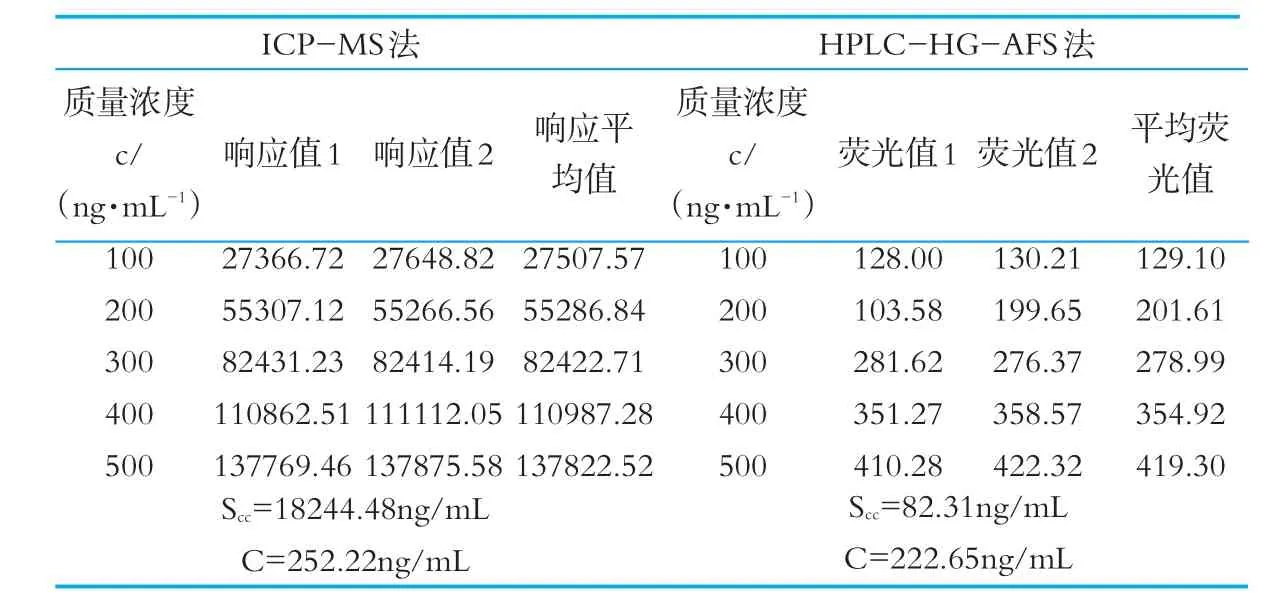
表7 5个不同质量浓度的硒标准溶液测量结果
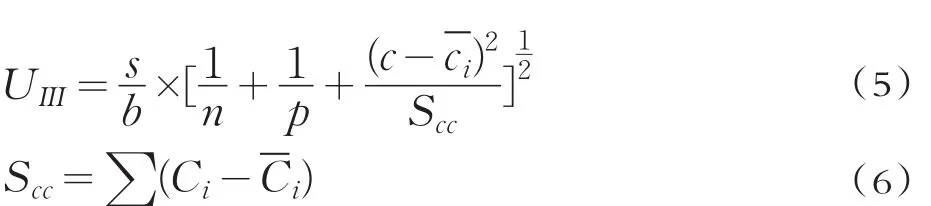
式中:n为标准溶液测定总次数,本研究中n=10;p为测试样品的测量次数,p=3;s为残余标准差(ng/m L);b为拟合曲线截距;c为被测样品溶液的质量浓度估计值,用被测样品溶液质量浓度的平均值表示(ng/m L);为绘制标准曲线的全部ci值的平均值ci(ng/m L);Scc为标准溶液质量浓度残差之和(ng/m L)[25]。
2.3.4 标准溶液引入的不确定度
标准溶液引入的不确定度主要由标准溶液稀释所引入,包括所购买标准物质的不确定度、移液管和容量瓶的不确定度。
2.3.4.1 硒标准物质的相对标准不确定度
根据硒标准物质证书可知其标准不确定度为1μg/m L、k=2,则up=1/2=0.5μg/m L,相对标准不确定度uprel=0.5/100=0.005。
2.3.4.2 标准工作溶液配制过程中玻璃量具校准产生的不确定度评定
配制标准品溶液时,首先用50 m L单标线容量瓶配制标准贮备液,然后分别单标线移液管移取1,2,5 m L标准贮备液至100 m L单标线容量瓶中,定容后作为标准工作液。整个过程用到了1,2,5m L单标线移液管和100 m L单标线容量瓶。按照JJG 196-2006《常用玻璃量具检定规程》的要求[26],A级1,2,5 m L单标线移液管的最大允差分别为±0.007,±0.010,±0.015;A级50 m L和100 m L单标线容量瓶的最大允差为±0.05 m L±0.10 m L,按照矩形分布考虑,k=3,由此计算不确定度如表8所示。

表8 玻璃量具校准的不确定度
由于2种方法所用的标准溶液,其稀释过程一致。因此2种方法中,标准溶液引入的不确定度也一样。根据表5,合成相对标准不确定度为

2.3.5 定容体积引入的不确定度
2.3.5.1 定容体积的不确定度
ICP-M S法中和HPLC-HG-AFS法,将消解好的样品溶液,用去离子水反复多次冲洗定容至10.0 m L,容量瓶允差为±0.02 m L,按矩形分布k=31/2计算,其不确定度为:

2.3.5.2 定容温度的不确定度
温度变大引起的液体膨胀明显大于容量瓶的体积膨胀,因此,只考虑温度变大即可。已知水的体积膨胀系数为2.1×10-4℃-1,容量瓶是在20℃温度校准时为10.00m L,当标准配制室温度在(20℃±5℃)时引起的不确定度为
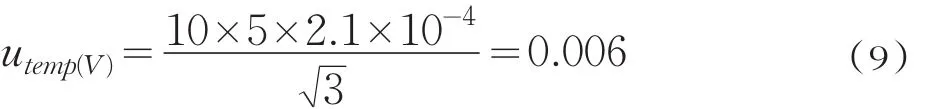
定容至10m L容量瓶引入的合成相对不确定度为

2.3.6 称样质量引入的不确定度
所使用的天平经检定为Ⅰ级合格,依据检定证书和JJG 1036—2008《电子天平检定规程》[27],天平校准允许的最大误差为±0.0001g,称取婴幼儿配方奶粉0.5 g,按矩形分布k=31/2,2次称量后获得样品质量(天平清零也带来称量的不确定度),计算引入的相对标准不确定度为:UⅥ=0.0001×21/2/31/2=0.000082 g,实验称取约0.5 g样品,则UⅥ=0.00016。
2.3.7 测量仪器引入的不确定度
根据仪器检定证书,硒质量浓度为50 ng/m L时,ICP-M S仪器的不确定度为 0.6 ng/m L(k=2),即ICP-M S仪器的相对标准不确定度 UⅦ(I)=0.006;硒质量浓度在50 ng/m L范围内时,HPLC-HG-AFS仪器的不确定度为2%(k=2),即HPLC-HG-AFS仪器的相对标准不确定度UⅦ(H)=0.01。
2.4 合成标准不确定度uc扩展不确定度U的计算
由表9可以看出,通过对2种方法不确定度分量的分析与比较得知对不确定分量影响顺序是是测定过程的样品前处理、测试随机效应、标准曲线拟合和测量仪器等,而定容体积、标准溶液、样品称量引入的相对标准不确定度度非常小可以忽略不计。由结果可知各不确定度来源的不确定度数值都是HPLC-HG-AFS法大于ICP-M S法。本次实验所用婴幼儿配方粉中硒的添加量为0.21 m g/kg,所以两种方法不确定度对检测结果都不会造成影响。
3 结论
本文讨论了应用电感耦合等离子体质谱法和高效液相色谱-氢化物-原子荧光光谱法(HPLC-HG-AFS)测定婴幼儿配方奶粉中硒含量不确定度的比较。通过实验结果比较得出以下结论:(1)测定婴幼儿配方奶粉中的硒含量时,影响测量结果的主要不确定度来源为:样品前处理、测试过程的随机效应、标准曲线拟合和测量仪器,而定容体积与样品称量引入的相对标准不确定度较小可以忽略。因此,在今后的检测过程中,应加强对这几个方面的质量控制,以保障检测结果的准确性;(2)同时,从2种方法的不确定度评估过程和结果来看,HPLC-HG-AFS法的不确定度数值都大于ICP-M S法,因此,在条件允许的情况下,应根据精度要求,选用合适的仪器进行检测,如出现不符合标准的样品,建议采用ICP-M S法进行复核。
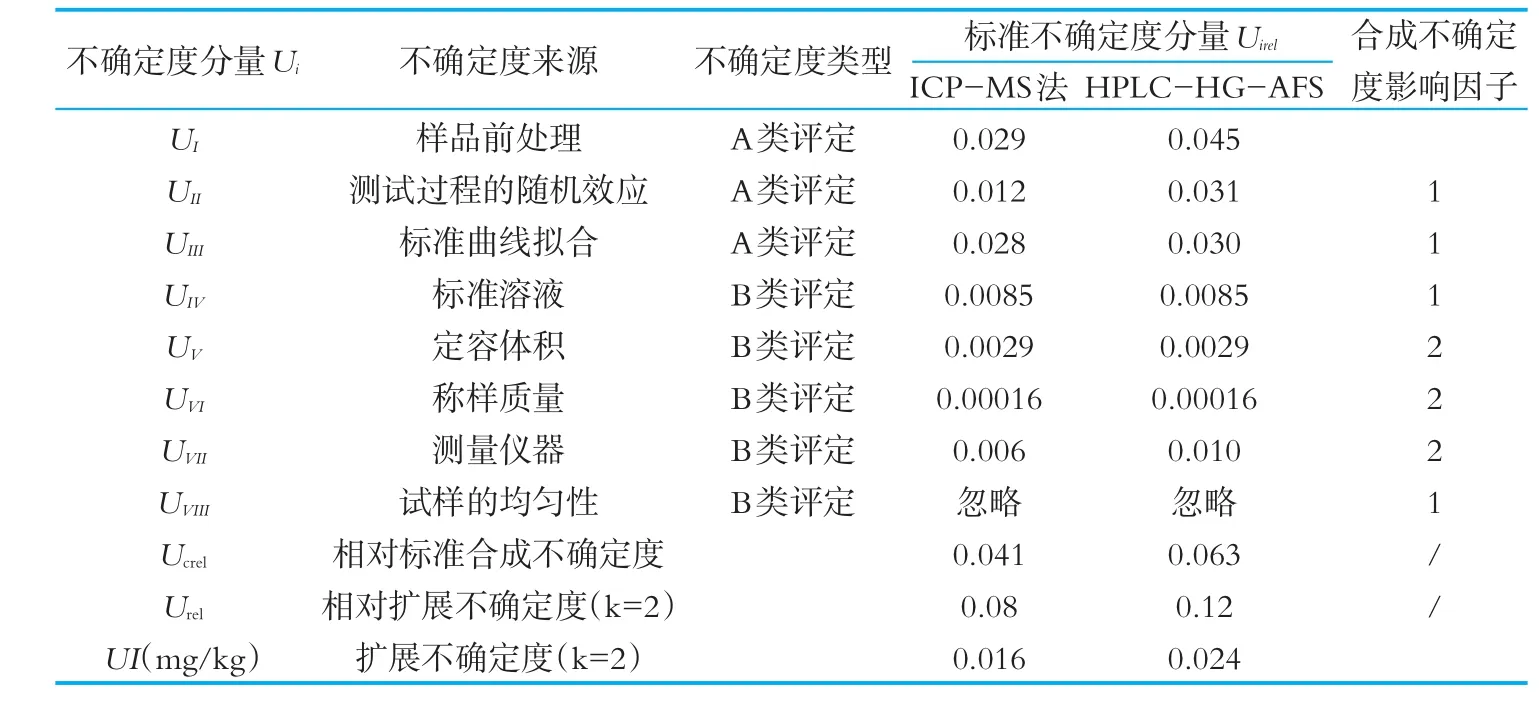
表9 影响婴幼儿配方奶粉中硒测定结果的不确定度分量
参考文献:
[1]刘秀华,辉永庆,张豫川,等.石墨炉原子吸收光谱法测定硒的条件研究[J].理化检验-化学分册,2006,42(2):133-134.
[2]邓世林,李新凤,郭小林.流动注射氢化物发生原子吸收光谱法测定禽蛋中的硒[J].光谱学与光谱分析,2010,30(03):809-811.
[3]吴庆晖,黄伯熹,冉文清,等.超声波水漏助消解-原子荧光光谱法测定食菌中硒含量[J].食品科学志,2013,34(10):215-218.
[4]于振花,荆淼,黄彦良,等.微波消解-电感耦合等离子体质谱测定食品中硒的含量[J].食品研究与开发,2009,30(10):100-103.
[5]袁媛,刘丽萍.电感耦合等离子体质谱法直接测定乳粉中的硒[J].中国卫生志,2014,24(13):1876-1878.
[6]GB 10765—2010婴儿配方食品[S].
[7]汪波,辛跃珍.高压消解-原子荧光光谱法测定牛初乳中硒的研究[J].生命科学器,2012,10(6):38-41.
[8]苟体忠,唐文华,张文华,等.氢化物发生-原子荧光光谱法测定植物样品中的硒[J].光谱学与光谱分析,2012,32(5):1401-1404.
[9]吴庆晖,黄伯熹,冉文清,等.超声波水浴辅助消解-原子荧光光谱法测定食用菌中硒含量[J].食品科学,2013,34(10):215-218.
[10]邓旭坤,李游,蔡俭,等.紫外分光光度法测定竹节参中微量元素硒的含量[J].中南民族大学学报(自然科学版),2013,32(2):66-68.
[11]国家质量监督检验检疫总局.JJF 1059.1—2012测量不确定度评定与表示[S].北京:中国质检出版社,2012.
[12]中国合格评定国家认可委员会.CNAS-GL06:2006化学分析中不确定度的评估指南[S].北京:中国计量出版社,2006.
[13]国家质量技术监督局计量司.测量不确定度评定与表示指南[S].北京:中国计量出版社,2000.
[14]中华人民共和国卫生部.GB 5009.93-2010食品安全国家标准食品中硒的测定[S].北京:中国质检出版社,2012:8-9
[15]全国认证认可标准化技术委员会.实验室质量控制规范食品理化检测:GB/T 27404-2008[S].北京:中国标准出版社,2008.
[16]王旭,龚媛,张同刚,等.基于主成分分析法羊肉火腿香气质量评价模型的构建[J].食品工业科技,2015,21:122-127.
[17]于洋,徐春祥,车文军.高效液相色谱法测定奶粉中的三聚氰胺及其不确定度分析[J].食品科学,2010,31(4):250-253.
[18]韩兴林,潘学森,刘民万,等.云门酱香型白酒风味特征的分析研究[J].酿酒科技,2014(10):6-8.
[19]SABER-TEHRANIM,HASHEM I-MOGHADDAM H,HADI-GIVIANRAD M,et al.Methyl mercury deter-minationin biological samples using electro thermal atomic absorption spectrometry after acid leaching extr-action[J].Anal Bioanal Chem,2006,386(5):1407-1412.
[20]Rayman PR.The importance of selenium to human health[J].Lancet,2000,356(9):233-241.
[21]张雪波,肖世青,杜先锋,等.基于主成分分析法的安溪铁观音香气质量评价模型的构建[J].食品科学,2012,33(22):225-230.
[22]TAPIA J,VARGAS-CHACOFF L,BERTRN C,et al.Study of thecontent of cadm ium,chromium and lead in bivalve molluscs of the Pacific Ocean(M aule Region,Chile)[J].Food Chemistry,2010,121(3):666-671.DOI:10.1016/j.foodchem.2009.12.091.
[23]张素娟.气相色谱法测定白酒中乙酸乙酯含量的不确定度分析[J].食品科学,2010,31(2):151-153.
[24]TAYLOR B N,KUYATT C E.Giudelines for evaluating and experssing the uncertainty of NIS Tmeasurement results(1994 Edition)[R/OL].(2000-05-05)[2016-02-29].http://elektron.pol.lublin.pl/elekp/ap_notes/N IST_tn1297.pdf.
[25]Jones F T.A Broad View of Arsenic[J].Poultry Science,2007,86:2-14.
[26]国家质量监督检验检疫总局.JJG 196-2006常用玻璃量器检定规程[S].北京:中国计量出版社,2006.
[27]国家质量监督检验检疫总局.JJG 1036-2008电子天平检定规程[S].北京:中国计量出版社,2008.

