卵巢甲状腺肿的MRI和超声表现及病理对照分析
程美英,赵 鑫,张小安,赵俊锋,鲁海燕,曹 静
(郑州大学第三附属医院,河南 郑州 450052)
卵巢甲状腺肿(Struma ovarii,SO)是一种少见的来源于卵巢细胞的高分化单胚层肿瘤,为成熟型畸胎瘤的一种特殊类型,约占成熟型畸胎瘤的2.7%[1]。SO完全或大部分(>50%)由甲状腺组织构成,或者甲状腺组织虽未超过50%但伴明显甲亢症状,或在成熟型畸胎瘤的标本中发现肉眼可见的甲状腺组织[2-3],即可诊断为SO。大多数SO为良性病变,由于多数SO囊、实性成分混杂[1],术前诊断有一定困难,且国内文献报道较少,对该病的影像表现认识不足。笔者回顾性分析9例SO患者的临床、影像及病理资料,对其MRI和超声特点及手术病理进行对照分析,以提高对该病的认识,帮助临床制定合理的诊疗方案,尤其对于有生育要求的女性,可避免不必要的卵巢切术手术。
1 资料与方法
1.1 临床资料
搜集郑州大学第三附属医院2015年9月—2017年9月经手术及病理证实的SO病例9例,发病年龄22~57岁,平均43.9岁。临床症状:下腹部无痛性肿块2例,无明显诱因阴道不规则流黄色液体1例,发现腹部逐渐增大1例,因其他妇科病检查意外发现2例,体检发现3例。全部病例术前均行甲状腺彩超检查,甲状腺大小正常;CA125、CA153、CA199、AFP及CEA检查,结果正常。甲状腺功能检查,包括游离 T3(FT3),游离 T4(FT4),三碘甲腺原氨酸(TT3),总甲状腺素(TT4),促甲状腺素(TSH),其中 1 例 TSH 8.09 mIu/L(0.35~6.5 mIu/L)轻度增高,余均无异常。全部病例术前均行3.0T MRI平扫、增强扫描及超声检查。
1.2 MRI检查
所有患者扫描采用Siemens公司生产的SYNGOVIA 3.0T MRI扫描机,采用TORSPA 线圈。扫描序列:平扫包括FSE T1WI(轴位),压脂FRFSE T2WI(轴位、冠状位),FRFSE T2WI(矢状位)。
扫描参数:轴位 T1WI序列:TR 560ms,TE 13ms。轴位 T2WI序列:TR 4 100 ms,TE 105.7 ms,二者均为:FOV 300mm×300mm,矩阵 512×512,层厚 4.0mm,层间隔4.8 mm,NEX 1次。 矢状位T2WI序列:TR=4 650 ms,TE 87 ms,FOV 240 mm×240 mm, 矩阵512×512,层厚 3.5 mm,层间隔 4.2 mm,NEX 1 次。DWI扫描采用横轴位扫描,TR 4 600 ms,TE 51 ms,FOV 380 mm×380 mm,矩阵 512×512,b=800 s/mm2,层厚 4.0 mm,层间隔 4.8 mm,NEX 1 次。
增强扫描采用FSE T1WI序列行轴位、矢状位、冠状位扫描,其中轴位扫描参数为:TR 3.31 ms,TE 1.30 ms, FOV 360 mm×360 mm, 矩阵 512×512,层厚 5.0 mm,层间隔 1.0 mm,NEX 1 次;使用对比剂为Gd-DTPA,肘前静脉注射,速率为2 mL/s,用量0.1 mmol/kg。阅片由两名中级职称以上放射诊断医师共同完成,以意见达成一致为准。
1.3 超声检查
采用GE Voluson E8彩色多普勒超声诊断仪,经腹探头型号RIC5-9-D。检查病变位置、边界、大小、回声特点及血流情况。由两名中级职称以上超声医师共同诊断,意见达成一致。
1.4 手术、病理检查
本组病例全部腹腔镜下手术,其中3例行囊肿剥离手术,余6例应病人及家属意愿均行附件及肿物切除术。病理切除肿瘤组织处理后常规石蜡包埋、切片,行HE染色,并由两名中级以上病理诊断医师行镜下观察,意见达成一致。
2 结果
2.1 MRI表现
9例SO患者均表现为单侧附件区肿块,右侧7例,左侧2例,肿瘤呈不规则形多囊样改变,边缘外凸,最大截面范围 3.6~7.6 cm,肿块边界清晰,与子宫、膀胱等邻近组织分界清楚,2例见少量盆腔积液;9例SO中3例为纯囊性,6例为囊实性,实性部分散在分布于囊腔之间,其中5例见结节样改变。
MRI平扫表现信号混杂,9例T1WI均见低信号,7例见高信号(脂肪信号),9例T2WI均出现高信号,7例出现极低信号影。
DWI扫描,9例肿瘤均可见低信号,3例囊性部分见稍高信号及高信号,按其T2WI信号不同测量ADC值,其中高信号区、稍低信号区及极低信号区ADC 值平均值为别为 (2.576±0.130)×10-3mm2/s、(1.641±0.349)×10-3mm2/s、(0.763±0.373)×10-3mm2/s;MRI增强扫描后肿物囊性部分无明确强化,实性部分及囊壁、囊内分隔呈明显强化。
2.2 超声表现
9例均表现为边界清晰混合性包块,内可及数个囊腔,囊腔透声差,4例可见稠厚细密光点,5例见点状高回声。CDFI:9例囊壁可及血流信号;6例囊实性肿物内见数个实性高回声,其中高回声可及较丰富血流。
2.3 病理表现
肿物大体观察呈灰白色,表面光滑,包膜完整,肿瘤切面呈囊实性、多房样改变,囊壁厚薄不均,内含胶冻样物或淡黄色液体。显微镜下观察:9例SO中6例见成熟的甲状腺滤泡,大小不等,内衬单层立方或柱状甲状腺滤泡上皮,腔内含有多少不等均质粉染的甲状腺胶质,1例伴含铁血黄素沉积,2例以甲状腺肿形成为主,1例伴小灶性甲状腺腺瘤形成。
3 讨论
3.1 SO 的临床表现
SO是一种罕见的起源于卵巢的高度分化单胚层畸胎瘤,占所有卵巢肿瘤的 0.3%~1.0%[3-4]。 SO 的诊断标准[3-5]为符合以下四点之一即可诊断:①肿瘤完全由甲状腺组织构成 (单纯甲状腺肿);②肿瘤50%以上由甲状腺组织构成;③肿瘤中甲状腺组织所占比例虽然小于50%但伴明显的非颈部甲状腺肿所致的甲亢;④肿瘤中有肉眼可见甲状腺组织。本组全部病例符合诊断标准。SO患者多无特异性临床症状或无症状体检发现,若肿瘤内甲状腺组织具有功能性,则可表现为甲亢症状。文献报道[6]约5%的卵巢甲状腺肿因有吸收碘的功能,分泌甲状腺素并出现甲亢及颈部甲状腺增生,因此临床工作中对于因甲亢症状而就诊的女性患者,要排除SO的可能性。本组9例SO患者临床表现为下腹部无痛性肿块2例,无明显诱因阴道不规则流黄色液体1例,发现腹部逐渐增大1例,因其他妇科病检查意外发现2例,体检发现3例,所有病例临床均未发现伴发甲亢症状,可能与肿瘤内甲状腺组织无摄碘功能或病例数目较少有关。据文献报道,SO发病年龄约为20~60岁[7]。在本次研究中,9例患者的年龄范围22~57岁,与文献报道的发病年龄相符。少数(约17%)SO病例恶变,临床合并腹水及CA125升高[8],本组病例所有 CA125、CA153、CA199、AFP 及 CEA 检查结果均显示正常,甲状腺功能检查仅1例TSH轻度升高,余结果显示正常,推测可能因为本组病例均为良性SO,未发生恶变有关。
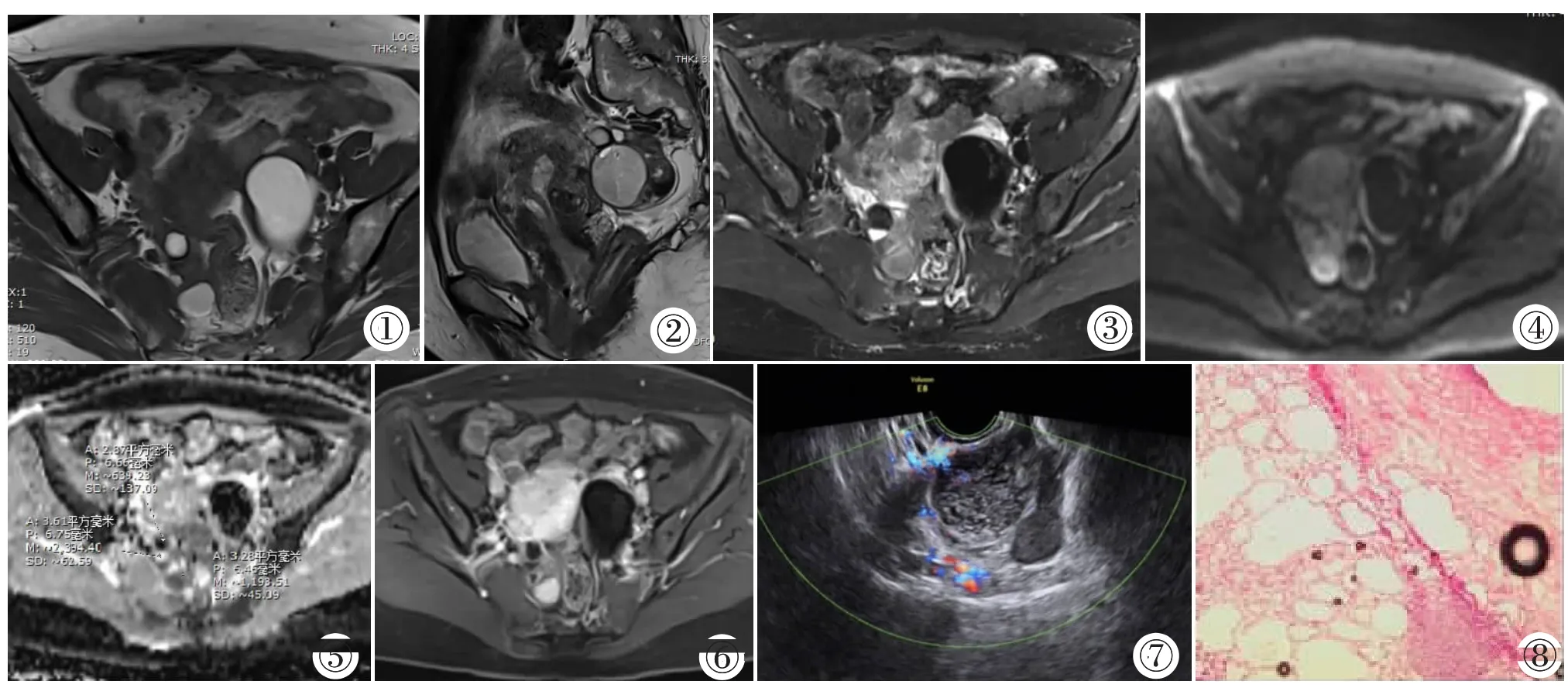
图1~8 女,48岁,右侧SO。图1:轴位T1WI,右侧卵巢囊实性肿块,边界清晰,多个分隔,可见高信号、低信号影。图2:矢状位T2WI,可见高信号及极低信号影。图3:压脂轴位T2WI,脂肪信号抑制。图4,5:DWI显示肿块信号混杂,原T2WI高信号区、稍低信号区及极低信号区ADC值分别为(2.394±0.062)×10-3mm2/s、(1.193±0.045)×10-3mm2/s、(0.639±0.173)×10-3mm2/s。 图6:增强轴位 T1WI,显示肿物囊性部分无强化,囊壁及囊内分隔明显强化。图7:彩超示右附件区混合性包块,可及多个大小不等的无回声,部分透声差,内可见多个点状高回声。图8:镜下观察(HE染色),可见大量成熟甲状腺滤泡及滤泡上皮。Figure 1~8. Female,48 years old,SO of right ovary.Figure 1:The axial T1WI shows a well-defined cystic-solid mass on the right ovary with multiple separations,high signal and low signal.Figure 2:The sagittal T2WI shows high signal and extremely low signal in the lesion.Figure 3:The axial fat-suppression T2WI shows that the fat signal is suppressed.Figure 4,5:DWI shows mixed signals in the mass,the ADC values of high signal region,low signal region and extremely low signal region of the original T2WI are respectively (2.394±0.062)×10-3mm2/s,(1.193±0.045)×10-3mm2/s,(0.639±0.173)×10-3mm2/s.Figure 6:Aaxial contrast-enhanced T1WI shows the cystic part of the mass is not enhanced,and the walls of the cyst and the separations are significantly enhanced.Figure 7:Color Doppler ultrasound shows mixed mass with multiple unechoes of different sizes and partial poor acoustic transmission,multiple punctate hyperechoic echoes are found.Figure 8:Observation under microscope(HE staining),a large number of mature thyroid follicular and follicular epithelium are found.
3.2 SO 的 MRI表现
SO的MRI表现较复杂,多囊且囊内信号可不均匀,表现为T1WI低信号,若囊内含有成熟脂肪成分,则呈明显高信号;T2WI表现为高信号和/或极低信号,取决于SO囊内容物蛋白质含量的不同,随着囊内液体黏度的增加,其MRI表现T2WI信号逐步降低,若囊内为胶冻样物质时,T2WI则可呈极低信号,是SO的特征性MRI表现[9]。本组9例T1WI均见低信号,其中7例见高信号,为成熟脂肪成分;本组7 例(77.8%)出现 T2WI极低信号影;压脂序列,成熟脂肪信号明显抑制,呈低信号。
DWI扫描可反应活体组织内水分子扩散运动的情况,弥散敏感系数b是影响DWI图像信号强度最相关的因素,二者呈负相关,除此之外,DWI信号强度还受T2WI信号强度影响,二者呈正比关系,且当b值越小时,T2WI信号对DWI信号影响越大,此为“T2穿透效应”,高 b 值(b=800~1000 s/mm2)能减少该效应,推荐应用于盆腔病变检查[10]。文献报道,蛋白的含量是影响DWI信号强度主要因素[11],且蛋白含量与ADC呈负相关[12],本组选择b=800 s/mm2,根据其T2WI像信号不同高信号、稍低信号及极低信号区测得 ADC 值平均值分别为(2.576±0.130)×10-3mm2/s、(1.641±0.349)×10-3mm2/s、(0.763±0.373)×10-3mm2/s,即高信号区<稍低信号区<极低信号区,推测这与肿瘤囊内的成分有关,当囊内蛋白含量较少,黏度较小的时候,DWI可表现为弥散不受限,随着蛋白含量及囊内黏度的增加,弥散逐渐受限,ADC值下降,与文献报道一致。本组病例囊性部分无明确强化,而囊壁、囊内分隔显示明显强化,与文献[9]相符,这与肿物囊壁及囊内分隔的血供丰富程度有关。
3.3 SO 的超声表现
SO患者的超声表现多种多样,多表现为来源于一侧的多房囊实性肿块,其中实性结节部分均出现较丰富的血流信号,这与甲状腺组织富血供有关[13]。本组9例均表现为边界清晰的混合性包块,内可及数个囊腔,部分囊腔透声差,4例可见稠厚细密光点,5例见点状高回声。CDFI:9例囊壁均可见血流信号;6例囊实性肿物内见数个实性高回声,其中高回声可及较丰富血流。与文献报道[13]一致。
3.4 SO 的病理特点
SO多单侧发生,本组9例均为单侧,右侧多见(77.8%),大体观察,肿瘤呈灰白色,大小不一,本组病例大小 3.6~7.6 cm,表面光滑,包膜完整,切面均为多房样或多囊状囊实性肿物,囊壁厚薄不均,囊内为淡黄色或胶冻样液体。SO的镜下[2]改变由正常或增生性甲状腺组织组成,可见甲状腺滤泡、结节性甲状腺肿及甲状腺腺瘤等病理改变。本组9例SO中6例见成熟的甲状腺滤泡,大小不等,内衬单层立方或柱状上皮,腔内含有多少不等均质粉染的甲状腺胶质,1例伴含铁血黄素沉积,2例以甲状腺肿形成为主,1例伴小灶性甲状腺腺瘤形成。本次搜集的9例SO中并没有发现恶性及转移病例。
综上所述,SO属于少见病,临床表现无特异性,术前很难与卵巢来源的其他肿块相鉴别,MRI联合超声与病理特点对照,发现其磁共振及超声表现具有相对特征性。对于育龄期女性,单侧卵巢来源的边界清晰的囊实性肿块,MRI联合超声检查特点,则应考虑SO的可能性。

