单能量去金属伪影技术在脑动脉瘤术后中的应用价值
冉彦永,潘宇宁,陈兆乾,黄求理
(1.宁波爱伊美医院放射科,浙江 宁波 315500;2.宁波市第一医院影像科,浙江 宁波 315010)
颅内动脉瘤是颅内动脉壁的囊性膨出,一旦出血,死亡率较高。随着神经外科技术的发展,动脉瘤栓塞和夹闭手术已经成为脑动脉瘤的主要治疗手段,但术后需要定期随访来观察疗效及金属植入物周围的情况[1-2],CTA是目前主要的术后随访手段。但颅内金属植入物周围由于线束硬化和光子饥饿产生的条带状伪影的存在,使术后并发症和动脉瘤再发的检出变得困难,从而造成误诊和漏诊。因此,如何减少或去除金属植入物周围的伪影,具有重要的临床意义。近几年来,随着技术的发展,能谱CT和各种去伪影后处理技术的应用,使得这个问题得到了一定程度的解决[3-4],但其去除金属伪影的效果未达到令人满意的结果。
单能量去金属伪影技术 (Single energy metal artifact reduction,SEMAR)是一种新近出现的CT去金属伪影的方法。目前对于SEMAR的评价都集中在较大金属植入物的伪影,比如髋关节、脊柱及牙齿金属植入物等[5-7],对于颅内较小的金属植入物伪影的评价未见报道。此外,脑CT灌注在动脉瘤治疗疗效及预后评价中有着非常重要的价值[8],以往双能CT去金属伪影的研究报道,经过高keV单能量重建后,金属伪影的面积减小,但金属及图像周围结构在同一时间变得模糊[9]。SEMAR算法会不会产生这种“模糊效应”?这种“模糊效应”会不会影响脑CT灌注结果的准确性?因此,本研究同时评价了SEMAR技术对CT图像质量和灌注参数的影响,以探讨其在颅内动脉瘤术后随访中的应用价值。
1 资料与方法
1.1 一般资料
搜集宁波市第一医院2017年1—6月共55例因颅内动脉瘤栓塞或者夹闭术后行320排CTA+灌注检查的患者,其中2例患者行2次检查,故57例患者数据纳入本组研究。55例患者中,男24例,女31 例,年龄 29~87 岁,平均(60.15±15.86)岁。其中动脉瘤夹闭17例,动脉瘤栓塞38例。排除标准包括:孕妇、严重心肾功能不全患者。该项目经医院伦理委员会同意,所有被检者均签署检查知情同意书。
1.2 扫描方法
所有病例在升级后的第二代320层CT(Aquilion ONE,日本Toshiba公司)上完成。采用仰卧位并用头带固定,CT灌注检查使用容积扫描方式,探测器宽度16 cm,球管单圈旋转时间0.5 s,重建层厚0.5 mm,视野(FOV)24 cm。 管电压 80 kV,管电流150 mA。使用双筒高压注射器(Stellant,美国Medrad公司)注射370 mgI/mL非离子型对比剂优维显(拜耳医药保健有限公司广州分公司)60 mL,注射流率为5.0 mL/s,接着以相同速率注射生理盐水20 mL。采用标准19圈容积扫描,共分5个序列,第1序列延迟7 s扫第一圈;第2序列10.7 s开始,扫描3圈,每圈间隔2 s;第3序列17 s开始,扫描6圈,每圈间隔2s;第4序列29.4 s开始,扫描4圈,每圈间隔2 s;第5序列39.1 s开始,扫描5圈,每圈间隔5 s。
1.3 图像后处理
扫描完成后对原始数据采用两种重建方法:No-SEMAR组采用迭代强度为50%的适应性迭代重建技术 (Adaptive iterative reconstruction technique,AIDR 3D)进行重建;SEMAR组采用 AIDR 3D+SEMAR算法重建。所有原始数据传至后处理工作站(Vitrea Fx4.0)进行处理,选取大脑中动脉作为输入动脉,上矢状窦作为输出静脉,由软件自动获得动态时间密度曲线(Time density curve,TDC)及各CT灌注参数图,包括脑血流量 (Cerebral blood flow,CBF)灌注图、脑血容量(Cerebral blood volume,CBV)灌注图、平均通过时间 (Mean transit time,MTT)灌注图。
1.4 图像评价
1.4.1 图像质量主观评价
由2名高年资的神经放射学医生对所获两组图像采用双盲法进行独立评分。按照图像质量受金属伪影的影响程度采用4分法[10]:1分代表伪影很重,图像无法观察;2分为图像伪影较重,图像尚能观察;3分为存在少量伪影,图像质量较好;4分为基本无伪影,图像质量好。
1.4.2 图像质量客观评价
每例患者选取第1组平扫数据中伪影最重的层面进行评价,窗宽设定为100HU,窗位设定为40HU。以金属植入物为中心半径大约为1 cm均匀取5个感兴趣区(Region of interest,ROI),每个 ROI相隔72°(图1),分别测量出5个ROI的 CT值和SD值(Standard deviations,SD)。 同时选取附近无伪影层面相同组织测其CT值和SD值作为参考,测量时同一患者所选层面的测量位置、范围保持一致,面积取80 mm2左右。ROI的勾画尽量避开颅骨和空气,并以其标准差的平均值作为图像噪声。伪影的直径被定义为由硬化束伪影引起的黑暗区的长度,伪影的最大直径在横断位图像上测得,伪影指数(Artifacts index,AI)和对比噪声比(Constrast-to-niose ratio,CNR)的计算由如下公式得到:。
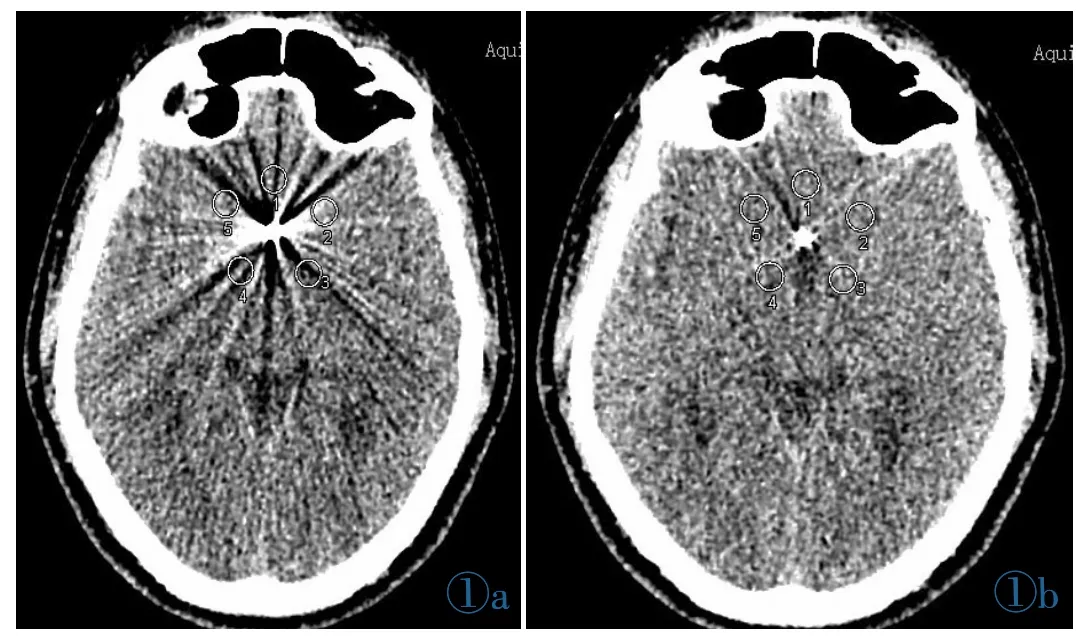
图1 客观图像质量参数在0.5 mm的原始图像上测得。图1a:No-SEMAR 图像;图1b:SEMAR 图像。Figure 1.Objective image parameters are measured on an original image in 0.5 mm slice thickness.Figure 1a: No-SEMAR image;Figure 1b:SEMAR image.
1.4.2 图像CT灌注参数的评价
基底节区层面,取左侧额叶灰质及白质、颞叶灰质及白质、基底节区所在的5个ROI,以脑中线为中线,右侧对称放置ROI,使两侧共10个ROI面积尽量保持一致,ROI面积取10 mm2,尽量避开血管、病变区及金属伪影区,两组图像测量位置尽量保持一致,测量代表全脑的CT灌注参数值,即CBF、CBV及MTT。
1.5 统计学分析
2 结果
2.1 图像主观评价
NO-SEMAR和SEMAR组图像质量主观评分分别为(1.08±0.29)、(3.77±0.42),经 SEMAR 算法重建后,伪影明显减少,图像质量明显得到了提高,两组间差异有统计学意义(z=0.00,P<0.001)。 两名观察者间的一致性良好(Kappa=0.79,P<0.05)。
2.2 图像客观评价
客观评价结果见表1。由表1可知NO-SEMAR和 SEMAR组图像的平均噪声分别为 (60.04±21.68) HU、(24.86±11.29) HU; 金属伪影的最大直径分别为 (132.58±33.29) mm、(7.47±7.04) mm;AI分别为(56.18±16.61) 、(21.05±8.54) ; CNR 分别为(3.09±1.26)、(12.46±3.14); 差异均有统计学意义(P<0.05)。 由结果可知,SEMAR 对减少伪影、提升图像质量的效果比较明显(图2)。
2.3 CT灌注参数的评价
两组CT灌注参数CBF、CBV及MTT的 Pearson’s correlation coefficient 值 分 别 为 0.82±0.07、0.83±0.09、0.82±0.10,提示两组 CT 灌注参数线性相关性良好(P<0.000 1)。 两组参数及相关性数据见图3,可见两组的CT灌注参数线性相关性良好,没有统计学差异。
表1 两组患者图像客观评分比较(±s)

表1 两组患者图像客观评分比较(±s)
注:AI:噪声指数;CNR:对比噪声比。
组别 例数 噪声(HU) 伪影的最大直径(mm) AI(HU) CNR NO-SEMAR 57 60.04±21.68 132.58±33.29 56.18±16.61 3.09±1.26 SEMAR 57 24.86±11.29 7.47±7.04 21.05±8.54 12.46±3.14 t 值 10.59 30.05 13.87 -22.50 P 值 0.00 0.00 0.00 0.00
3 讨论
对于脑动脉瘤术后复查的患者,弹簧圈和动脉瘤夹产生的金属伪影会使术区周围的组织结构细节显示不清,而且范围较大的伪影往往会产生假象,对术后精确评价及随访复查带来极大的挑战[11]。有报道称AIDR算法可以减低图像噪声,但是不会减少金属伪影[12]。因此,本研究使用了SEMAR联合AIDR技术同时减少图像噪声和金属伪影,从而达到提高图像质量的目的。我们知道,动脉瘤栓塞及夹闭术后脑CT灌注参数直接影响患者的预后,CTA与灌注的一站式检查已经广泛应用于临床[13]。因此,本研究同时比较了两组的金属伪影和CT灌注参数。我们的研究表明,经过SEMAR算法重建后,脑动脉CTA的客观和主观图像质量均提高。与NO-SEMAR组相比,SEMAR组的噪声、AI和伪影的最大直径明显减少,而CNR和图像质量主观评分明显提高。颅内金属伪影明显减少,使得伪影周围结构的显示显著改善,为评价金属物周围的结构及术后并发症提供了有力保证。此外本研究提示,经SEMAR重建后图像的CT灌注参数没有受到影响,CT灌注参数与NO-SEMAR组具有高度的一致性。
在图像后处理方面,金属伪影校正方法大致可以分为3类:投影插值方法、迭代重建方法和混合法。投影插值法是基于滤波反投影 (Filtered back projection,FBP)法的一种算法。这种纯粹基于插值的方法的可靠性在存在多个大的金属植入物时显著减少,并且这种方法会导致金属周围区域投影值差异。此外,投影差值法虽然可减少金属伪影,但增加了远离金属区域的图像噪声,十分不利于CT图像重建[14]。迭代重建法可以有效减少金属伪影和抑制图像噪声,但受其巨大的运算量的影响,重建速度慢,难以被实际应用[15]。混合法也是以插值法为基础的方法,但只对金属区域重建时运用了迭代重建法。相比前面两种迭代重建法,混合法运算速度较快,更好的显示金属结构,但往往存在金属周围区域的失真情况,使其实际应用受到了明显限制。
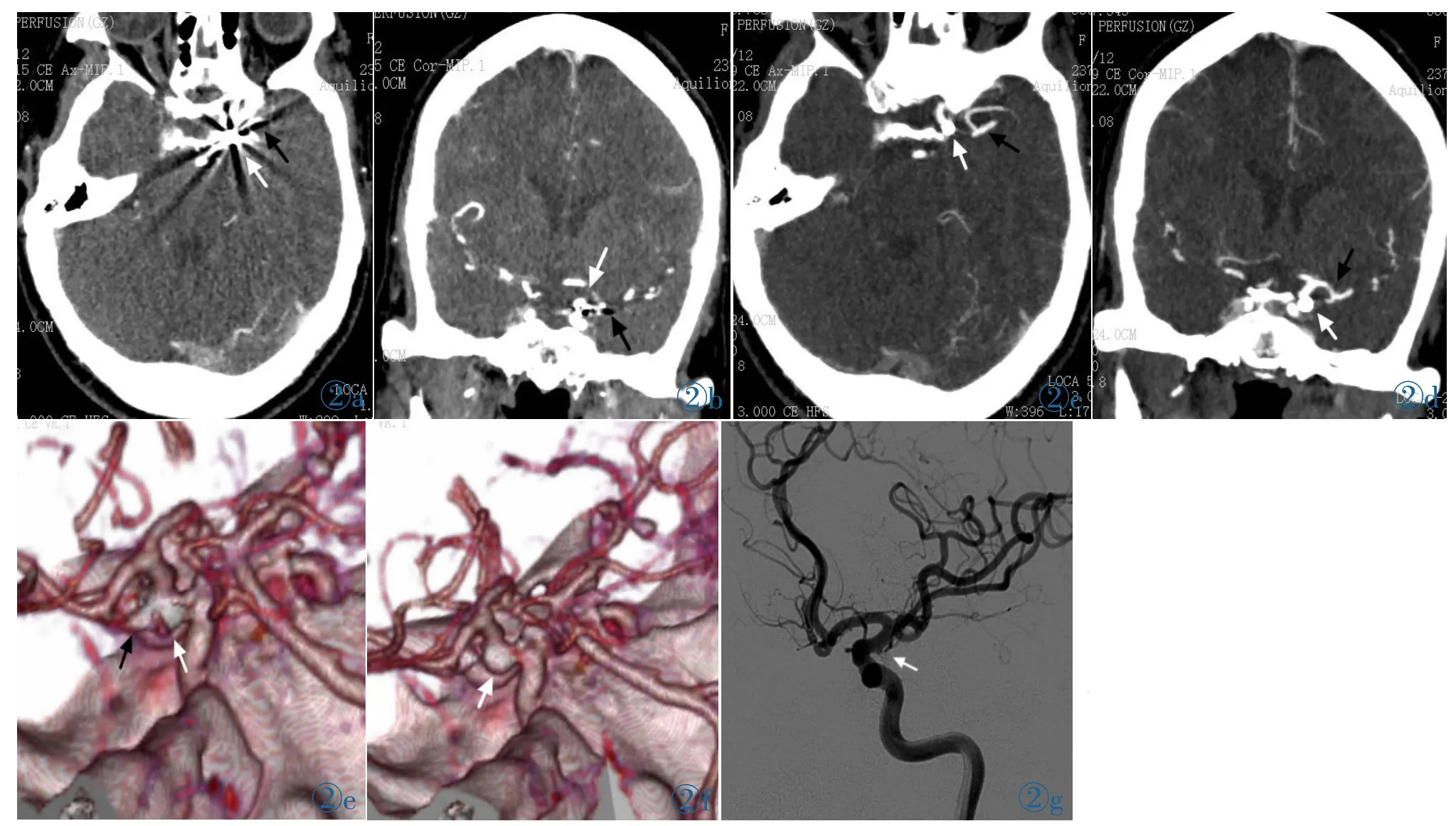
图2 女,77岁,左侧后交通动脉瘤栓塞术后6月复查。在No-SEMAR轴位(图2a)和冠状位图像(图2b)上,动脉瘤栓塞物(白箭头)周围严重的金属伪影,导致周围结构如大脑中动脉显示不清 (黑箭头)。SEMAR组轴位(图2c)和冠状位(图2d)图像显示伪影明显减少,动脉瘤完全栓塞(白箭头),周围结构如大脑中动脉显示清晰 (黑箭头)。在No-SEMAR VR 图像上(图2e)显示大量伪影致尖角样突起,误以为是动脉瘤残留或复发。在SEMAR VR 图像上(图2f)显示伪影消失,动脉瘤已完全栓塞。随诊DSA图(图2g)证实这一点。Figure 2.A 77-year-old female with a posterior communicating aneurysm 6 months post-coil embolization.Non-SEMAR(single-energy metal artifact reduction)axial(Figure 2a)and coronal images(Figure 2b)demonstrate the presence of strong metallic artifacts around the coiled aneurysm(white arrow),and the surrounding structure is obscure,like the middle cerebral artery(black arrow).SEMAR axial(Figure 2c)and coronal images(Figure 2d)show complete occlusion of the aneurysm with substantially reduced metallic artifacts (white arrow),and the surrounding structure is clear,as the middle cerebral artery(black arrow).The non-SEMAR images(Figure 2e)show several artifacts like sharp corns which can be misdiagnosed as residual or aneurysm recurrence.The SEMAR images(Figure 2f)demonstrating no artifacts,and the aneurysm has been embolized and the same findings are verified by digital subtraction angiography(Figure 2g).

图3 两组ROI的CT灌注参数值散点图。 图3a~3c:两组CT灌注参数线性相关性图;图3a:平均脑血流量(mL/(100 g·min));图3b:平均脑血容量(mL/100 g);图3c:平均通过时间(s)。Figure 3.Scatter diagrams of the mean values obtained from all regions of interest.Figure 3a:mean cerebral blood flow(CBF,units for X- and Y-axes:mL/(100 g·min));Figure 3b:mean cerebral blood volume(CBV,units for X- and Y-axes:mL/100 g);Figure 3c:mean transit time(MTT,units for X- and Y-axes:s).
本研究采用的SEMAR技术是基于FBP的一种算法[16]。本研究中经SEMAR算法重建后,远离金属区域的图像噪声没有增加,这可能与SEMAR算法本身和颅内金属植入物一般远离空气有关。另外,SEMAR算法重建的时间相对较快,NO-SEMAR组的图像重建接近实时重建,在我们的平台上SEMAR组重建需要10~15 min。而且,SEMAR算法通过分隔图像中的金属开始,不会影响没有金属伪影的层面,和本研究中两组的CT灌注参数没有统计学差异相吻合。Korpics等[12]报道经SEMAR重建后,在颈部没有金属伪影的层面,SEMAR重建前后CT值和噪声没有变化,与本研究结果相一致。
能谱CT突破了传统CT在球管方面的限制,产生单一能量的电子,从而实现低辐射量、高分辨率的目标。与采用软件算法去除金属伪影不同的是,能谱CT并不是单纯对已采集数据进行处理,使ROI的图像质量得到提升,而是在图像采集时,利用单一能量光子去照射,进而采集投影数据,因此,从理论上讲,这种方法能够完全避免因射线硬化产生的金属伪影。但是,金属伪影并非仅由射线硬化效应产生,电子饥饿效应、部分容积效应、噪声、散射以及运动伪影同样会造成金属伪影的存在,并且鉴于当前制造工艺和技术水平的限制,能谱CT还不可能完全规避射线硬化效应造成的金属伪影。另外一方面,能谱CT单能量技术对较大金属伪影的矫正往往过强[17]。此外,该技术需要双源CT进行扫描,并且需要详尽的扫描方案,目前关于双源CT最佳kVp的设置方案没有达成共识[18]。而且诸如患者的体型、假体的组成和双能量的采集方法等各种因素均会影响其减低金属伪影的有效性。与双能CT的去伪影原理不同的是,SEMAR技术是一种基于原始数据且与单能量模式一起作用的后处理算法,其数据采集过程与普通容积扫描过程是一样的,可以在后处理时去除金属伪影。因此,扫描前不需要准确了解患者体内有无金属植入物,这一优势大大提高了其临床应用价值,适宜在临床工作中进一步推广。但SEMAR目前只能用于轴向扫描,在螺旋扫描上应用SEMAR算法仍在研究当中。因此,目前只能评价16 cm扫描范围内的病变,当扫描范围超过16 cm时,步进扫描(Step-and-shoot)技术可以解决这个问题。
研究局限:①我们只评价了图像质量的改进,而没有评价SEMAR的诊断性能,没有和 “金标准”DSA对照。②我们没有研究80 kV以外的管电压的影响,没有研究辐射剂量与伪影之间的联系。③我们没有研究不同材料对伪影及图像质量的影响。④在本研究中,我们没有将SEMAR算法与其他去伪影算法进行比较。因此,需要进一步的研究来确定SEMAR算法是否更加通用。
总之,SEMAR算法减少了颅内动脉瘤植入物的金属伪影,能在不影响脑CT灌注结果准确性的情况下,提高脑CT灌注的图像质量,为评价金属物周围的结构、术后并发症及预后提供了有力保证,值得临床推广运用。

