热带假丝酵母菌感染临床检验调查
罗云 王瑜敏 罗盛
随着免疫抑制剂、激素、广谱抗菌药物的大量应用,以及器官移植技术的开展、各种导管的应用及肿瘤化疗等,使各种条件致病菌尤其是真菌感染日趋严重[1-2]。当前临床感染的真菌虽以白色假丝酵母菌感染为主,但非白色假丝酵母菌感染比率逐年上升。有研究报道称,热带假丝酵母菌是导致假丝酵母菌感染的第二常见原因[3]。为探讨热带假丝酵母菌的临床感染及其对抗真菌药物的耐药状况,为预防与控制医院真菌感染提供依据,本资料对本院2013年7月至2016年7月收治的47例热带假丝酵母菌进行了回顾性的临床调查,并对分离菌株进行了生化特性和对抗真菌药物的敏感情况分析,现将结果报道如下。
1 临床资料
1.1 一般资料 选自温州医科大学附属第一医院2013年7月至2016年7月收治的血培养“热带假丝酵母菌”阳性病例共47例。其中男31例,女16例,年龄中位数51岁;<20岁患者5例,21~40岁4例,41~60岁29例,≥61岁9例;血液内科24例,重症监护12例,急诊、呼吸、消化和胃肠外科等总共11例。
1.2 方法 (1)菌株和培养:对患者的血培养分离真菌采用VITEK2全自动鉴定仪及配套酵母样真菌鉴定卡YST作假丝酵母菌属菌种鉴定,确定其为“热带假丝酵母菌”菌属。分离菌株保存于琼脂糖平板(含1%蛋白胨和2%葡萄糖,YCB agar,Difco Laboratories,USA),在含1%蛋白胨和2%葡萄糖的YCB液体培养基(YCB,Difco Laboratories)中37℃预培养24h,离心收集菌体,用PBS洗两次,调整菌体数用于生化特性鉴定。(2)真菌生化特性的鉴定:生化特性鉴定包括蛋白酶、脂肪酶和葡糖苷酶活性鉴定。蛋白酶活性鉴定:取预培养的真菌,在含5% 牛血清蛋白(BSA;Sigma Chemical Co.,USA)的YCB液体培养基中培养4d,取0.2ml上清液与1ml含5% BSA的乙酸钠(1M,pH4.0)溶液在37℃共培养1h,之后加入1.0 ml 三氯乙酸(10%,TCA; Sigma)终止反应。离心后取上清液检测750nm吸光度值;脂肪酶活性鉴定:取预培养的真菌,在含2.5% Tween-80的YNB培养基(0.7%YNB,Difco Laboratories)中37℃培养3d,之后用lipase assay kit(Toyobo,Osaka,Japan)检测其脂肪酶活性;葡糖苷酶活性鉴定:取预培养的真菌,在含0.6% 麦芽糖的YNB培养基(0.7%YNB,Difco Laboratories)中37℃培养16h,取上清液,与含5mM吡喃葡糖苷的柠檬酸盐溶液(pH6.0)在37℃反应30min,0.1M的Na2CO3终止反应,测其在405nm的吸光度值。所有试验中均采取实验室保存分离的白色假丝酵母菌作为对照。(3)体外抗真菌药物敏感性检测:采用ATBTM FUNGUS3真菌药敏卡进行常用抗真菌药物体外敏感性检测,包括5-氟胞嘧啶、两性霉素B、氟康唑、伊曲康唑和伏立康唑。(4)治疗情况和预后分析:采用卡泊芬净针和卡泊芬净针联合两性霉素B治疗后患者预后转归情况,死亡比例及死亡原因进行统计分析。
1.3 统计学方法 采取SPSS19.0统计软件。计数资料组间比较采用χ2检验,P<0.05表示差异有统计学意义。
2 结果
2.1 菌株生化特性鉴定 对分离的真菌培养物全部进行生化特性鉴定,包括蛋白酶活性,脂肪酶活性和葡糖苷酶活性。每株真菌培养物进行3次平行试验测试,取平均值进行记录分析。本资料分离的热带亚热带假丝酵母菌的蛋白酶活性显著低于白色假丝母菌(P<0.05),葡糖苷酶活性显著高于白色假丝酵母菌(P<0.05),脂肪酶活性无显著差异。
2.2 菌株耐药性分析 分离的47株真菌,均对5-氟胞嘧啶和两性霉素B敏感,对氟康唑敏感为63.8%(30/47),对伊曲康唑敏感为59.6%(28/47),对伏立康唑敏感为68.1%(32/47),见表1。最小抑菌浓度(MIC):5-氟胞嘧啶完全敏感浓度≤2μg/ml;氟康唑完全敏感浓度≤8μg/ml,剂量依赖性敏感浓度16~32μg/ml,抵抗浓度 >32μg/ml;伏立康唑完全敏感浓度≤1μg/ml,剂量依赖性敏感浓度2~4μg/ml,抵抗浓度>4μg/ml;伊曲康唑完全敏感浓度≤0.125μg/ml,剂量依赖性敏感浓度0.25~0.5μg/ml,抵抗浓度>0.5μg/ml。两性霉素B完全敏感浓度≤ 1μg/ml。
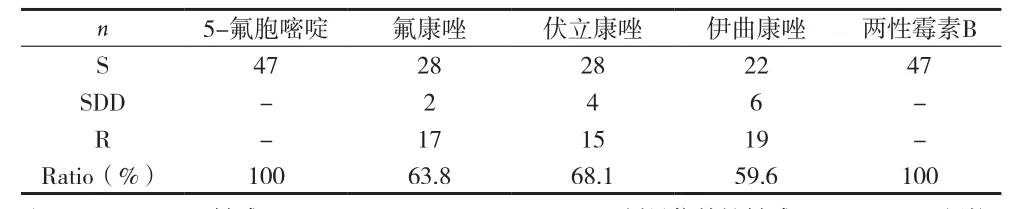
表1 菌株耐药性分析
2.3 治疗方法与预后分析 对患者采取卡泊芬净针和卡泊芬净针联合两性霉素B针抗真菌治疗,治疗结果表明,23例患者预后良好(49.0%),24例患者死亡(51.0%),主要死亡原因为感染性休克和多脏器功能衰竭,见表2。

表2 治疗方案与预后分析(n)
3 讨论
热带假丝酵母菌是一种腐物寄生菌,广泛分布于自然界,也可存在于健康人体的体表皮肤和外界相通的腔道中,如口腔、消化道、阴道等部位。当机体抵抗力下降或局部环境发生改变时,热带假丝酵母菌易致病是一种条件致病菌,而且,热带假丝酵母菌感染的发生率和病死率要高于白色假丝酵母菌。热带假丝酵母菌常引起免疫功能减弱患者肺部感染、血液感染、泌尿系统感染、生殖系统感染、眼部感染乃至全身感染。目前国内外对热带假丝酵母菌引起的感染以研究血液感染居多[4]。
热带假丝酵母菌呈圆形或卵圆形,直径3~6μm,革兰氏染色阳性,着色不均匀。沙氏琼脂上呈奶油样,灰白色,柔软,菌落光滑,边缘或有皱褶,而在吐温80玉米粉琼脂平板上可见大量菌丝,上附芽生孢子,不产生厚膜孢子。在血清中不产生典型的芽管; 少数菌株圆形孢子出芽处明显狭窄,“芽管”较粗。能同化葡萄糖、麦芽糖、蔗糖、半乳糖、木糖、海藻糖,尚同化纤维二糖,不同化L-阿拉伯糖和鼠李糖。该菌除可在黏膜细胞上增殖引起感染外,其产生的毒素可引起过敏反应及产生水解酶类,引起组织损伤,重者可导致患者死亡[5]。
本资料中患者多分布于血液内科,ICU次之,其余来源于急诊、呼吸、消化和胃肠外科等。这些患者的共同特点是:长期患病,病情较重,年老体弱,免疫力极度低下,定期放化疗,长期应用免疫抑制剂,皮质激素,长期反复使用多种广谱抗菌药物,破坏了机体自然保护屏障,导致体内微生态平衡紊乱,造成菌群失调,抑制了常见的条件致病菌,使假丝酵母菌属大量繁殖。此外,临床创伤性诊疗手段的广泛开展,如气管插管、气管切开、各种插管的留置等因素降低了机体正常防御功能,为假丝酵母菌属的侵入提供了条件。
热带假丝酵母菌的生化反应显示,本资料中分离的热带假丝酵母菌的蛋白酶活性显著低于白色假丝酵母菌(P<0.05),葡糖苷酶活性显著高于白色假丝酵母菌(P<0.05),脂肪酶活性无显著差异。体外药物敏感试验提示,分离的47株真菌,均对5-氟胞嘧啶和两性霉素B敏感,说明5-氟胞嘧啶和两性霉素B是治疗深部真菌的首选药物,5-氟胞嘧啶不良反应轻,而两性霉素B不良反应较大,但5-氟胞嘧啶较少单独用药,一般与两性霉素B 联合应用;对氟康唑的敏感率为63.8%(30/47),对伊曲康唑的敏感率为59.6%(28/47),对伏立康唑的敏感率为68.1%(32/48),氟康唑、伊曲康唑和伏立康唑是三唑类药物,在临床上广泛应用,其作用于细胞色素P450 酶和14α-脱甲基酶,最终使麦角醇合成受阻,造成甲基戊酸在细胞内的堆集,使膜结构破坏,抑制真菌生长,这是三唑类药物的共同作用机制,亦是造成交叉耐药的理论基础。随着越来越多的抗真菌药物被应用于临床,深部真菌的耐药性也在明显增加,尤其是对作为一线药物的氟康唑。目前,就氟康唑的使用是否是导致非白假丝酵母菌感染比例上升的原因仍存在争议。实际上临床治疗真菌感染并不容易,因为每种抗真菌药物都有一定的毒性作用,而其毒性作用限制了用量和使用方式,使感染部位药物浓度偏低,而达不到杀菌程度。作者在临床上采取对患者进行卡泊芬净针和卡泊芬净针联合两性霉素B针抗真菌治疗,治疗结果表明,23例患者预后良好(49.0%),24例患者死亡(51%),造成死亡的主要原因为感染性休克和多脏器功能衰竭。
有关体外药敏试验与临床疗效的一致性尚需进一步研究。热带假丝酵母菌作为重要的非白假丝酵母菌,感染日益增多,且会导致比其它假丝酵母菌更高的病死率,因此临床需要尤其重视其感染情况,机体的抵抗力与免疫力低下与真菌感染有重要关系,因此对于年龄大、免疫力低下、住院时间长、长期使用抗生素等危险因素的患者,临床医生需尤其注意真菌的感染。微生物实验室应加强对此类菌株的检测,并将酵母菌属鉴定至种的水平。同时为预防与控制耐药菌株的进一步增加,给临床治疗提供依据,及时准确地了解和掌握医院真菌感染和耐药情况至关重要。
[1] Laupland KB, Gregson DB, Church DL, et al. Invasive Candida species infections: a 5 year population-based assessment. Journal of Antimicrobial Chemotherapy, 2005, 56(3): 532-537.
[2] Wang JL, Chang SC, Hsueh PR, et al. Species distribution and fluconazole susceptibility of Candida clinical isolates in a medical center in 2002. Journal of microbiology, immunology, and infection, 2004, 37(4): 236-241.
[3] 李文革, 程颖, 吴媛, 等. 王靖医院内假丝酵母菌感染的菌种构成和耐药性分析. 疾病监测, 2013, 28(8): 684-687.
[4] Chiu YS, Chang SC, Hsueh PR, et al. Survey of amphotericin B susceptibility of Candida clinical isolates determined by E-test.Journal of microbiology, immunology, and infection, 2006, 39(4):335-341.
[5] Mandelblat M, Frenkel M, Abbey D, et al. Phenotypic and genotypic characteristics of Candida albicans isolates from bloodstream and mucosal infections. Mycoses, 2017, 60(8): 534-535.

