麻花艽×狭叶柴胡F1代β-amyrin合成酶基因表达及齐墩果酸含量分析
刘艳玲, 向凤宁
(1.莱芜职业技术学院信息工程系,山东 莱芜 271100;2.山东大学生命科学院 植物细胞工程与种质创新教育部重点实验室,山东 济南 250100)
【研究意义】中药材的绝大多数有效成分都来源于次生代谢产物,随着对植物次生代谢网络认识和研究的不断深入,应用细胞融合方式向目标植物中导入可表达的基因序列或者完整的生物合成途径已成为可能,并逐渐发展为具有广阔应用前景的热点研究领域[1-4]。高寒藏药材—麻花艽(GentianastromineaMaxim.)系龙胆科、龙胆属植物,分布于青海、西藏、甘肃等海拔2500~4700 m 的高寒地区,全草及根入药,其主要有效成分为齐墩果酸、龙胆苦甙等,主治风湿性关节痛、黄胆性肝炎、胆结石等病[5-7]。狭叶柴胡(BupleurumscorzonerifoliumWilld.)为伞形科、柴胡属植物,主要用于治疗感冒发热、胸肋腹痛等症,是著名的抗病毒感冒中药材[8]。【前人研究进展】利用细胞融合手段可以将代谢途径中的关键酶基因进行转移,从而改变目标产物的含量。Yun等在颠茄(Atropabelladonna)中引入编码莨菪碱-6β-羟化酶的基因,结果使颠茄中含量很低的高价值托品生物碱东莨菪碱大量积累,并且几乎所有的莨菪碱都转化成了东莨菪碱[9];Shelagh等通过番茄CHI(chalcone isomerase)基因的超量表达使其果皮的类黄酮含量增加了78倍,其加工产品番茄酱中的类黄酮含量增加了21倍[10]。Shim等在人参中过量表达SQS基因,测得转基因植物中人参皂甙的含量为对照的2.5倍[11]。【本研究切入点】本实验室已经通过细胞融合的方式获得了麻花艽和狭叶柴胡的杂种细胞系[12],并已经在亲本中克隆了齐墩果酸合成的关键酶β-amyrin合成酶的基因序列[13],分析了该基因在杂种细胞系中的表达方式,确定杂种细胞系中基因的变异与齐墩果酸含量的关系。【拟解决的关键问题】以期为深入研究中草药次生代谢奠定良好的基础。
1 材料与方法
1.1 供试材料
麻花艽、狭叶柴胡、杂种细胞系ZA、ZB、ZC。
1.2 试验方法
1.2.1 基因扩增 ①引物。GsAS1正向引物P1:5′-GAATTCATGTGGAGGCTAAAAATCGG-3′;GsAS1反向引物P2:5′-CGTCTCCTACGGCACTTGCTTGCG-3′;GsAS2正向引物P3:5′-CTCGAGATGTGGAGGCTGAAGATCG-3′;GsAS2反向引物P4:5′-CTCGAGCGTCTCTCAAATCTTCAAGATGGCAA-3′。② 扩增体系。采用20 μl PCR体系rTaq为大连Takara生产。反应体系如下:10×PCR Buffer 2.0 μl(1×);MgCl2(25 mM)1.2 μl(1.5 mM);dNTP(10 mM)0.2 μl(200 μM);引物 各40 pmol;rTaq酶(5 U/μl)0.1 μl(0.5 U);模板 50~200 ng;加水至20 μl;③扩增程序。按照以下循环进行扩增:94 ℃ 5 min;94 ℃ 1 min,57 ℃ 2.5 min,72 ℃ 1 min,35个循环;72 ℃ 10 min;10 ℃保存。
1.2.2 β-amyrin合成酶基因的半定量RT-PCR 正向引物:5′-CCACCG(A)TTTTTG(A)CTCTGTA-3′;反向引物:5′-ACTTGGCTTTCGATA(T)CTTGG-3′;Tm:49 ℃。
1.2.3 测序 博尚生物公司。
1.2.4 序列比对 应用DNAMAN软件进行。
1.2.5 HPLC 仪器为日本岛津公司生产的LC-10AD型高效液相色谱仪,齐墩果酸标准品从中国药品生物制品检定所购买。分别取4.0,8.0,12.0,16.0,20.0 μl 齐墩果酸标准品进样,以峰面积值为横坐标,进样量为纵坐标作图,得回归方程为:y=0.00287888x-16.1335,r=0.9994724,表明仪器精密度良好。
2 结果与分析
2.1 杂种细胞系中β-amyrin合成酶基因的克隆与序列分析
2.1.1 杂种细胞系中β-amyrin合成酶基因的克隆 在先前的研究中,已经通过RACE方法在麻花艽中获得了 2 个同源的β-amyrin合成酶基因,将其称作GsAS1 和GsAS2;在狭叶柴胡中获得了 1 个 β-amyrin合成酶基因,称作BsAS。本研究以P1、P2和P3、P4 两对引物分别在杂种细胞系ZA、ZB、ZC中进行扩增,分别获得了GsAS1 的同源序列GsAS1za、GsAS1zb、GsAS1zc和GsAS2的同源序列GsAS2za、GsAS2zb、GsAS2zc(图1a,b),通过序列分析表明,这 6 个基因均编码β-amyrin合成酶基因。在狭叶柴胡BsAS的多个区段中设计引物,对杂种细胞系进行扩增,均未获得相应的片段,由此可以看出,杂种ZA、ZB、ZC仅表达了来源于供体麻花艽的GsAS1和GsAS2。
2.1.2 杂种细胞系中GsAS1和GsAS2的同源性比较 将杂种细胞系ZA、ZB、ZC中的6个基因序列GsAS1a、GsAS2a、GsAS1b、GsAS2b、GsAS1c、GsAS2zc进行分析,其核苷酸同源性为90.24 %,氨基酸序列同源性为90.38 %。其中,GsAS1与GsAS1a、GsAS1b、GsAS1c序列完全相同;GsAS2与GsAS2b序列完全相同,与GsAS2a、GsAS2c不相同,其核苷酸序列同源性分别为99.8 %和99.87 %,氨基酸序列同源性分别为99.87 %和99.80 %。
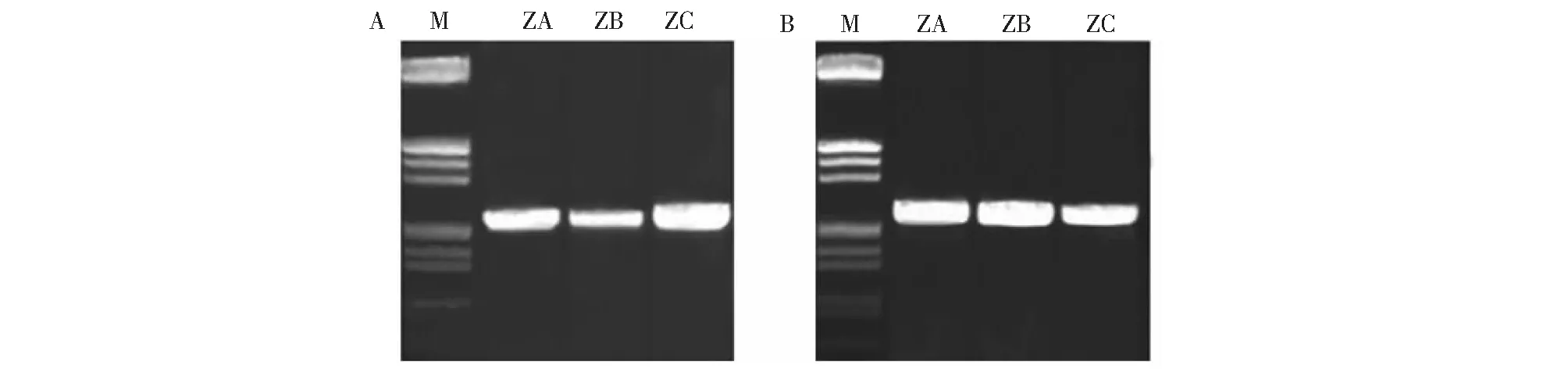
图1 体细胞杂种cDNA中GsAS1(A)和GsAS2(B)基因的扩增Fig.1 Amplification of GsAS1(A)和GsAS2(B) from cDNA in hybrids

IMS: isomultiflorenol合成酶; BAS: β-amyrin 合成酶 (单功能型); MTS:多功能三萜合成酶; LUS:羽扇豆醇合成酶; OSC: 氧化角鲨烯合成酶; CAS: 环阿屯醇合成酶; MAS: 混合的β-amyrin 合成酶图2 亲本和杂种中β-amyrin合成酶基因的系统树分析Fig.2 Phylogenetic analysis of β-amyrin synthase in parents and hybrids
2.2 体细胞杂种中β-amyrin合成酶基因的系统树分析
为了分析体细胞杂种中β-amyrin合成酶基因与亲本及其它物种中同族基因的亲缘关系,从GenBank中选取了拟南芥、大豆、人参、甘草、白桦、紫菀、北柴胡等植物的β-amyrin合成酶基因、环阿屯醇合成酶基因、羽扇豆醇合成酶基因等氧化角鲨烯家族基因进行系统树分析。结果表明:GsAS1及其3个杂种细胞系最接近拟南芥的LUP2(属于羽扇豆醇合成酶),在GsAS1所处的分支上,除刚才提到的LUP2外,其余均为βAS(β-amyrin合成酶)(图2),说明GsAS1及其杂种应聚类在β-amyrin合成酶中。GsAS2及其3个杂种细胞系均与人参的OSCPNY2(属于β-amyrin合成酶)关系最近,而体细胞杂种的另一个亲本狭叶柴胡的BSAS存在于系统树的另一β-amyrin合成酶分支上,与绿玉树最接近,与麻花艽亲缘关系较远。
2.3 杂种细胞系中GsAS1和GsAS2的等位变异研究
对亲本及其杂种细胞系的β-amyrin合成酶基因序列进行分析,如图3所示,杂种ZA和ZC的GsAS2 与麻花艽的GsAS2序列存在1~2个碱基的突变(同源性分别为99.3 %和98.6 %),麻花艽GsAS2 第4位氨基酸(CTG)在杂种ZA和ZC中突变为CTA,但CTG和CTA均编码亮氨酸;384位氨基酸CCA在杂种ZC中突变成CCG,但二者均编码脯氨酸。这说明在杂种细胞系中,GsAS2a和GsAS2c虽发生了不同程度的碱基突变,却编码同一种氨基酸,即发生了无义突变,因此,不影响杂种ZA和ZC中GsAS2的功能。
2.4 杂种细胞系及亲本β-amyrin合成酶基因表达及下游产物齐墩果酸含量分析
2.4.1 杂种细胞系及亲本β-amyrin合成酶基因表达分析 利用β-amyrin合成酶基因对杂种ZA、ZB、ZC及亲本进行RT-PCR分析,如图4所示,杂种ZB和ZC均高于双亲,ZA低于双亲,且ZA低于ZB和ZC。

图3 GsAS2基因在麻花艽及杂种中的核苷酸序列比较Fig.3 Comparison of nucleotides of GsAS2 in G. straminea and hybrids
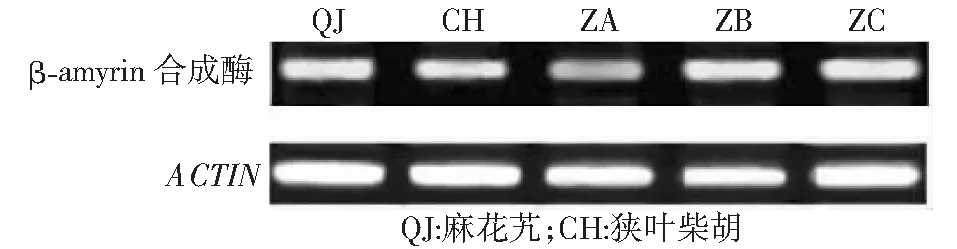
图4 亲本及杂种β-amyrin合成酶基因的RT-PCR分析Fig.4 Expression of β-amyrin synthase gene in parents and hybrids by semi-quantitative RT-PCR
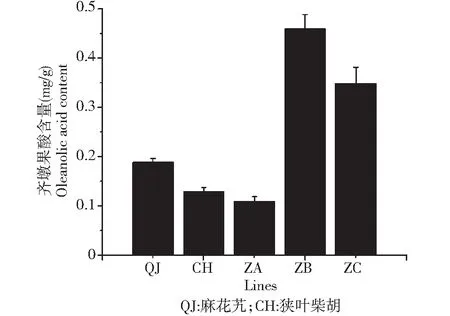
图5 体细胞杂种及亲本齐墩果酸的HPLC分析Fig.5 HPLC analysis of the oleanolic acid in parents and hybrids
2.4.2 杂种细胞系及亲本齐墩果酸含量分析 齐墩果酸含量的HPLC分析表明,体细胞杂种ZA的齐墩果酸含量均低于双亲,ZB和ZC均高于双亲,其中,ZB的齐墩果酸含量最高,是麻花艽的 2.4 倍,其次是ZC,为麻花艽的1.8 倍(图5)。综合图4~5可以看出,齐墩果酸含量和β-amyrin 合成酶基因的表达水平呈正相关,并且说明ZA和ZC中的碱基突变并没有影响其下游产物齐墩果酸的含量,也就是说:β-amyrin合成酶中个别基因的突变对该基其功能未造成影响。
3 讨 论
前人研究发现,体细胞杂交技术可以实现外源染色体/DNA片段及基因向受体基因组的转移[14-16]。本研究通过分析β-amyrin合成酶基因在麻花艽与狭叶柴胡的3个杂种细胞系中的存在方式,发现杂种与麻花艽基因的序列相似性很高,仅在ZA中发生了1个碱基突变,在ZB中未发生突变,在ZC中发生了2个碱基突变。进一步分析发现,这些基因的变异与3个体细胞杂种的齐墩果酸含量没有对应关系,表明,β-amyrin合成酶基因发生1~2个碱基的无义突变对该基因的功能没有影响。
另外,在本实验中,体细胞杂种中的β-amrin合成酶基因均来源于麻花艽,而未得到来源于柴胡的该基因。其原因可能与柴胡的β-amrin合成酶基因在其愈伤组织培养及体细胞杂交过程中发生了丢失,其丢失位点由麻花艽β-amyrin合成酶基因所替代有关,这还需要进行深入探讨。
参考文献:
[1]Bertea C M, Freije J R, van der Woude H, et al. Identification of intermediates and enzymes involved in the early steps of artemisinin biosynthesis inArtemisiaannua[J]. Planta Med, 2005, 71: 40-47.
[2]Donaldson P A, Bevis E E, Pandeya R S, et al. Random chloroplast segregation and frequent mtDNA rearrangements in fertile somatic hybrids betweenNicotianatabacumL. andN.glutinosaL.[J].Theor. Appl. Genet, 1994, 87: 900-908.
[3]Choi D W, Jung J, Ha Y I. Analsis of transcripts in methylmonate-treated ginseng hairy roots to identity genes involved in the biosynthesis ginsenosides and other secondary metabolites[J]. Plant Cell Rep, 2005, 23(8): 557-566.
[4]Haralampidis K, Trojanowska M, Osbourn A E. Biosynthesis of triterpenoid saponins in plants[J].Adv. Biochem. Eng. Biotechnol, 2002, 75: 31-49.
[5]张西玲,晋 玲,刘丽莎. 近10年秦艽、麻花艽研究概况[J]. 中国中医药信息,2000,10(增): 62-63.
[6]刘艳红. 秦艽中的环烯醚苷类成分[J]. 云南植物研究,1995,15(1):85-91.
[7]近藤嘉和. 秦艽的成分研究[J]. 生药学杂志,1996,46(3):342-343.
[8]刘永春,丛培臣. 柴胡的化学成分及药理作用研究概况[J]. 黑龙江医药,2006,19(3):216-218.
[9]Yun D J, Hashimoto T, Yamada Y. Metabolic engineering of medicinal plants: transgenicAtropabelladonnawith an improved alkaloid composition[J]. Proceedings of the National Academy of Sciences, 1992, 89(24): 11799-11803.
[10]Muir S R, Collins G J, Robinson S, et al. Overexpression of petunia chalcone isomerase in tomato results in fruit containing increased levels of flavonols[J]. Nature Hiotechnology, 2001, 19(5): 470-474.
[11]Shim J S, Lee O R, Kim Y J, et al. Overexpression ofPgSQS1 increases ginsenoside production and negatively affects ginseng growth rate inPanaxginseng[J]. Journal of Ginseng Research, 2010, 34(2): 98-103.
[12]蔡云飞. 植物远缘体细胞杂种的核/质基因组及其代谢转录组研究[D]. 山东大学:博士论文,2006.
[13]Liu Y L, Cai Y F, Zhao Z J, et al. Cloning and functional analysis of a β-amyrin synthase associated with oleanolic acid biosynthesis inGentianastramineaMaxim[J]. Biol. Pharm. Bull, 2009, 32(5): 818-824.
[14]Xiang F N, Xia G M, Zhou A F, et al. Asymmetric somatic hybridization between wheat (Triticumaestivum) andBromusinermis[J]. Acta Botanica Sinica, 1999, 41(5): 458-462.
[15]Xia G M, Xiang F N, Zhou A F, et al. Asymmetric somatic hybridization between wheat (TriticumaestivumL.) andAgropyronelongatum(Host)Nevishi[J]. Theor Appli Genet, 2003, 107: 299-305.
[16]向凤宁. 小麦远缘体细胞杂交及体细胞杂种的遗传研究[D]. 山东大学:博士论文,2003.

