热处理对紫山药淀粉理化和消化特性的影响
李 涛, 安凤平,2, 宋洪波,2, 王艺伟,2, 刘灿灿, 万 成
(1.福建农林大学食品科学学院;2.福建省特种淀粉品质科学与加工技术重点实验室,福建 福州 350002)
紫山药(DioscoreaalataL.)又称紫莳药、紫人参等,为一年或多年生藤本蔓性植物,在我国南方地区广泛种植[1].淀粉是紫山药中的主要成分,约占新鲜块茎生物总量的16%~20%.
原淀粉因具有某些天然缺陷,大大限制了其应用范围[2].改性处理改善了原淀粉的加工性能和营养价值,使之广泛应用于肉类制品、烘焙制品、奶制品以及冷冻等食品中[3-4].淀粉改性主要包括物理法、化学法和酶法,其中物理法因具有方法简便、产品安全性好等优点而受到广泛关注.韧化法、湿热法和压热法是物理改性淀粉的主要方法,是一类低成本、环保并能改善淀粉性能的方法[5].
淀粉的溶解特性、热焓特性与食品加工过程设计以及产品设计密切相关,消化特性是淀粉类食品营养和功能性的重要组成部分[6-8].近年来,关于紫山药的研究多集中于小分子生物活性成分的功能性研究与利用[9-10],而关于紫山药淀粉加工利用的研究鲜有报道.因此,本试验开展韧化、湿热和压热3种物理方法对紫山药淀粉溶解、热焓等理化性质和消化特性影响的研究,并分析导致这些差异的原因,旨在为紫山药淀粉的加工利用提供参考.
1 材料与方法
1.1 材料
紫山药产自福建省三明市建宁县,品种为紫玉淮山.
D-葡萄糖检测试剂盒由爱尔兰Megazyme公司提供;柠檬酸、氯化钠、异抗坏血酸钠、无水乙醇、磷酸氢二钠和氢氧化钙均为国产分析纯.
主要仪器与设备有200F3型差示扫描量热仪(德国NETZSCH公司)、JSM-6380 LV型扫描电镜(日本JEOL公司)、MiniFlex 600型X-射线衍射仪(日本Rigaku公司)、Nicolet-460型傅立叶变换红外光谱扫描仪(美国Thermo Scientific公司)和UV-1100型紫外可见分光光度计(上海美谱达仪器有限公司).
1.2 方法
1.2.1紫山药淀粉的制备以新鲜紫山药为原料,去皮、切片,置于复配护色剂(含0.05%柠檬酸、0.10%氯化钠、0.35%异抗坏血酸钠和0.06%氢氧化钙)中室温护色30 min.取出沥干,加入3倍的蒸馏水,用搅拌机打浆.将浆液依次过纱布、100绢目和200绢目后,静置沉降6 h.取下层沉淀并用蒸馏水反复清洗,每次清洗后室温静置4 h,弃去上清液,直到上清液澄清为止,置离心机中于4 000 r·min-1离心15 min,刮去上层杂质,反复离心除杂,乙醇真空抽滤沉淀物后置烘箱中,于40 ℃烘至含水量为(10±0.2)%,粉碎后过100目筛,得紫山药淀粉.
1.2.2基本成分的测定样品中的淀粉、蛋白质、脂肪、灰分和粗纤维含量按照文献[11]的方法测定,重复3次,取平均值.
1.2.3热处理方法韧化处理:参考杜双奎等[12]的方法.取含水量为75%的紫山药淀粉乳,60 ℃下恒温振荡水浴24 h,于4 000 r·min-1离心10 min,烘干、粉碎,过100目筛.
湿热处理:参考Xia et al[13]的方法.取紫山药淀粉加水至水分含量为20%,放入密闭耐高温的反应釜中进行湿热处理(温度100 ℃,时间10 h),烘干、粉碎,过100目筛.
压热处理:参考张丽芳等[14]的方法并稍作修改.取紫山药淀粉,加水配成25%的乳液,于高压灭菌锅(120 ℃)中处理30 min,烘干、粉碎,过100目筛.
1.2.4颗粒形貌观察将少量样品用双面胶固定在制样台上,在真空条件下进行喷金处理,采用扫描电镜观察淀粉颗粒形貌.
1.2.5傅立叶变换红外光谱分析将干燥的淀粉样品与溴化钾以1∶100~1∶150的比例进行混合,充分研磨.将研磨好的粉末倒入模具中抽真空压片,于12 MPa压力下保持30 s,压至透明.傅立叶变换红外光谱扫描仪扫描范围为4 000~400 cm-1,分辨率为4 cm-1,扫描次数16~32.
1.2.6结晶特性的测定采用X-射线衍射仪测定.参数设定为:管压40 kV,电流200 mA,在2θ=5°~35°的范围内进行连续扫描.采用MDI Jade 5.0软件处理试验数据.
1.2.7溶解特性的测定溶解特性包括溶解度和膨胀度,参考Gani et al[15]的方法测定.
1.2.8热焓特性的测定准确称取3.4 mg淀粉样品置耐高压坩埚中,加入6.6 μL去离子水,锁紧压盖后室温平衡24 h.采用差示扫描量热仪(DSC)进行测定,扫描温度范围为20~200 ℃,加温速率为10 ℃·min-1.起始温度(To)、峰值温度(Tp)、终止温度(Tc)和糊化焓由差示扫描量热仪曲线得出,糊化温度范围(R)=Tc-To.
1.2.9体外消化特性的测定参考Englyst et al[16]的方法测定,有部分改动.取0.2 g淀粉样品置锥形瓶中,添加15 mL 0.2 mol·L-1醋酸钠缓冲液(pH 5.2),混匀后加入10 mL混合酶液(含290 U·mL-1猪胰α-淀粉酶和15 U·mL-1糖化酶),置37 ℃恒温水浴中振荡120 min.于20、120 min各取0.5 mL酶解液,加入4 mL无水乙醇,于4 000 r·min-1离心10 min.取离心上清液,采用D-葡萄糖检测试剂盒测定葡萄糖含量,根据公式(1)、(2)和(3)分别计算样品中快速消化淀粉(ready digestible starch, RDS)、缓慢消化淀粉(slowly digestible starch, SDS)、抗消化淀粉(resistant starch, RS)的含量.
(1)
(2)
RS/%=100-RDS-SDS
(3)
式中:G0—淀粉酶解前的葡萄糖质量(mg);G20—酶解20 min时的葡萄糖质量(mg);G120—酶解120 min时的葡萄糖质量(mg);W—样品的质量(mg).
1.2.10数据统计应用DPS V7.65软件分析处理间的差异显著性(P<0.05),采用OriginPro 8.0软件绘图.
2 结果与分析
2.1 紫山药淀粉的基本成分组成
从表1可以看出,紫山药淀粉样品中的蛋白质、脂肪、灰分和粗纤维含量低,淀粉含量高达97.26%,表明制备紫山药淀粉的方法是合理的,淀粉样品具有较高的纯度.

表1 紫山药淀粉样品的基本成分(干基)1)Table 1 Basic components of purple yam starch sample (dry basis)
1)数据为平均值±标准差(n=3).
2.2 紫山药淀粉的颗粒形貌
图1显示:紫山药原淀粉颗粒大多呈不规则的卵形,且表面光滑、轮廓清晰;韧化处理对淀粉颗粒形貌影响较小,颗粒表面仅发生少许形变;经湿热处理的改性淀粉,颗粒表面有部分糊化引起的凹坑现象;经压热处理的改性淀粉,由于高温、高压导致颗粒原有形貌已不存在,形成不规则的块状颗粒.

A:原淀粉;B:韧化改性淀粉;C:湿热改性淀粉;D:压热改性淀粉.图1 紫山药原淀粉和改性淀粉的扫描电镜图Fig.1 Scanning electronic micrographs of native starch and modified starches prepared from purple yam
2.3 紫山药淀粉的红外光谱扫描
1 047/1 022和1 022/995 cm-1处吸收峰的比值可作为淀粉双螺旋短程结构有序度的指数,1 047/1 022 cm-1处吸收峰强度的比值越大,表明结晶度越高;1 022/995 cm-1处吸收峰强度的比值越小,表明淀粉颗粒中双螺旋的分子有序度越高[17].从图2可得出,原淀粉及韧化改性、湿热改性、压热改性淀粉在1 047/1 022 cm-1处吸收峰的比值分别为0.628、0.642、0.589和0.518.与原淀粉相比,韧化改性淀粉的结晶度有所增大,湿热改性淀粉则有所减小,压热改性淀粉的结晶度最小;原淀粉及韧化改性、湿热改性、压热改性淀粉在1 022/995 cm-1处吸收峰的比值分别为1.17、1.05、1.26和1.43,表明淀粉颗粒中双螺旋分子的有序度与结晶度呈正相关.
2.4 紫山药淀粉的结晶特性
从图3可见,紫山药原淀粉的特征峰出现在5.7°、17.3°、22.4°和24.1°处,表明原淀粉的结晶类型为B型,这与Nadia et al[18]得出的结论一致.原淀粉经湿热处理后,淀粉在23.3°处出现了新的吸收峰,在5.7°、22.4°和24.1°处消失,晶型由B型转变为C型;经韧化和压热处理后,淀粉衍射特征峰的位置未改变,依然表现为B型.对原淀粉及韧化改性、湿热改性、压热改性淀粉的X-射线衍射图谱进行处理,得结晶度分别为24.75%、25.90%、22.43%和15.36%.表明经湿热和压热改性处理后,淀粉的结晶度均较原淀粉降低,而韧化改性淀粉的结晶度升高,与红外光谱扫描所得的结果一致.有文献报道,采用压热或湿热处理的淮山药淀粉[19]和马铃薯淀粉[20]也出现了结晶度降低的现象.

图2 紫山药原淀粉和改性淀粉的红外光谱扫描图Fig.2 Fourier transform infrared spectra of native starch and modified starches prepared from purple yam
2.5 紫山药淀粉的溶解特性
从表2可以看出,经改性后,淀粉的溶解度均小于原淀粉,文献[21]亦报道热处理可导致淀粉溶解度减小.与原淀粉相比,韧化改性淀粉在溶解度为50~80 ℃的范围内均减小,仅在90 ℃时溶解度与原淀粉相当;当温度为50 ℃时湿热改性淀粉的溶解度与原淀粉相当,随着温度的升高,溶解度小于原淀粉的溶解度,且温度越高,差异越大;尽管压热改性淀粉的溶解度较原淀粉低,但总体上表现良好.可见,韧化改性淀粉的溶解性较差,湿热改性淀粉的溶解度不佳,压热改性淀粉的溶解度较好.
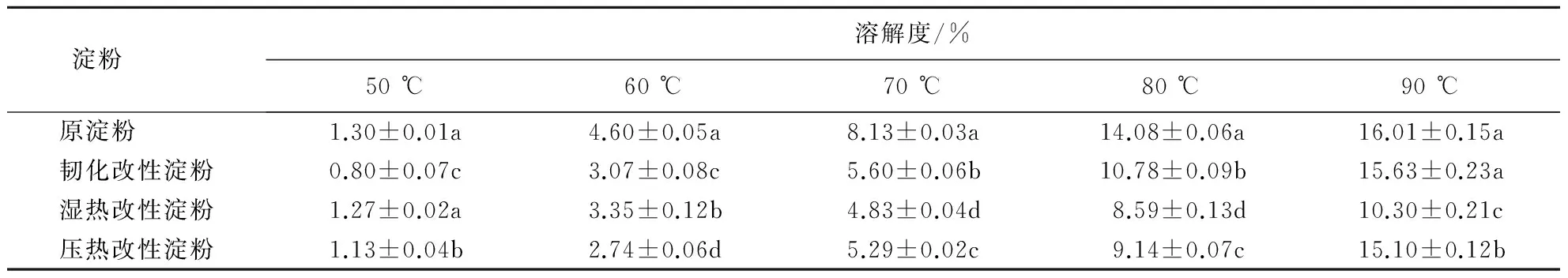
表2 温度对紫山药原淀粉和改性淀粉溶解度的影响1)Table 2 Effect of temperature on solubility of native starch and modified starch prepared from purple yam
1)数据为平均值±标准差(n=3);同列数据后附不同字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).
表3显示:各淀粉样品的膨胀度均随温度的升高而增大;温度为50~60 ℃时,改性淀粉膨胀度均较原淀粉显著增大;温度为80~90 ℃时,改性淀粉的膨胀度均显著低于原淀粉(P<0.05).总体而言,韧化改性淀粉的膨胀性较差,湿热改性淀粉的膨胀性不佳,压热改性淀粉的膨胀性较好.
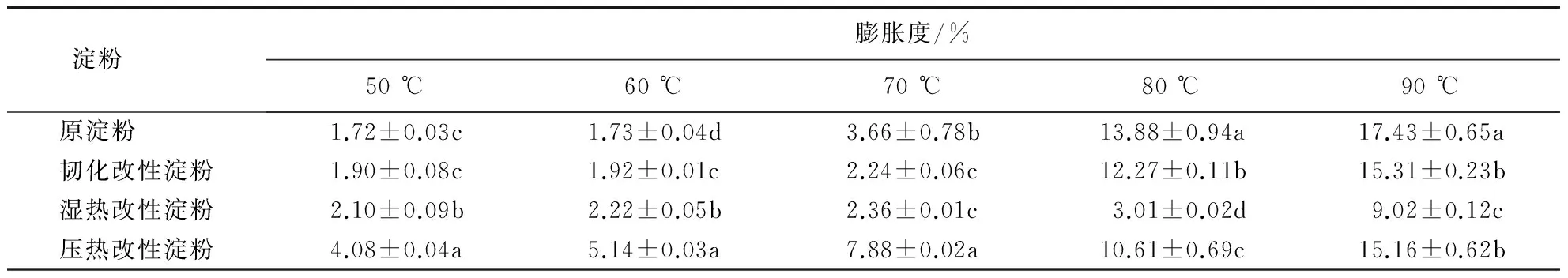
表3 温度对紫山药原淀粉和改性淀粉膨胀度的影响1)Table 3 Effect of temperature on swelling capacity of native starch and modified starch prepared from purple yam
1)数据为平均值±标准差(n=3);同列数据后附不同字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).
各淀粉样品的溶解度和膨胀度随温度的升高而增大,这主要与加热过程中被破坏的淀粉晶体结构等因素有关[22].韧化处理促进了淀粉中直链淀粉分子链与支链淀粉分子链的相互作用,致使分子结构重排,提高了淀粉颗粒结晶的完美性及分子有序化,导致淀粉溶出率降低及颗粒水合能力下降[23],因此,溶解度和膨胀度与原淀粉相比较低;湿热作用下的水分子吸收了强辐射热,变成高能水分子,使淀粉结晶结构改变形成小的网络结构,晶型由B型转变为C型,同时,直链淀粉与直链淀粉、直链淀粉与脂质之间的相互作用更加紧密,极大地限制淀粉的溶解和膨胀[24];与湿热处理不同的是,高压与过量的水分促使原淀粉颗粒破碎,链段部分裂解,重新取向、结晶[25],使得结晶区中被切断的氢键数目增多、双螺旋结构破坏,游离的水分子更容易渗透到淀粉分子内部,因此具有良好的吸水膨胀性和溶解性.
2.6 紫山药淀粉的热焓特性
由表4可知,改性淀粉糊化的To、Tp和Tc均显著高于原淀粉(P<0.05),其中,压热改性淀粉的糊化温度最高,湿热改性淀粉次之,韧化改性淀粉相对较小.与原淀粉相比,湿热和压热处理导致淀粉糊化焓显著降低(P<0.05),其中,压热改性淀粉糊化焓大幅度降低.

表4 紫山药原淀粉和改性淀粉的热力学特性参数1)Table 4 Thermal properties of native starch and modified starch prepared from purple yam
1)数据为平均值±标准差(n=3);同列数据后附不同字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).
糊化温度(To、Tp和Tc)与淀粉颗粒内部晶体部分的结晶状况密切相关,内部晶体结构的破坏会引起低熔点结晶向高熔点结晶转变[26].韧化过程通过对结晶层双螺旋链的作用使淀粉颗粒的完整度增加,晶体结构更趋完美化[27],提高了淀粉自身的结晶度,导致韧化改性淀粉To、Tp和Tc增大;相对于韧化改性淀粉对原有结晶结构的调整,湿热,特别是压热处理致使淀粉原有结晶遭到破坏,结晶度降低,部分晶体重新缔合形成新的高熔点结晶,导致To、Tp和Tc较原淀粉显著增大.
糊化焓指双螺旋结构分离所需能量,与双螺旋短程结构有序性密切相关[28].韧化温度的适宜及水分的过量,加速了水化速率和葡聚糖链的流动,导致双螺旋链在一定范围内的并排移动形成完美的晶型结构[29],规则的双螺旋结构解旋需要更多能量,因此与原淀粉相比糊化焓升高;淀粉颗粒中存在的双螺旋结构随剧烈的热能而发生降解,同时水分的存在促使湿热处理过程中淀粉分子链间相互作用,限制了非结晶区的移动性[25],导致了淀粉糊化焓降低;高温和高压作用,迫使淀粉内部结构发生断裂,双螺旋结构无序度增加,表现出压热改性淀粉的糊化焓显著降低.
2.7 紫山药淀粉的消化特性

表5 紫山药原淀粉和改性淀粉中的RDS、SDS和RS含量1)Table 5 Content of RDS, SDS and RS in native starch and modified starches prepared from purple yam
1)数据为平均值±标准差(n=3);同列数据后附不同字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).
表5显示,紫山药原淀粉中RDS和SDS的含量较少,RS的含量最高,表明生淀粉难以消化利用.与原淀粉相比,韧化改性淀粉的RDS含量降低,SDS含量显著增加,RS含量为75.87%,可利用性仍然很差;湿热改性淀粉的可消化淀粉(RDS+SDS)大幅度增加,特别是SDS含量增幅最大,表现出良好的慢速消化特性;压热改性淀粉的RDS和SDS含量均明显增大,特别是RDS含量很高,而RS含量很低,因此具有很好的快速消化特性.
淀粉的酶解速率与淀粉颗粒形貌、结晶类型以及双螺旋结构等因素有关.完整的颗粒表面抑制淀粉酶浸入颗粒内部,可提高淀粉的抗酶解性[30];有序的双螺旋结构、完整且致密的结晶结构较难酶解[31].在韧化温和的作用条件下,淀粉基本保持原有的颗粒形貌,形成较高的结晶度以及有序的分子结构抑制了淀粉的酶解,因此韧化改性淀粉的消化性不佳.在湿热蒸汽的作用下,氢键受到破坏导致淀粉的双螺旋结构发生解旋,淀粉颗粒不再致密,水分子进入颗粒内部,使颗粒结构发生改变,反应在淀粉颗粒外部的现象就是淀粉颗粒表面的凹坑,结晶度和双螺旋结构的有序度较低,因此湿热改性淀粉的消化性得以明显改善.高温和压力的协同作用伴随着部分分子链的断裂、瓦解,颗粒内部结晶区氢键破坏,结晶度和双螺旋结构的有序度最低,同时淀粉颗粒结构破碎增大了与酶接触的表面积,更易被淀粉酶结合利用[32],因此,压热改性淀粉的可消化性最好.
3 结论
不同热处理条件,如温度、时间和水分等导致紫山药淀粉表面结构受到不同程度的破坏,同时引起淀粉内部双螺旋分子的有序度和晶体结构发生变化,致使改性淀粉溶解与膨润特性、热焓和消化特性均明显不同,扩大了紫山药淀粉在食品工业及其他行业的应用范围.其中,韧化改性淀粉表现出较差的溶解度、膨胀度和消化性,糊化温度为76.25~84.42 ℃,糊化焓最高(7.84 J·g-1);湿热改性淀粉具有良好的缓慢消化特性,糊化温度较高(89.20~106.83 ℃),糊化焓较低(6.06 J·g-1),溶解度和膨胀度最差;压热改性淀粉具有较好的溶解、膨润以及快速消化的特性,其糊化温度为98.72~120.52 ℃,糊化焓为1.96 J·g-1.
[1] YIN J M, YAN R X, ZHANG P T, et al. Anthocyanin accumulation rate and the biosynthesis related gene expression inDioscoreaalata[J]. Biologia Plantarum, 2015,59(2):325-330.
[2] LAWAL O S. Starch hydroxypropylation: Physicochemical properties and enzymatic digestibility of native and hydroxypropylated finger millet (Eleusinecoracana) starch [J]. Food Hydrocolloids, 2009,23:415-425.
[3] 张微,赵凯.改性淀粉在焙烤制品中的应用[J].农产品加工·学刊,2011,6:79-80.
[4] 李素云,鲍彤华.变性淀粉在肉制品中的应用及发展[J].肉类研究,2008(5):22-24.
[5] JAYAKODY L, HOOVER H, LIU Q, et al. Studies on tuber starches Ⅲ. Impact of annealing on the molecular structure, composition and physicochemical properties of yam (Dioscoreasp.) starches grown in Sri Lanka [J]. Carbohydrate Polymers, 2009,76(1):145-153.
[6] JAYAKODY L, HOOVER R. Effect of annealing on the molecular structure and physicochemical properties of starches from different botanical origins—A review [J]. Carbohydrate Polymers, 2008,74(3):691-703.
[7] SILVA W M F, BIDUSKI B, LIMA K O, et al. Starch digestibility and molecular weight distribution of proteins in rice grains subjected to heat-moisture treatment [J]. Food Chemistry, 2017,219:260-267.
[8] DUNDAR A N, GOCMEN D. Effects of autoclaving temperature and storing time on resistant starch formation and its functional and physicochemical properties [J]. Carbohydrate Polymers, 2013,97(2):764-771.
[9] MORIYA C, HOSOYA T, AGAWA S, et al. New acylated anthocyanins from purple yam and their antioxidant activity [J]. Bioscience, Biotechnology, and Biochemistry, 2015,79(9):1 484-1 492.
[10] GUO X X, SHA X H, CAI S B, et al. Chinese purple yam (DioscoreaalataL.) extracts inhibit diabetes-related enzymes and protect HepG2 cells against oxidative stress and insulin resistance induced by FFA [J]. Food Science and Technology International, 2015,21(5):677-683.
[11] 汪颖.莲子抗性淀粉制备、性质及其对双歧杆菌增殖效应的研究[D].福州:福建农林大学,2013.
[12] 杜双奎,王华,赵佳,等.韧化处理对不同玉米淀粉理化特性的影响[J].食品科学,2012,33(17):78-81.
[13] XIA H P, LI Y Y, GAO Q Y. Preparation and properties of RS4 citrate sweet potato starch by heat-moisture treatment [J]. Food Hydrocolloids, 2016,55:172-178.
[14] 张丽芳,宋洪波,安凤平,等.淮山药淀粉及其抗性淀粉理化性质的比较[J].中国粮油学报,2014,29(3):24-29.
[15] GANI A, BASHIR M, WANI S M, et al. Modification of bean starch by c-irradiation: Effect on functional and morphological properties [J]. LWT-Food Science and Technology, 2012,49(1):162-169.
[16] ENGLYST H N, KINGMAN S M, CUMMINGS J H. Classification and measurement of nutritionally important starch fractions [J]. European Journal of Clinical Nutrition, 1992,46(2):30-50.
[17] WANG S, WANG J, ZHANG W, et al. Molecular order and functional properties of starches from three waxy wheat varieties grown in China [J]. Food Chemistry, 2015,181:43-50.
。[18] NADIA L, WIRAKARTAKUSUMAH M A, ANDARWULAN N, et al. Characterization of physicochemical and functional properties of starch from five yam (Dioscoreaalata) cultivars in Indonesia [J]. International Journal of Chemical Engineering and Applications, 2014,5(6):489-496.
[19] WANG S J, WANG J R, WANG S K, et al. Annealing improves paste viscosity and stability of starch [J]. Food Hydrocolloids, 2017,62:203-211.
[20] VERMEYLEN R, GODERIS B, DELCOUR J A. An X-ray study of hydrothermally treated potato starch [J]. Carbohydrate Polymers, 2006,64(2):364-375.
[21] JACOBS H, MISCHENKON, KOCH M H J, et al. Evaluation of the impact of annealing on gelatinisation at intermediate water content of wheat and potato starches: A differential scanning calorimetry and small angle X-ray scattering study [J]. Carbohydrate Research, 1998,306(1-2):1-10.
[22] CORREIA P R, NUNES M C, BEIRAO-DA-COSTA M L. The effect of starch isolation method on physical and functional properties of Portuguese nuts starches. Ⅰ. Chestnuts (CastaneasativaMill. var. Martainha and Longal) fruits [J]. Food Hydrocolloids, 2012,27(1):256-263.
[23] OLUWATOOYIN F O, KUDIRAT T S, RUDOLF M. Dynamic rheological and physicochemical properties of annealed starches from two cultivars of cassava [J]. Carbohydrate Polymers, 2011,83(4):1 916-1 921.
[24] LI S L, WARD R, GAO Q Y. Effect of heat-moisture treatment on the formation and physicochemical properties of resistant starch from mung bean (Phaseolusradiatus) starch [J]. Food Hydrocolloids, 2011,25(7):1 702-1 709.
[25] 赵凯.淀粉非化学改性技术[M].北京:化学工业出版社,2008:99-100.
[26] MIAO M, ZHANG T, MU W M, et al. Effect of controlled gelatinization in excess water on digestibility of waxy maize starch [J]. Food Chemistry, 2010,119:41-48.
[27] SENAY S, MARIBEL O, KRISTIN W, et al. Effect of acetylation, oxidation and annealing on physicochemical properties of bean starch [J]. Food Chemistry, 2012,134 (4):1 796-1 803.
[28] ZENG F, ZHU S M, CHEN F Q, et al. Effect of different drying methods on the structure and digestibility of short chain amylose crystals [J]. Food Hydrocolloids, 2016,52:721-731.
[29] TESTER R F, DEBON S J J, DAVIES H V, et al. Effect of temperature on the synthesis, composition and physical properties of potato starch [J]. Journal of the Science of Food and Agriculture, 1999,79:2 045-2 051.
[30] 贺永朝,吴枭锜,宋洪波,等.高压均质改性淮山药淀粉及其消化性的研究[J].现代食品科技,2016,32(4):227-233.
[31] MIAO M, ZHANG T, MU W, et al. Structural characterizations of waxy maize starch residue followinginvitropancreatin and amyloglucosidase synergistic hydrolysis [J]. Food Hydrocolloids, 2011,25(2):214-220.
[32] 赵娜.阴米淀粉的理化性质、体外消化性以及老化动力学研究[D].武汉:华中农业大学,2010.

