拟南芥泛素连接酶RING1A参与ABA信号途径的调控
张峻川, 张 力, 李苏迪, 石武良
(吉林大学植物科学学院植物遗传改良工程实验室,吉林 长春 130062)
植物体内存在多种植物激素诱导的信号通路,通过对这些信号通路的调控,植物可以响应外界信号,将细胞生理与自然环境的变化保持一致.类胡萝卜素诱导的植物激素脱落酸(abscisic acid, ABA)就是一种重要的非生物逆境信号[1].植物激素ABA调控着许多重要的生理生化进程[2].非生物逆境因子诱发ABA的合成,使植物适应外界环境的改变[3].近些年来的研究证明,植物体内的多种E3泛素连接酶受到ABA的诱导,表明ABA调控的逆境信号转导途径和依赖泛素化的蛋白降解途径存在交叉互作[4].在拟南芥基因组中,大约存在着1 400多个编码E3泛素连接酶的基因[5],RING(really interesting new gene)就是其中重要的家族[6].拟南芥中大约有469个存在RING结构域的E3连接酶,构成了拟南芥中第三大基因家族[7].据先前报道,RING型E3泛素化连接酶AIP2可以通过与ABA响应蛋白ABI3互作影响ABA信号转导的下游通路[8],表明RING家族的成员可能参与了ABA信号转导.
拟南芥基因组中编码着两个RING1同源基因:AtRING1A和AtRING1B[9].AtRING1A是多梳抑制复合物1(polycomb repressive complex1, PRC1)的核心成分,能结合两个锌原子行使E3泛素连接酶的作用[8].PRC1和PRC2属于多梳家族(polycomb group, PcG)的组分,在ABA依赖的对外界逆境响应中起重要作用[10].PcG蛋白介导着后代发育调节因子的遗传沉默,PRC1和PRC2都参与其中[11-12].最近的研究证实,PcG调控的沉默途径中,组蛋白H2A在119位赖氨酸被单泛素化.在这个过程中,RING1A/B行驶着E3泛素连接酶的作用[13].
通过大规模ABA筛选突变体,发现ring1a突变体存在ABA敏感表型.然而,拟南芥基因AtRING1A是否与ABA信号转导有关尚未清楚.通过研究和分析ring1a-11突变体(CS347748)以及RING1A过表达植株在ABA处理下相关基因的表达以及植株表型,证实了AtRING1A和拟南芥ABA响应通路有密切关系.
1 材料与方法
1.1 植物材料
1.1.1野生型拟南芥及ring1a突变体的鉴定拟南芥野生型(Columbia-4, Col4)以及T-DNA插入突变体ring1a-11 (CS347748)从ArabidopsisBiological Resource Center (ABRC)中查询并购买.
种子在4 ℃的条件下春化处理2 d,然后放置在0.8%蔗糖,1/2 MS培养基上,于22~24 ℃,60%相对湿度的长日照(16 h光照,8 h黑暗,光强100 μmol·m-2·s-1)的条件下培养.
ring1a-11突变体由RT-PCR的方法检测,使用的引物见表1(1-2).

表1 引物序列Table 1 Primers sequences
1.1.2转基因过表达植株AtRING1A的获得和检测用PCR的方法将AtRING1A编码序列从拟南芥全转录组cDNA中克隆出来,引物见表1(1-2).
将PCR产物用EcoRⅠ和HindⅢ双酶切,得到991 bp的产物,将产物插入连接到含有双35S启动子和NOS终止子的植物表达载体pEGAD-3XHA-LUC中.将连接产物转入大肠杆菌感受态DH5α中,经过0.1%卡那霉素(Kanamycin)的LB培养基筛选,挑取单克隆进行基因测序.
将测序正确的菌株扩繁提取质粒,将重组质粒转入农杆菌中(agl0).选取花期的野生型拟南芥,通过沾花侵染的方法将农杆菌侵染拟南芥Col4.
经过Basta®筛选后,将T0代植株移出,在相同条件下生长4周,取1~2片叶片,液氮中研磨,加入4×sample buffer,100 ℃热水浴10 min,经过10% SDS PAGE凝胶电泳,将蛋白转入硝酸纤维素膜膜上.用一抗(1∶500 anti-Luciferase)和二抗(驴抗鼠,Donkey anti-mouse)孵育后于Bio-Imaging Systems中曝光拍照,检测转基因植株.
1.2 ABA胁迫下种子萌发试验
将上述野生型拟南芥,ring1a突变体,RING1A过表达植株的种子浸入1%次氯酸钠中消毒10 min,用灭菌超纯水漂洗三遍后接种到含ABA(0.3,0.5,0.8 μmol·L-1)的1/2 MS培养基上,设置不含ABA的对照组.当根完全穿透种皮时,此种子被认为是发芽的.将种子放置在培养基上后,8 d内每天记录发芽率.
1.3 荧光定量实时PCR(quantitive real time PCR)
利用植物总RNA提取试剂盒(TIANGEN Company, China)提取拟南芥全转录组RNA,并用反转录试剂盒(TIANGEN Company, China)反转录成cDNA.将每个样品加入SYBA Green Master Mix染料进行荧光定量PCR,并在Mx3005P系统中检测.检测后每组值通过2-ΔΔCt法进行检测,Actin2作为内参来检测各组数据.荧光定量PCR所使用的引物见表1(3~10)每个样本都设置至少3个技术重复,每种植物样本都设置至少3个生物重复.
1.4 RING1A亚细胞定位
利用GATEWAY系统将AtRING1A连入载体pYFP, RING1A蛋白与YFP的C端相连.将重组质粒转入DH5α大肠杆菌感受态中,挑取单克隆提取质粒.取生长4周长势良好的野生型拟南芥植株,取若干叶片撕去下表皮,将叶肉细胞暴露在酶解液(每10 mL 0.15 g纤维素酶和0.04 g离析酶)中避光裂解2 h.用PEG-4000/Ca2+以及载体质粒和提取的原生质体避光孵育15 min,将质粒转入原生质体中.后22 ℃避光培16 h,置荧光倒置显微镜中观察原生质体成像.
2 结果与分析
2.1 RING1A突变体以及过表达植株的建立及组织表达分析
为了解RING1A在ABA信号转导中的功能,从ABRC中购买获得了RING1A基因的T-DNA插入突变体(CS347748).突变体的插入位点见(图1A),通过PCR和RT-PCR分析进一步证实了纯合突变体.PCR结果显示ring1a-11完全不存在RING1A转录产物(图1C).
构建了烟草花叶病毒(tobacco mosaic virus)35S启动子的控制下的RING1A的过表达植株(图2).使用一抗(anti-Luciferases)和二抗(驴抗小鼠)孵育后,HA-LUC-RING1A蛋白在Western检测下在转基因苗中高度表达,而WT和ring1a纯合突变体均未表达(图1B).
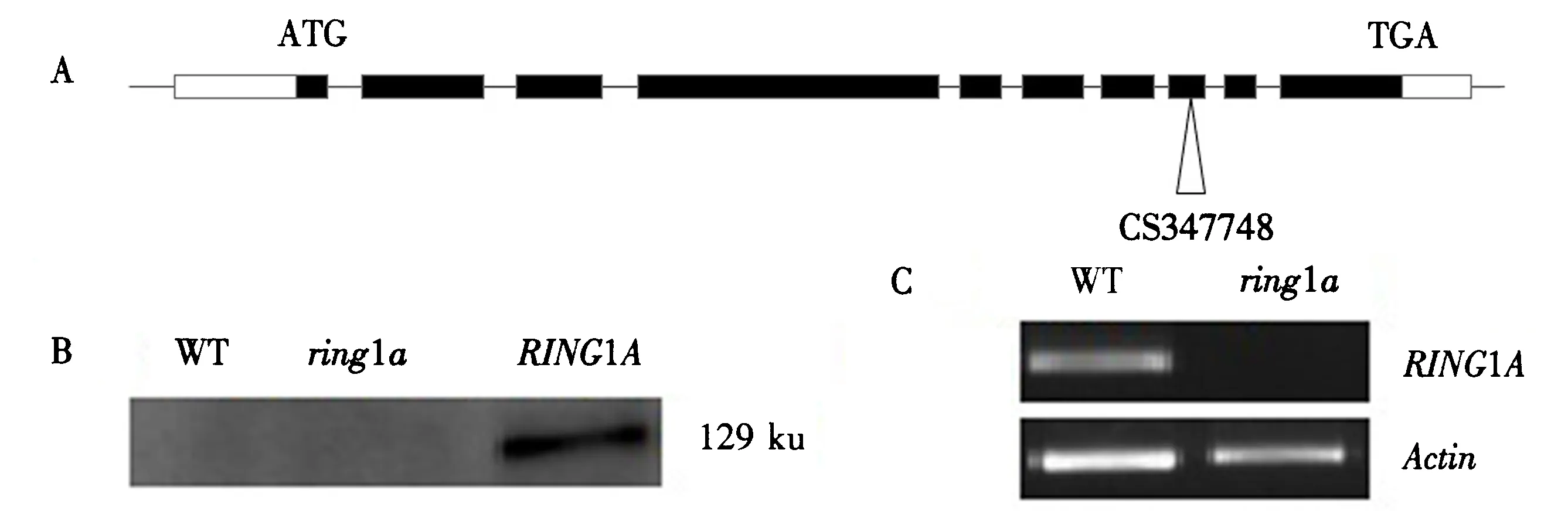
A.ring1a突变体的T-DNA插入位点;B.用免疫印迹的方法鉴定RING1A过表达植株;C.通过反转录PCR鉴定ring1a突变体拟南芥.图1 ring1a突变体及RING1A过表达植株的鉴定Fig.1 Identification of ring1a mutant and RING1A overexpression line
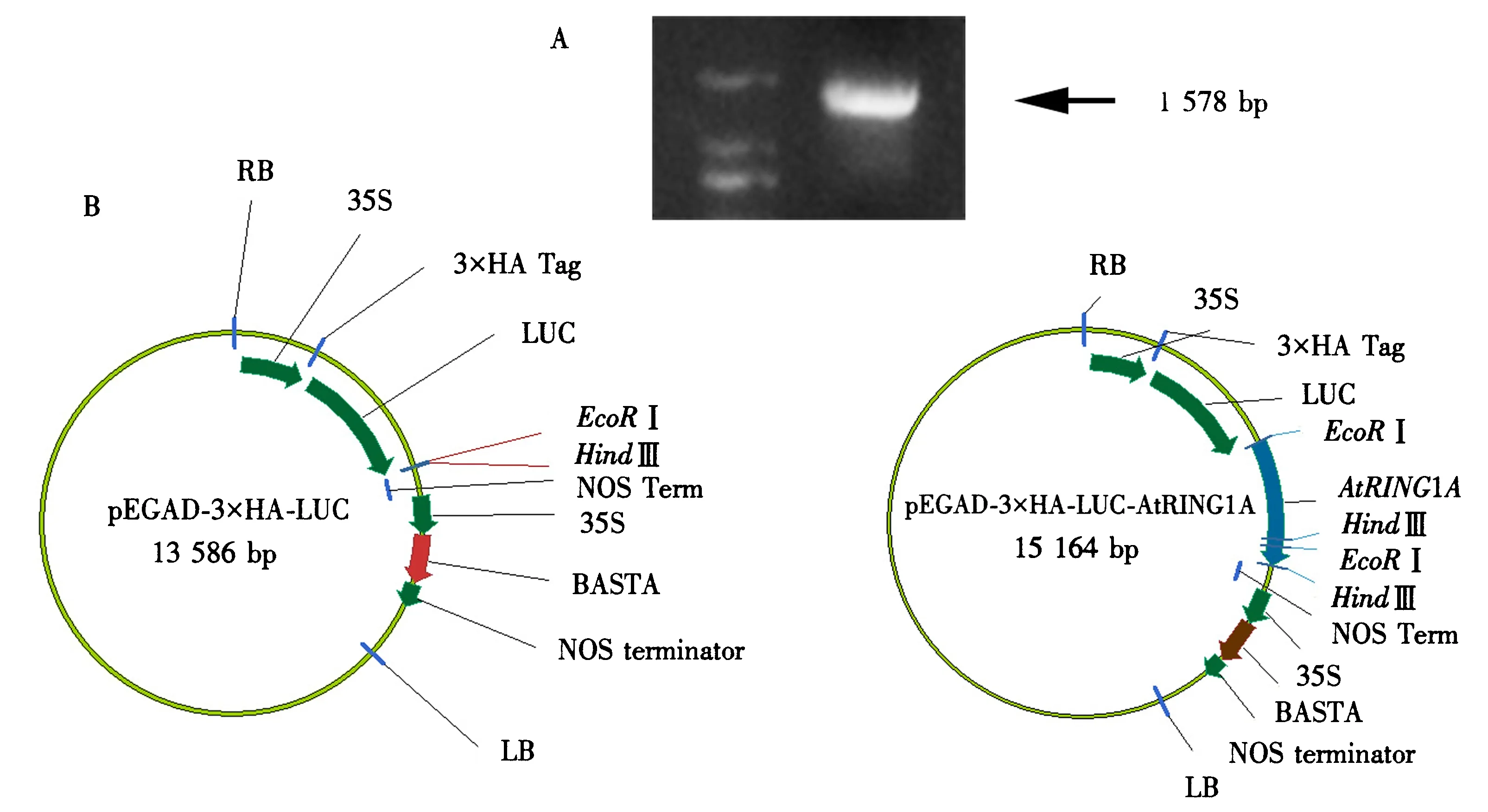
A.AtRING1A基因的克隆;B.RING1A过表达植株空载体(左)及植物表达载体(右).图2 AtRING1A基因的克隆及植物表达载体的建立Fig.2 Cloning of AtRING1A and construction of plant expression vectors
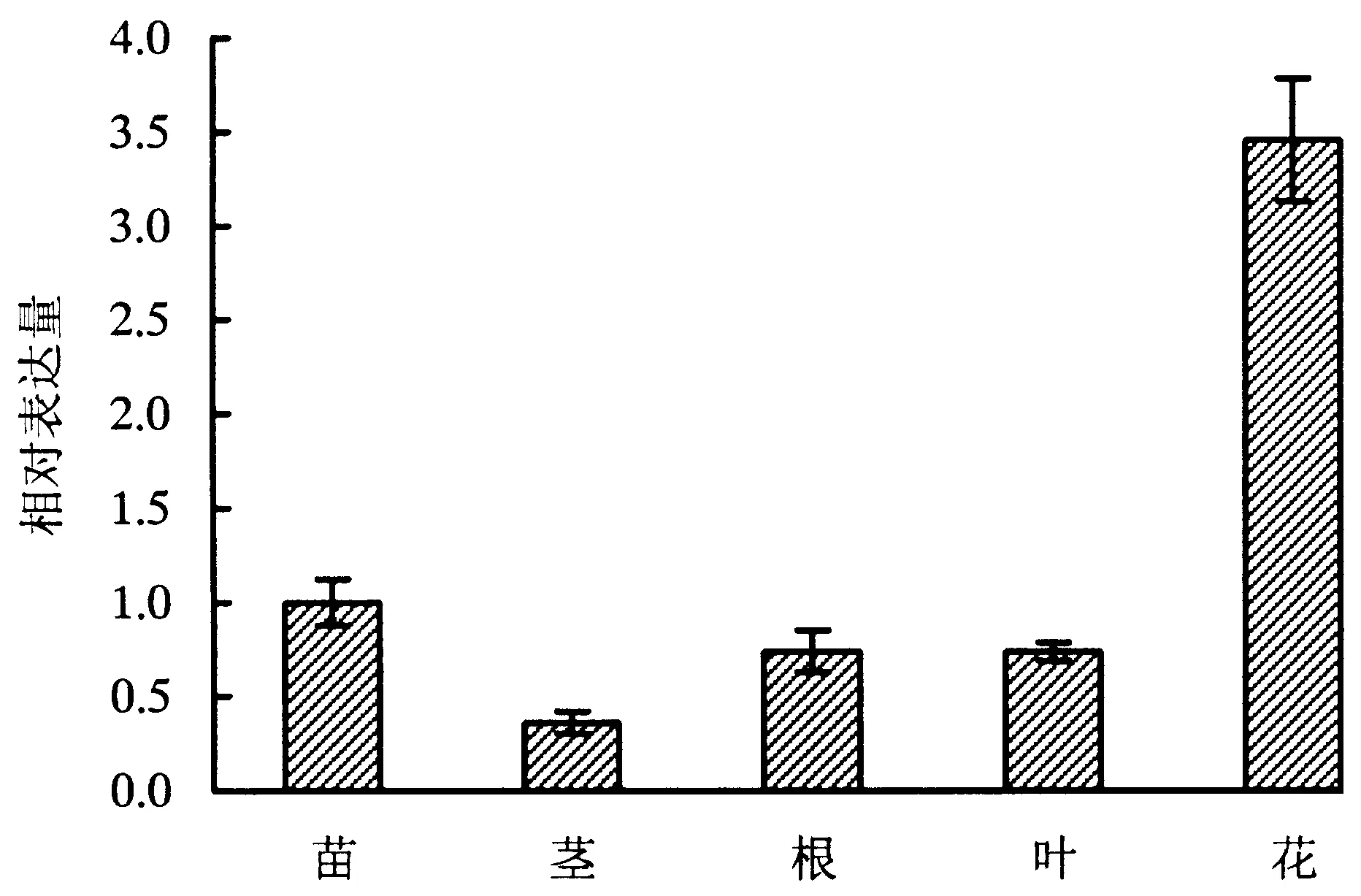
图3 AtRING1A基因在不同组织的表达分析Fig.3 Expression level on different tissues of AtRING1A
将生长3周的植物材料取不同的植物组织,提取出总RNA进行荧光定量实时PCR测定,以检测RING1A在植物各器官中的相对表达含量.结果显示,AtRING1A在植物所有部位均有表达,在种子,根和叶中表达量基本相同,茎中表达量最少,在花中表达量最高(图3).这结果可能与ABA在植物种子中的积累密切相关.
2.2 ABA处理下RING1A突变体及过表达植株萌发率
将WT、ring1a突变体,HA-LUC-AtRING1A过表达拟南芥的种子放置在含ABA(0,0.3,0.5,0.8 μmol·L-1)的1/2 MS培养基上培养8 d,结果显示,在0.3 μmol·L-1ABA处理下,ring1a突变体种子第八天萌发率明显差于野生型和过表达植株(图4).在0.8 μmol·L-1ABA处理下,RING1A过表达植株种子在第8天的发芽率明显高于野生型和突变体种子.这说明高浓度的ABA可以抑制种子萌发,而过表达RING1A基因可以阻断ABA对种子萌发的抑制作用.相反,将AtRING1A基因插入突变会使拟南芥呈现出ABA敏感的表型.
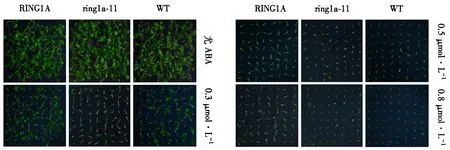
图4 ABA处理下RING1A, ring1a, WT的萌发率Fig.4 Germination rate of RING1A, ring1a, WT under ABA treatment
在不同浓度ABA处理下,3种植物材料的萌发速度也有显著不同.在0.3 μmol·L-1ABA处理下,野生型和过表达植株萌发速率相同,而ring1a突变体在第6天才完全萌发;在0.5 μmol·L-1ABA处理下,过表达植株在第4天基本萌发完成,而过表达植株在第5天才基本上萌发,ring1a突变体萌发速率明显低于前两种植物材料,而且于第8天仍未完全萌发;0.8 μmol·L-1ABA的条件下,突变体和野生型在第8天均未完全萌发,而过表达植株则在第6天基本萌发完全(图5).
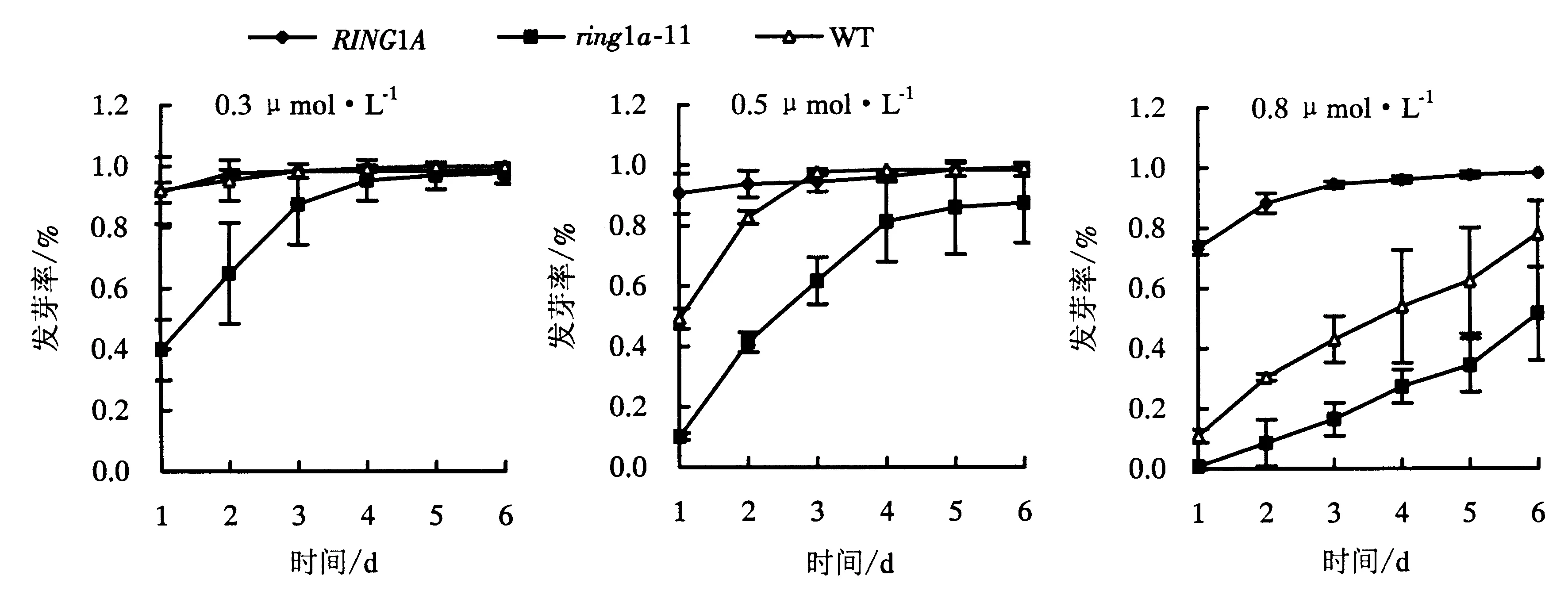
图5 不同浓度的ABA处理下植株的发芽速率Fig.5 Germination rate under different concentrations of ABA treatment
2.3 RING1A过表达植株诱导ABA响应基因的表达
应激反应基因的诱导表达是植物适应外界的重要机制之一[14].为了更深入地了解RING1A在ABA反应中的作用,我们通过实时PCR的方法测定了2个ABA响应基因的表达情况.测试的基因包括RD29A和RD29B(图6).结果显示,在10 μmol·L-1ABA的处理下,所有基因都有相关的变化:2个基因在3种植物材料中均有上调,而在RING1A过表达植株中,2个基因相对表达量的上调幅度明显高于野生型和突变体.这表明RING1A可以影响逆境胁迫标记基因RD29A、RD29B的表达量,说明RING1A参与了ABA信号转导途径.而在过表达植株中,RD29A,RD29B相对表达量都有显著上升,这说明RING1A可能作为一个负调控因子参与了ABA信号转导途径.
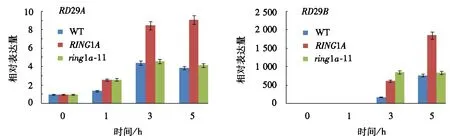
图6 10 μmol·L-1 ABA处理下RING1A诱导ABA响应基因的表达Fig.6 Expression of ABA response gene stimulated by RING1A under 10 μmol·L-1 ABA treatment
2.4 RING1A蛋白的亚细胞定位
为了检测RING1A的亚细胞位置,我们将RING1A和YFP的C端相连,构建了YFP-RING1A融合蛋白表达载体.然后将所得构建体通过PEG-4000/Ca2+诱导转入拟南芥原生质体中,同时,用pYPF空载体转入原生质体中作为对照.用DAPI染料染色,细胞核会在荧光显微镜下显影.通过不同波长的荧光观察,结果显示显示:YFP-RING1A融合蛋白仅在核中定位,表明RING1A可能在细胞核中起作用(图7).ABA信号转导途径中存在多个转录因子,它们定位在核中促进相关基因的表达.RING1A可能与这些转录因子存在联系并以此调控ABA信号转导途径.
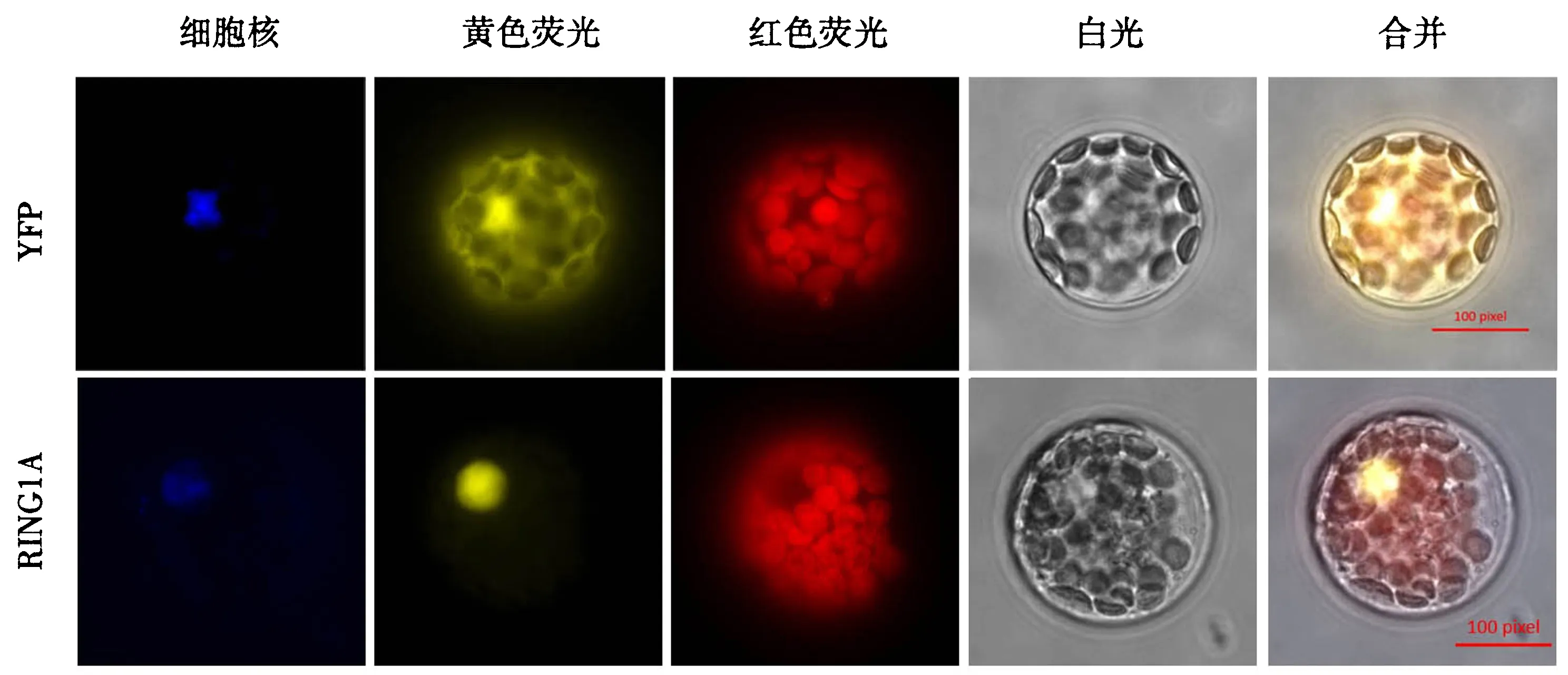
图7 RING1A的亚细胞定位Fig.7 Subcellular localization of RING1A
第一行为空载体亚细胞定位,第二行为RING1A融合表达YFP的亚细胞定位.DAPI为细胞核染料;YFP列为YFP荧光蛋白的图像;RFP列为叶绿体荧光图像;Bright列为白光下原生质体的图像;Merge为各图像重叠.
3 讨论
在拟南芥基因组中,超过1 400多个基因被预测编码着不同的E3泛素化连接酶[5].最近的研究显示,一些拟南芥RING E3连接酶参与各种细胞过程,如脱落酸信号传导,生长素信号传导,油菜素类固醇反应,种子发芽,幼苗发育,适应性氮限制途径和糖响应[15-17].此外,RING蛋白家族在对环境刺激的反应中起关键作用,如参与光形态建成,防御信号的传导,衰老,耐寒,干旱,盐和渗透胁迫的耐受机制等[18-20].这里,我们确定了编码泛素E3连接酶的RING1A基因(AT5G44280)的表征,证明了RING1A参与了ABA信号转导.RING1A在植物各部分均有表达,在花中表达量最高.在种子中期成熟阶段,ABA在花中积累到最大水平[21].大部分ABA在营养组织中合成,然后转运到各个部位,转运到花中的ABA有助于调控种子发育.ABA可以诱导种子败育,减少种子产量,并且推迟胚胎生长[22],这可以解释AtRING1A在花的高度表达.在种子的萌发过程中,ABA先在种子中积累,种子处于休眠状态.而RING1A对ABA的抵抗作用可能促使种子打破休眠而发芽.
在植物体中,至少有两个信号调节系统涉及应激反应基因表达,即ABA依赖和独立于ABA的信号转导途径.拟南芥R D29A基因表达可以被干旱,高盐度,低温和脱落酸信号转导途径所诱导,具有120 bp启动子区域,包含DRE,RE/CRT-核心基序(A/GCCGAC)和ABA反应元件(ABRE)序列[23].这两个独立的顺式作用元件,一个响应渗透势的变化,独立于ABA,另一个受ABA信号转导途径调控.相比之下,RD29B启动子不含渗透势调控的启动子区域[24].我们通过对ABA响应基因RD29A和RD29B的实时定量PCR,分析了ABA信号转导途径中RING1A的调节功能.我们的研究表明,RING1A过表达植株中ABA诱导的应激反应基因RD29A、RD29B的相对表达量的变化比在WT和ring1a突变体植物中更显著.这个可以说明RING1A可以在ABA处理的信号下,诱导ABA响应基因的表达.
综上所述,AtRING1A与拟南芥ABA信号通路密切相关,RING1A很有可能作为一种负调控因子调控ABA信号通路,抑制ABA对植物的作用,提高植物对ABA的抗性.作为一种E3泛素连接酶,AtRING1A很有可能能与ABA信号通路中的某个蛋白相结合使其泛素化而降解,以此来调控ABA信号通路,这有待于进一步的研究和发现.
[1] WEINER J J, PETERSON F C, VOLKMAN B F, et al. Structural and functional insights into core ABA signaling[J]. Curr Opin Plant Biol, 2010,13(5):495-502.
[2] LIU X, ZHU Y, ZHAI H, et al. AtPP2CG1, a protein phosphatase 2C, positively regulates salt tolerance ofArabidopsisin abscisic acid-dependent manner[J]. Biochem Biophys Res Commun, 2012,422(4):710-715.
[3] XIONG L M, SCHUMAKER K S, ZHU J K. Cell signaling during cold, drought, and salt stress[J]. Plant Cell, 2002,14:S165-S183.
[4] CHO S K, RYU M Y, SEO D H, et al. TheArabidopsisring E3 ubiquitin ligase atairp2 plays combinatory roles with atairp1 in abscisic acid-mediated drought stress responses[J]. Plant Physiol, 2011,157(4):2 240-2 257.
[5] VIERSTRA R D. The ubiquitin-26S proteasome system at the nexus of plant biology[J]. Nature Reviews Molecular Cell Biology, 2009,10(6):385-397.
[6] TYERS M, JORGENSEN P. Proteolysis and the cell cycle: with this ring I do thee destroy[J]. Current Opinion in Genetics & Development, 2000,10(1):54-64.
[7] STONE S L, HAUKSDOTTIR H, TROY A, et al. Functional analysis of the ring-type ubiquitin ligase family ofArabidopsis[J]. Plant Physiol, 2005,137(1):13-30.
[8] CHEN D H, MOLITOR A, LIU C L, et al. The Arabidopsis PRC1-like ring-finger proteins are necessary for repression of embryonic traits during vegetative growth[J]. Cell Res, 2010,20(12):1 332-1 344.
[9] QIN F, SAKUMA Y, TRAN L S P, et al.ArabidopsisDreb2A-interacting proteins function as ring E3 ligases and negatively regulate plant drought stress-responsive gene expression[J]. Plant Cell, 2008,20(6):1 693-1 707.
[10] KAPAZOGLOU A, TONDELLI A, PAPAEFTHIMIOU D, et al. Epigenetic chromatin modifiers in barley: Ⅳ. The study of barley polycomb group (PcG) genes during seed development and in response to external ABA[J]. Bmc Plant Biology, 2010:10.
[11] CZERMIN B, MELFI R, MCCABE D, et al. Drosophila enhancer of Zeste/ESC complexes have a histone H3 methyltransferase activity that marks chromosomal polycomb sites[J]. Cell, 2002,111(2):185-196.
[12] KUZMICHEV A, NISHIOKA K, ERDUMENT-BROMAGE H, et al. Histone methyltransferase activity associated with a human multiprotein complex containing the enhancer of zeste protein[J]. Genes Dev, 2002,16(22):2 893-2 905.
[13] DE NAPOLES M, MERMOUD J E, WAKAO R, et al. Polycomb group proteins ring1A/B link ubiquitylation of histone H2A to heritable gene silencing and X inactivation[J]. Developmental Cell, 2004,7(5):663-676.
[14] SHINOZAKI K, YAMAGUCHI-SHINOZAKI K. Gene networks involved in drought stress response and tolerance[J]. J Exp Bot, 2007,58(2):221-227.
[15] SANTNER A, ESTELLE M. Recent advances and emerging trends in plant hormone signalling[J]. Nature, 2009,459(7250):1 071-1 078.
[16] STONE S L, WILLIAMS L A, FARMAER L M, et al. Keep on going, a ring E3 ligase essential forArabidopsisgrowth and development, is involved in abscisic acid signaling[J]. Plant Cell, 2006,18(12):3 415-3 428.
[17] HUANG Y D, LI C Y, PATTISON D L, et al. Sugar-insensitive3, a ring E3 ligase, is a new player in plant sugar response[J]. Plant Physiol, 2010,152(4):1 889-1 900.
[18] CRAIG A, EWAN R, MESMAR J, et al. E3 ubiquitin ligases and plant innate immunity[J]. J Exp Bot, 2009,60(4):1 123-1 132.
[19] YAN J Q, WANG J, LI Q T, et al. AtCHIP, a U-box-containing E3 ubiquitin ligase, plays a critical role in temperature stress tolerance inArabidopsis[J]. Plant Physiol, 2003,132(2):861-869.
[20] SMIRNOVA O, STEPANENKO I, SHUMNYI V. The role of the COP1, SPA, and PIF proteins in plant photomorphogenesis[J]. Biology Bulletin Reviews, 2011,1(4):314-324.
[21] KANNO Y, JIKUMARU Y, HANADA A, et al. Comprehensive hormone profiling in developingArabidopsisseeds: Examination of the site of ABA biosynthesis, ABA transport and hormone interactions[J]. Plant and Cell Physiology, 2010,51(12):1 988-2 001.
[22] FREY A, GODIN B, BONNET M, et al. Maternal synthesis of abscisic acid controls seed development and yield inNicotianaplumbaginifolia[J]. Planta, 2004,218(6):958-964.
[23] NARUSAKA Y, NAKASHIMA K, SHINWARI Z K, et al. Interaction between two cis-acting elements, ABRE and DRE, in ABA-dependent expression ofArabidopsisrd29A gene in response to dehydration and high-salinity stresses[J]. The Plant Journal, 2003,34(2):137-148.
[24] YAMAGUCHI-SHINOZAKI K, SHINOZAKI K. Characterization of the expression of a desiccation-responsive rd29 gene ofArabidopsisthalianaand analysis of its promoter in transgenic plants[J]. Molecular and General Genetics MGG, 1993,236(2):331-340.

