Cd2+暴露对斑马鱼肝脏和卵巢抗氧化和免疫系统的影响及蓝LED光预暴露的保护作用
蔡荣, 郭赛男, 郑家浪
浙江海洋大学 海洋科学学院,舟山 316000
镉(Cd)是非必需金属元素,即使很低剂量也能对人类和动物产生巨大的毒性[1]。在正常的淡水中,Cd2+的浓度介于10到500 ng·L-1之间[2],然而,在我国的滦河流域Cd2+的浓度为1.120~4.474 μg·L-1 [3],在武汉东湖西南湖区为8 μg·L-1[4],在龙江重污染河段甚至达到800 μg·L-1[5]。目前,Cd已经成为局部水生生态系统的主要污染源。
Cd主要通过诱导氧化应激和免疫毒性对鱼类产生广泛的毒性影响[4]。因此,搜寻一种合适的抗氧化剂或者免疫增强剂以提高鱼类对金属的耐受性成为目前研究的热点。例如,水体中加入腐殖酸或者饲料添加肌醇可以明显增强鱼类抗氧化和免疫能力,缓解金属暴露诱导的损伤[7-8]。发光二极管(LED)具有能耗低、发出光单色性高和寿命长等优点。卢菁菁和李敦海[9]的研究表明,不同光质LED能影响念珠藻葛仙米生长并对生理生化产生显著影响。Villamizar等[10]暗示蓝LED光 (LDB) 能促进鲈鱼的生长和发育。其他的一些有关鱼类的研究证明,LDB能缓解饥饿或者高温诱导的氧化应激[11-12]。但是,到目前为止,没有任何研究报道LDB预暴露对随后金属暴露的正面影响。最近我们课题组的几项研究表明,蓝LEDs(LDB)不仅能促进鱼类的生长发育,而且能增强免疫力和缓解氧化应激[13-15]。因此,当前研究的假设是LDB预暴露可以缓解Cd暴露引起的氧化性损伤和免疫毒性。
鱼类依赖抗氧化防御系统和先天免疫系统应对环境威胁。在抗氧化系统中,超氧化物歧化酶(SOD)和过氧化氢酶(CAT)是其重要指标。在免疫系统中,环氧合酶-2 (COX-2)和诱导型一氧化氮合成酶(iNOS)都是炎症过程中的早期反应基因。一方面,这些基因受转录因子控制。例如,核转录相关因子2(Nrf2)和核转录因子-κB(NF-κB)调控着相关基因的转录,在金属诱导的氧化应激和免疫毒性过程中起着至关重要的作用[6, 16]。另一方面,这些转录因子又受其抑制子调节。抑制因子Kelch样ECH联合蛋白1(Keap1)和抑制蛋白激酶(IκBα)分别结合Nrf2 和 NF-κB,使其处于失活状态。当机体处于应激状态,Keap1和IκBα磷酸化导致抑制子从转录因子解离,进而诱导Nrf2和NF-κB的转录激活。本研究以斑马鱼为研究模型,分析急性Cd暴露对斑马鱼抗氧化系统和免疫反应的影响,评估蓝LEDs (LDB)预暴露可能的缓解作用,探讨可能的分子机制,为处理金属毒性提供策略措施,为鱼类健康养殖提供理论依据。
1 材料与方法(Materials and methods)
1.1 实验设计
AB系斑马鱼于室内预暴露2周。相同规格的斑马鱼(初始体重(0.19 ± 0.02) g, mean ± SEM)为2组,分别用白炽灯和LDB处理4周 (辐照度为0.9 W·m-2)。4周后每组再分为2个小组,分别在白炽灯下用0和0.97 mg·L-1Cd2+的水体处理4 d。共有4个处理,每个处理4个重复,每个重复80尾鱼,包括(1) 正常对照组;(2) Cd处理组:单独0.97 mg·L-1Cd2+暴露组;(3)LDB预处理组;(4) LDB预处理+Cd暴露组。Cd浓度和辐照度的设定参照我们近期的研究[6, 14]。试验期间每天早上7点换水100%,随后加入Cd的母液到理论浓度。斑马鱼每天按照体重的1%投喂量分别在早上8点、下午3点和晚上9点投喂。试验期间定期检测水质:水温(25.8 ± 0.4) ℃,光周期12 h L:12 h D,溶解氧(7.46 ± 0.34) mg·L-1,pH值7.49 ± 0.17。对照组的Cd浓度为0,Cd处理组水体Cd浓度为(0.97 ± 0.04) mg·L-1。采用火焰原子吸收光谱法(FAAS)测量金属浓度。
1.2 样品采集和匀浆液准备
取样之前,鱼禁食24 h,然后使用0.02%的MS-222麻醉。随机取鱼在冰袋上进行肝脏和卵巢样本采集。样本采集后立即放入冻存管中,然后用液氮速冻,最后置-80 ℃冰箱保存备用。
肝脏和卵巢组织用0.1 mol·L-1的磷酸盐缓冲溶液(PBS, pH 7.4)在玻璃匀浆器中冰浴匀浆。匀浆液离心(20 min、5 000 r·min-1、4 ℃)后取上清液,立即进行相关指标的测定。
1.3 抗氧化和免疫指标测定
采用黄嘌呤氧化酶法(羟胺法)测定Cu/Zn-SOD的活力;采用可见光分光光度计法测定CAT活力;采用精氨酸转化法测定iNOS活性;采用放射免疫法测定COX-2活性[17];采用硫代巴比妥酸法测定MDA 含量;采用硝酸还原酶法测定NO含量;采用考马斯亮兰法测定样品总蛋白。除COX-2外所有指标的测定采用南京建成试剂盒,具体操作按试剂盒说明书进行。实验采用4次生物学重复和2次技术性重复。
1.4 基因表达测定
组织总RNA的提取和cDNA第一链的合成参照我们最近的研究[16]。采用Applied Biosystems Prism 7500实时定量PCR仪,参照SYBR®Premix Ex TaqTM(Takara) 试剂盒说明书进行qRT-PCR。引物序列详见表1。每对引物经琼脂糖凝胶电泳检测只有单一条带,不同的引物在扩增效率上没有显著差异。以β-Actin和GAPDH几何平均数作为相对定量内参[16],采用2-ΔΔCt法分析数据,计算目的基因的相对表达量。
1.5 统计分析
本实验数据采用SPSS 19 统计分析软件进行方差分析和Duncan多重比较。数据进一步统计检验前用单样本Kolmogorov Smirnow检验和Levene方差齐次性检验分别确定其分布型和方差同质性。数据以平均值±标准差表示,显著度水平为0.05。
2 结果(Results)
2.1 LDB预暴露对Cd2+暴露斑马鱼MDA和NO含量的影响
与对照组相比,急性Cd2+暴露组MDA和NO的含量在肝脏和卵巢中显著升高(P < 0.05) (图1)。LDB预暴露组MDA和NO的含量在肝脏和卵巢中没有显著变化(P > 0.05)。在LDB预暴露+Cd2+暴露组中,MDA和NO的含量在卵巢中没有显著变化(P > 0.05),在肝脏中仍处于较高的水平(P < 0.05)。
2.2 抗氧化反应
与对照组相比,急性Cd2+暴露导致了肝脏Cu/Zn-SOD和CAT的酶活和表达的显著下降 (P < 0.05) (图2)。Cd2+暴露也导致卵巢CAT的酶活和表达以及Cu/Zn-SOD的表达显著上升(P < 0.05)。在LDB预暴露+Cd2+暴露组中,Cu/Zn-SOD和CAT在肝脏中的表达水平以及在卵巢中的表达和活性水平维持在正常水平(P > 0.05),并且在肝脏中的酶活显著上升(P < 0.05)。除了能诱导肝脏CAT的表达升高外(P < 0.05),LDB预暴露不能显著影响以上指标(P > 0.05)。
2.3 炎症反应
与对照组相比,急性Cd2+暴露导致了肝脏COX-2和iNOS的酶活和表达的显著上升 (P < 0.05),也导致卵巢COX-2和iNOS的酶活显著上升(P < 0.05),但并不显著影响卵巢COX-2和iNOS的表达(P > 0.05) (图2)。在LDB预暴露+Cd2+暴露组的肝脏中,COX-2和iNOS的表达恢复到对照水平(P > 0.05),但是COX-2和iNOS的酶活仍显著上升(P < 0.05)。在LDB预暴露+Cd2+暴露组的卵巢中,COX-2和iNOS的酶活恢复到对照水平(P > 0.05),但是COX-2的表达水平仍较高(P < 0.05)。除了能诱导肝脏COX-2的表达下降外(P < 0.05),LDB预暴露不能显著影响以上指标(P > 0.05)。
2.4 转录因子及其抑制因子的表达
与对照组相比,急性Cd2+暴露组肝脏中Nrf2、Keap1a、Keap1b、NF-κB和IκBαa的表达水平显著上升(图4A) (P < 0.05)。在Cd2+暴露组卵巢中Nrf2和NF-κB的表达增加,Keap1a和IκBαa的表达减少(图4B)(P < 0.05)。在LDB预暴露+Cd2+暴露组的肝脏中Nrf2、Keap1a、Keap1b、NF-κB和IκBαa的表达恢复到正常水平(P > 0.05),IκBαa的表达水平显著增加(P < 0.05)。在LDB预暴露+Cd2+暴露组的卵巢中Nrf2、Keap1a和NF-κB的表达恢复到正常水平(P > 0.05),Keap1b和IκBαa的表达水平显著增加(P < 0.05)。除减少肝脏NF-κB的表达和增加IκBαa的表达以及增加卵巢IκBαb的表达外(P < 0.05),LDB预暴露不能显著影响以上指标(P > 0.05)。
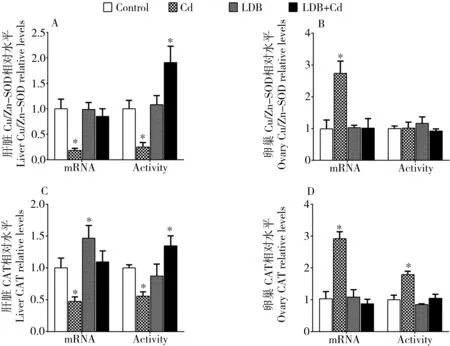
图2 LDB预暴露对急性Cd2+暴露斑马鱼肝脏和卵巢抗氧化酶活性和表达的影响注: *与对照相比, P < 0.05。Fig. 2 Effects of LDB acclimation on mRNA levels and activity of antioxidant enzymes in liver and ovary of zebrafish acutely exposed to Cd2+Note: * denotes significant differences (P<0.05) with control group.
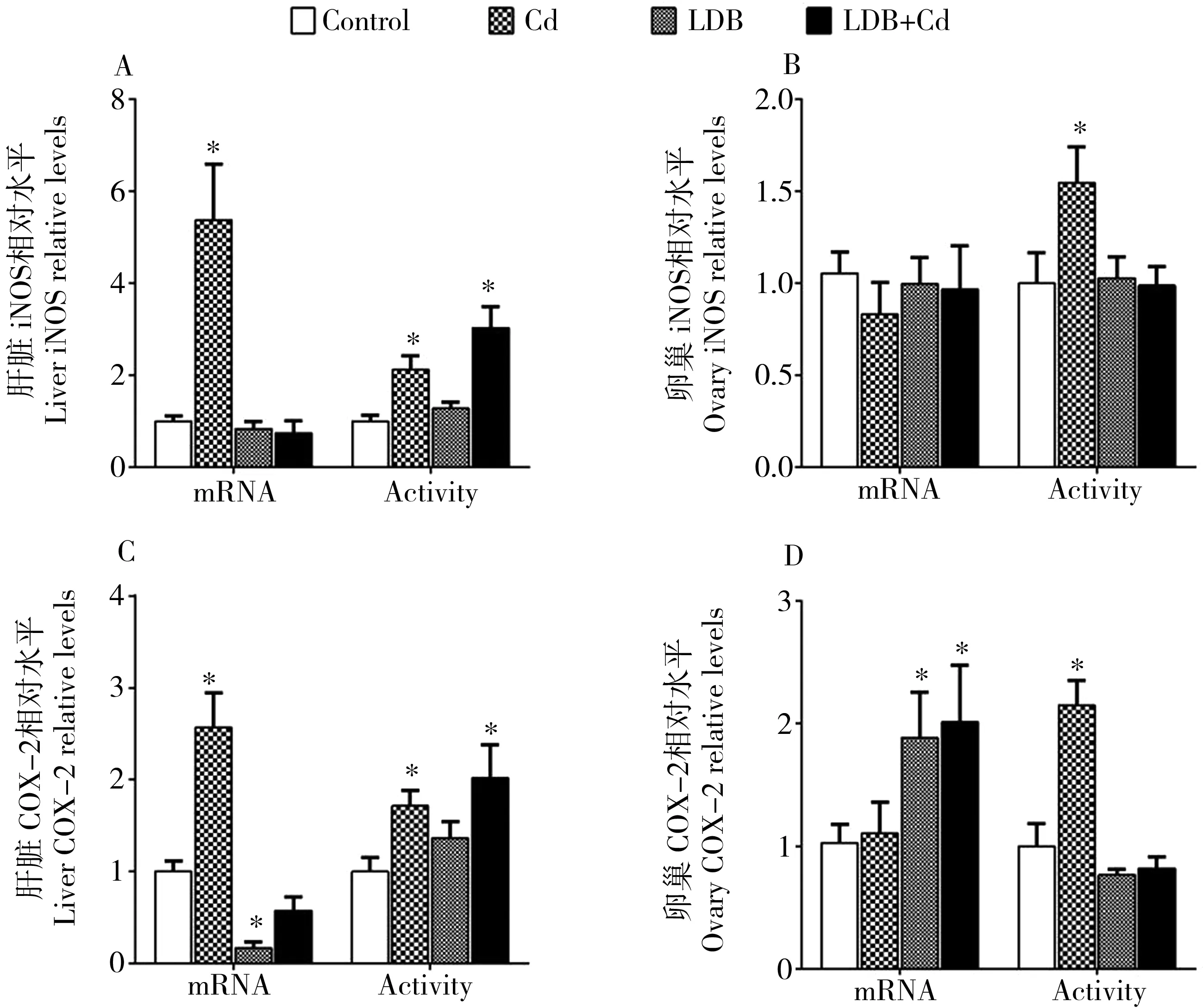
图3 LDB预暴露对急性Cd2+暴露斑马鱼肝脏和卵巢免疫相关酶活性和表达的影响注: *与对照相比, P < 0.05。Fig. 3 Effects of LDB acclimation on mRNA levels and activity of enzymes related to immunity in liver and ovary of zebrafish acutely exposed to Cd2+Note: * denotes significant differences (P<0.05) with control group.
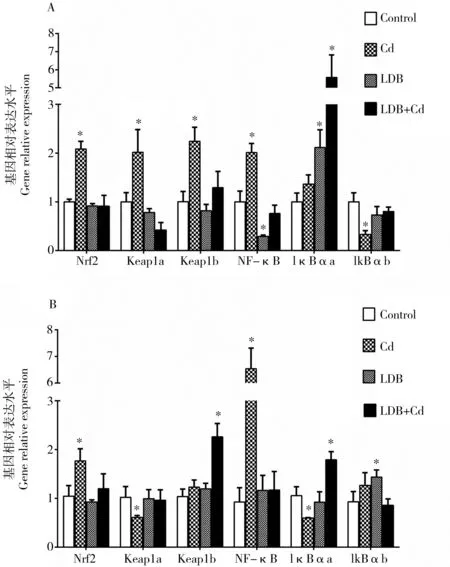
图4 LDB预暴露对急性Cd2+暴露斑马鱼肝脏(A)和卵巢(B)转录因子及其抑制因子表达的影响注:*与对照相比,P < 0.05。Fig. 4 Effects of LDB acclimation on mRNA levels of transcription factors and their inhibitors in liver (A) and ovary (B) of zebrafish acutely exposed to Cd2+Note: * denotes significant differences (P<0.05) with control group.
2.5 转录因子与其目的基因及其抑制因子表达的相关性
如表2所示,Nrf2的表达与其目的基因Cu/Zn-SOD和CAT的表达在卵巢中呈现显著的正相关性,但是在肝脏中呈现显著的负相关性。Nrf2的表达与其抑制因子Keap1a和Keap1b的表达在肝脏中呈现显著的正相关性。在肝脏中,NF-κB的表达与其目的基因iNOS和COX-2显示显著的正相关性,与IκBαb的表达呈现显著的负相关。在卵巢中,NF-κB与IκBαa的表达呈现显著的负相关。
3 讨论(Discussion)
Cd主要通过氧化应激和炎症反应对机体产生损伤。MDA是脂质过氧化的指标,反应了氧化应激诱导的细胞功能障碍[18-20]。NO作为鱼类免疫系统的一个重要信号分子,能诱导炎症反应并且在鱼类免疫系统损伤和细胞凋亡中起着重要作用[21]。本研究中,Cd暴露显著提高了斑马鱼肝脏和卵巢MDA和NO水平,表明Cd暴露导致了氧化性损伤和免疫毒性。该结果和我们近期的研究相符[6, 13, 16]。此外,我们的研究揭示了LDB预暴露具有缓解Cd毒性的作用。例如,在Cd暴露+ LDB预暴露组中,斑马鱼卵巢MDA和NO的含量恢复到正常水平。尽管在Cd暴露+ LDB预暴露组肝脏中MDA和NO含量相对于对照仍处于较高水平,但是绝大部分氧化应激和炎症反应相关基因的表达恢复到正常水平。当前的研究结果表明:早期LDB暴露的斑马鱼在后期能更好地抵御外源刺激物诱导的氧化应激和免疫毒性。Bayarri等[22]的研究表明蓝光能有效地诱导鱼类松果体和视网膜褪黑素的产生。产生的褪黑素经由血液循环到达肝脏和卵巢,可能缓解应激的负面影响[23]。另一方面,LDB预暴露很有可能导致了细胞防御机制的提前动员使之能迅速地响应应激反应[24]。
金属暴露会干扰线粒体的功能,产生更多的活性氧(ROS),进而形成氧化应激[25]。生物体在进化过程中形成了抗氧化防御系统以抵御ROS的损伤。在抗氧化系统中,SOD是一种重要的抗氧化性酶类,能够催化超氧阴离子发生歧化反应,解除超氧阴离子对细胞产生的毒害作用[26]。CAT是生物氧化中的末端氧化酶,能分解生物体某些代谢物需氧脱氢后所产生的对机体有害物质的一种酶,具有一定的解毒功能[27]。本研究中,卵巢Cu/Zn-SOD和CAT的表达以及CAT的活性在单独Cd暴露条件下显著上升,表明抗氧化系统被激活。相似地,斑马鱼胚胎在115 μg·L-1Cd的水体中暴露4 d,Cu/Zn-SOD和CAT的表达和Cu/Zn-SOD的活性增加[2],在570 μg·L-1Cd的水体中暴露4 h,CAT的表达升高[28]。Wang等[29]研究显示河豚在5 mg·L-1Cd的水体中暴露4 h,肝脏SOD活性增加。然而,抗氧化系统的激活可能并不足以清除过量的ROS,从而导致卵巢脂质过氧化水平显著增加。过量的ROS会增加氧化性损伤风险,反过来降低肝脏抗氧化酶的活性[30]。在Cd暴露+LDB预暴露条件下,Cu/Zn-SOD和CAT在肝脏中的表达以及在卵巢中的活性和表达都恢复到正常水平,在肝脏中的酶活大幅增加。以上的结果表明,LDB预暴露有助于缓和Cd诱导的氧化应激。氧化还原的平衡是机体行使正常免疫反应的前提[31]。iNOS和COX-2是炎症响应过程中的早期基因,被认为炎症标记物。在炎症反应模型中,iNOS和COX-2往往被协同诱导[32]。在Cd暴露组中,iNOS和COX-2在卵巢中的表达和酶活都显著上升,表明了Cd引起了强烈的炎症反应。LDB预暴露缓解了这些指标的过度增加,表明LDB预暴露具有抵抗Cd诱导的炎症的作用。相反,在Cd暴露+LDB预暴露组的肝脏中,iNOS和COX-2的酶活相对于对照组仍处于较高水平,暗示LDB预暴露在肝脏中并没有缓解炎症的作用。然而,我们注意到的是,LDB预暴露导致Cd诱导的iNOS和COX-2的表达恢复到正常水平。我们猜想从mRNA水平到蛋白质或者活性水平,存在一个时间效应。这可能导致尽管iNOS和COX-2的mRNA水平不变,但是它们的活性仍处于较高水平。
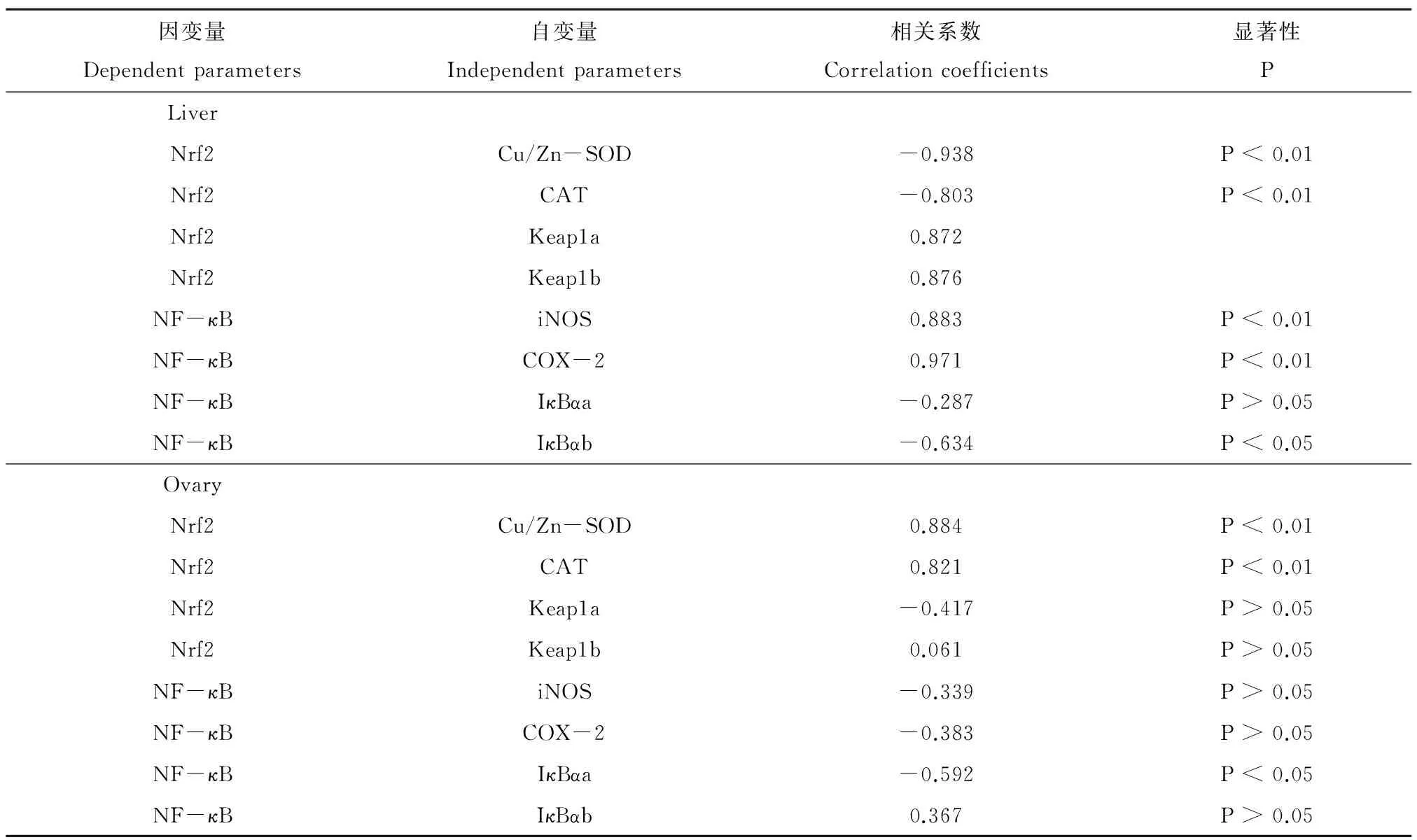
表2 转录因子与其目的基因及其抑制因子之间的相关性分析Table 2 Correlation coefficients between mRNA levels of transcription factors and their target genes and inhibitors
Cd的毒性和ROS的大量聚集有关。在Cd暴露组中,组织过高的脂质过氧化水平反映了大量ROS的形成。相应地,ROS含量的增加能通过ROS/Nrf2和ROS/NF-κB信号通路分别激活抗氧化和炎症反应[33-34]。在Cd暴露+LDB预暴露条件下,斑马鱼肝脏和卵巢中Nrf-2和NF-κB的表达水平恢复到正常水平,表明LDB预暴露对Cd诱导的炎症反应具有改善作用。在这过程中,卵巢Keap1b和IkBαa和肝脏IkBαa的表达水平升高。这将有助于形成反馈抑制从而控制Nrf2和NF-κB的丰度[35]。Nrf-2结合抗氧化基因的启动子区的ARE序列来激活下游基因转录[36]。NF-κB调控大量炎症反应相关基因的表达[37]。相应地,卵巢Nrf-2与其目的基因(Cu/Zn-SOD和CAT),肝脏NF-κB与其目的基因(iNOS和COX-2)均显著正相关。然而,我们也可以注意到,肝脏Nrf-2与其目的基因,卵巢NF-κB与其目的基因没有显著的相关性。这可能涉及组织特异性的调节机制。也有可能Nrf2或者NF-κB的蛋白活性而不是它们的转录水平决定了下游基因的诱导表达。在后续的研究过程中,我们将进一步验证我们的假设。
总之,当前的研究结果表明,急性Cd暴露诱导了斑马鱼肝脏和卵巢氧化应激和免疫毒性,而LDB预暴露可以起到缓解作用。这个过程可能涉及Nrf2和NF-κB信号通路及其诱导的下游基因表达和相关酶的活性。当前的研究将为处理环境因子导致鱼类的毒性提供新的预防措施,为促进鱼类的健康养殖提供新的思路和理论依据。
参考文献(References):
[1]史慧勤, 张利军, 苑晓燕, 等. 氯化镉暴露对斑马鱼幼鱼神经行为毒性作用[J]. 生态毒理学报, 2013, (8)8: 374-380
Shi H Q, Zhang L J, Yuan X Y, et al. Toxic effects of cadmium chloride exposure on neurobehavior of zebrafish larvae [J]. Asian Journal of Ecotoxicology, 2013, (8)8: 374-380 (in Chinese)
[2]Jin Y, Liu Z, Fang L, et al. Embryonic exposure to cadmium (II) and chromium (VI) induce behavioral alterations, oxidative stress and immunotoxicity in zebrafish (Danio rerio) [J]. Neurotoxicology and Teratology, 2015, 48: 9-17
[3]李永丽, 刘静玲. 滦河流域不同时空水环境重金属污染健康风险评价[J]. 农业环境科学学报, 2009, 28: 1177-1184
Li Y L, Liu J L. Health risk assessment on heavy metal pollution in the water environment of Luan River [J]. Journal of Agro-Environment Science, 2009, 28: 1177-1184 (in Chinese)
[4]何玲玲, 陈正洪. 武汉市水环境重金属污染的监测[J]. 环境科学与技术, 2007, 30: 41-44
He L L, Chen Z H. Monitoring of heavy metal pollution in water environment of Wuhan [J]. Environmental Science and Technology, 2007, 30: 41-44 (in Chinese)
[5]董璟琦, 张红振, 王金南, 等. 龙江河突发环境事件河流镉污染化学形态模拟[J]. 中国环境科学, 2015, 35: 3046-3052
Dong J Q, Zhang H Z, Wang J N, et al. Modeling of cadmium speciation in Longjiang River during an emergent environmental incident [J]. China Environmental Science, 2015, 35: 3046-3052 (in Chinese)
[6]Zheng J L, Yuan S S, Wu C W, et al. Acute exposure to waterborne cadmium induced oxidative stress and immunotoxicity in the brain, ovary and liver of zebrafish (Danio rerio) [J]. Aquatic Toxicology, 2016, 180: 36-44
[7]Meinelt T, Playle R C, Pietrock M, et al. Interaction of cadmium toxicity in embryos and larvae of zebrafish (Danio rerio) with calcium and humic substances [J]. Aquatic Toxicology, 2001, 54: 205-215
[8]Jiang W D, Liu Y, Jiang J, et al. Copper exposure induces toxicity to the antioxidant system via the destruction of Nrf2/ARE signaling and caspase-3-regulated DNA damage in fish muscle: Amelioration by myo-inositol [J]. Aquatic Toxicology, 2015, 159: 245-255
[9]卢菁菁, 李敦海. 发光二极管光质对念珠藻葛仙米生长及生理生化特性的影响[J]. 水生生物学报, 2014, 38: 257-261
Lu J J, Li D H. Effect of light-emitting diode light quality on the growth and physiological and biochemical characteristics of Nostoc sphaerpides [J]. Acta Hydrobiologica Sinica, 2014, 38: 257-261 (in Chinese)
[10]Villamizar N, Garcia-Alcazar A, Sanchez-Vazquez F. Effect of light spectrum and photoperiod on the growth, development and survival of European sea bass (Dicentrarchus labrax) larvae [J]. Aquaculture, 2009, 292: 80-86
[11]Choi C Y, Shin H S, Choi Y J, et al. Effect of LED light spectra on starvation-induced oxidative stress in the cinnamon clownfish Amphiprion melanopus [J]. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2012, 163: 357-363
[12]Kim N N, Choi Y J, Shin H S, et al. The effect of LED light spectra on antioxidant system by thermal stress in goldfish, Carassius auratus [J]. Molecular and Cellular Toxicology, 2014, 10: 47-58
[13]Yuan S S, Lv Z M, Zhu A Y, et al. Negative effect of chronic cadmium exposure on growth, histology, ultrastructure, antioxidant and innate immune responses in the liver of zebrafish: Preventive role of blue light emitting diodes [J]. Ecotoxicology and Environmental Safety, 2017, 139: 18-26
[14]Zheng J L, Yuan S S, Li W Y, et al. Positive and negative innate immune responses in zebrafish under light emitting diodes conditions [J]. Fish and Shellfish Immunology, 2016, 56: 382-387
[15]Yuan S S, Xu H Z, Liu L Q, et al. Different effects of blue and red light-emitting diodes on antioxidant responses in the liver and ovary of zebrafish Danio rerio [J]. Fish Physiology and Biochemistry, 2017, 43(2): 411-419
[16]Zheng J L, Yuan S S, Wu C W, et al. Chronic waterborne zinc and cadmium exposures induced different responses towards oxidative stress in the liver of zebrafish [J]. Aquatic Toxicology, 2016, 177: 261-268
[17]陈美珺, 梁统, 周克元. 原花青素对脂多糖诱导RAW264.7细胞COX-2酶活性、mRNA及蛋白表达的影响[J]. 药学学报, 2005, 40: 406-409
Chen M J, Liang T, Zhou K Y. Effect of proanthocyanidins on COX-2 enzyme activity and COX-2 mRNA/protein expression in LPS-induced RAW264.7 cells [J]. Acta Pharmaceutica Sinica, 2005, 40: 406-409 (in Chinese)
[18]Storey K B. Oxidative stress: Animal adaptations in nature [J]. Brazilian Journal of Medical and Biological Research, 1996, 29: 1715-1733
[19]邓思平, 赵云涛, 朱春华, 等. 镉对尖紫蛤抗氧化酶活性及脂质过氧化的影响[J]. 水生生物学报, 2012, 36: 689-695
Deng S P, Zhao Y T, Zhu C H, et al. Effect of cadmium on the antioxidant enzyme activity and lipid peroxidation in Sanguinolaria acuta [J]. Acta Hydrobiologica Sinica, 2012, 36: 689-695 (in Chinese)
[20]李涌泉, 王兰, 刘娜, 等. 镉对长江华溪蟹酶活性及脂质过氧化的影响[J]. 水生生物学报, 2008, 32: 374-379
Li Y Q, Wang L, Liu N, et al. Effects of cadmium on enzyme activity and lipid peroxidation in freshwater crab Sinopotamon yangtsekiense [J]. Acta Hydrobiological Sinica, 2008, 32: 374-379 (in Chinese)
[21]Jin Y, Zheng S, Fu Z. Embryonic exposure to cypermethrin induces apoptosis and immunotoxicity in zebrafish (Danio rerio) [J]. Fish and Shellfish Immunology, 2011, 30: 1049-1054
[22]Bayarri M, Madrid J, Sanchez-Vazquez F. Influence of light intensity, spectrum and orientation on sea bass plasma and ocular melatonin [J]. Journal of Pineal Research, 2002, 32: 34-40
[23]Lopez-Patino M A, Conde-Sieira M, Gesto M, et al. Melatonin partially minimizes the adverse stress effects in Senegalese sole (Solea senegalensis) [J]. Aquaculture, 2013, 388: 165-172
[24]Dolci G, Dias V, Roversi K, et al. Moderate hypoxia is able to minimize the manganese-induced toxicity in tissues of silver catfish (Rhamdia quelen) [J]. Ecotoxicology and Environmental Safety, 2013, 91: 103-109
[25]Zheng J L, Yuan S S, Shen B, et al. Organ-specific effects of low-dose zinc pre-exposure on high-dose zinc induced mitochondrial dysfunction in large yellow croaker Pseudosciaena crocea [J]. Fish Physiology and Biochemistry, 2017, 43: 653-661
[26]张玉平, 孙振中, 郝永梅. 镉对大弹涂鱼肝脏超氧化物歧化酶活性的影响[J]. 水产科学, 2008, 27: 79-81
Zhang Y P, Sun Z Z, Hao Y M. Effects of cadmium on superoxide dismutase activities in liver of bluespotted mudhopper Boleophthalmus pectinirostris [J]. Fisheries Science, 2008, 27: 79-81 (in Chinese)
[27]成嘉, 付贵红, 刘芳, 等. 重金属铅对鲫鱼乳酸脱氢酶和过氧化氢酶活性的影响[J]. 生命科学研究, 2006, 10: 372-376
Chen J, Fu G H, Liu F, et al. Effects of heavy metal lead (Pb2+) on activity of LDH and CAT in the black carp, Carassius auratus [J]. Life Science Research, 2006, 10: 372-376 (in Chinese)
[28]Hsu T, Huang K M, Tsai H T, et al. Cadmium(Cd)-induced oxidative stress down-regulates the gene expression of DNA mismatch recognition proteins MutS homolog 2 (MSH2) and MSH6 in zebrafish (Danio rerio) embryos [J]. Aquatic Toxicology, 2012, 126: 9-16
[29]Wang J, Zhu X, Huang X L, et al. Combined effects of cadmium and salinity on juvenile Takifugu obscurus: Cadmium moderates salinity tolerance; salinity decreases the toxicity of cadmium [J]. Scientific Reports, 2016, 6: 30968
[30]Zheng J L, Zhu Q L, Shen B, et al. Effects of starvation on lipid accumulation and antioxidant response in the right and left lobes of liver in large yellow croaker Pseudosciaena crocea [J]. Ecology Indicators, 2016, 66: 269-274
[31]Elvitigala D A S, Priyathilaka T T, Whang I, et al. A teleostan homolog of catalase from black rockfish (Sebastes schlegelii): Insights into functional roles in host antioxidant defense and expressional responses to septic conditions [J]. Fish and Shellfish Immunology, 2015, 44: 321-331
[32]Morales A I, Vicente-Sanchez C, Jerkic M, et al. Effect of quercetin on metallothionein, nitric oxide synthases and cyclooxygenase-2 expression on experimental chronic cadmium nephrotoxicity in rats [J]. Toxicology and Applied Pharmacology, 2006, 210: 128-135
[33]Hu Z, Yu F Gong P, et al. Subneurotoxic copper(II)-induced NF-κB-dependent microglial activation is associated with mitochondrial ROS [J]. Toxicology and Applied Pharmacology, 2014, 276: 95-103
[34]Wang L L, Liu T, Wang C, et al. Effects of atrazine and chlorpyrifos on the production of nitric oxide and expression of inducible nitric oxide synthase in the brain of common carp (Cyprinus carpio L.) [J]. Ecotoxicology and Environmental Safety, 2013, 93: 7-12
[35]Lee O H, Jain A K, Papusha V, et al. An auto-regulatory loop between stress sensors INrf2 and Nrf2 controls their cellular abundance [J]. Journal of Biological Chemistry, 2007, 282: 36412-36420
[36]Osburn W O, Kensler T W. Nrf2 signaling: An adaptive response pathway for protection against environmental toxic insults [J]. Mutation Research-Reviews in Mutation Research, 2008, 659: 31-39
[37]Liang Y, Zhou Y, Shen P. NF-kappaB and its regulation on the immune system [J]. Cellular and Molecular Immunology, 2004, 1: 343-35

