泌尿系草酸钙结石蛋白分析*
叶韬 ,王义兵 ,刘伟 ,罗晓明 ,王共先 ,黄学明 ,刘伟鹏 ,习海波 ,余月 ,傅斌 ,
(1、江西省九江市第一人民医院泌尿外科,九江 332000;2、南昌大学第二附属医院急诊科,南昌 330006;3、江西省妇幼保健院药剂科,南昌 330006;4、南昌大学第一附属医院泌尿外科,南昌 330006;5、江西省泌尿外科研究所,南昌 330006)
我国是泌尿系结石高发区之一,人群发病率高达1%-10%,其中25%患者需住院手术治疗[1]。泌尿系结石复发率非常高,10年复发率为50%,15年复发率更是高达75%[2]。因此探讨泌尿系结石的发病机制与防治方法具有重要意义。草酸钙结石在尿石病患者中最为常见,其形成机制尚不明确。结石内蛋白成分在结石形成过程中可能有重要作用,而且与泌尿系感染密切相关。本项目通过研究草酸钙结石蛋白成分特点,分析其与尿路感染最为常见的大肠杆菌的关系,旨在探索结石蛋白成分在结石形成中的作用与机制,进而为临床防治提供依据。
1 材料和方法
1.1实验材料随机收集20例患者的尿路结石标本。同时收集相应患者的尿液标本。大肠杆菌通过参考大肠杆菌培养操作手册进行培养获得。
1.2实验方法将收集到的结石样本,经过清洗、晾干、充分碾磨。全部患者的尿液标本行尿常规分析及中段尿细菌培养。采用LIIR-20型号的结石红外光谱分析系统分析结石的无机组成成分。利用本团队的专利方法(专利号为ZL201510017515.7)提取结石内蛋白质。采用细菌蛋白质提取试剂盒提取大肠杆菌蛋白。采用Bradford法测定蛋白浓度。采用SDS-SPAGE电泳纯化蛋白,银染染色和考马斯亮蓝染色分别鉴定结石和大肠杆菌内蛋白分子量大小。经液相色谱仪和质谱仪鉴定蛋白质成份,对质谱结果进行Gene Ontology等生物功能信息分析。
2 结果
2.1结石无机成分20例结石样本中有18例(90%)为草酸钙结石,其中含一水草酸钙成分的结石有17例;非草酸钙结石2例,分别为二水磷酸氢钙、碳酸磷灰石合并六水磷酸铵镁。
2.2尿常规及中段尿培养6例患者尿常规结果正常。14例(70%)患者尿白细胞增多,提示有泌尿道感染可能。草酸钙结石患者尿常规异常者13例(72%)。草酸钙结石患者尿培养结果阳性1例(5%),培养结果为大肠埃希氏菌。
2.3结石蛋白与大肠杆菌蛋白浓度测定所有结石样本均含有不同浓度的蛋白成分,草酸钙结石平均蛋白浓度为0.57μg/μL,其标准曲线见图1。合并感染的结石平均蛋白浓度为0.69μg/μL,非感染结石平均蛋白浓度为0.23μg/μL。采用t检验计算p值为0.01751,提示感染性结石和非感染结石浓度有显著性差异。大肠杆菌蛋白浓度为5.38μg/μL。
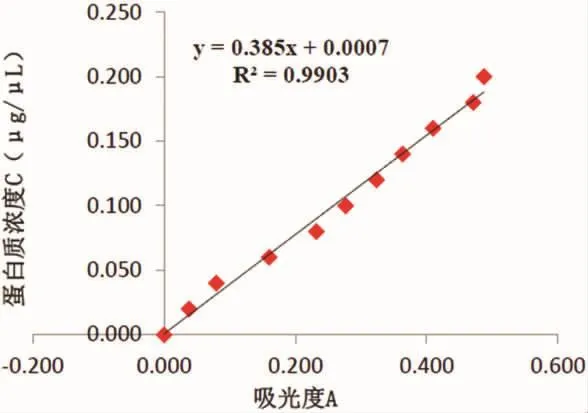
图1 尿蛋白浓度测定的标准曲线
2.4SDS-PAGE电泳草酸钙结石内蛋白有3至4条蛋白带,主要集中在25.0-35.0KDa和66.2-116.0KDa。相同成分结石条带集中区域大致相同 (图2)。大肠杆菌蛋白SDS-PAGE凝胶电泳显示蛋白成分主要集中在35.0KDa-116.0KDa,与草酸钙结石有部分重叠(图3)。

图2 草酸钙结石SDS-PAGE胶分离后行银染染色(M为蛋白marker)
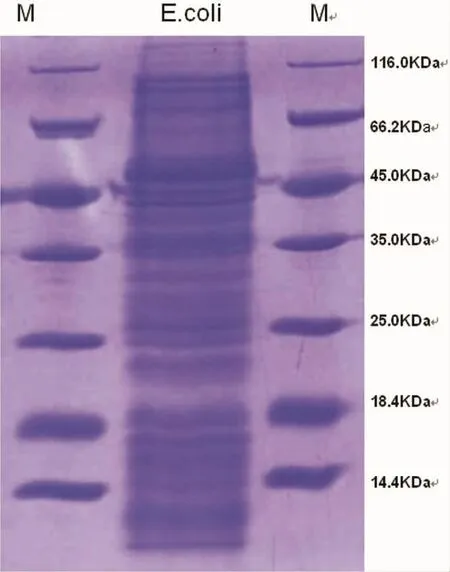
图3 大肠杆菌蛋白SDS-PAGE胶分离后考马斯亮蓝染色结果(M为蛋白marker)
2.5草酸钙结石蛋白质谱分析质谱结果共鉴定到88个蛋白,204个肽段。蛋白分子功能分析结果显示48.8%为结合功能蛋白,19.58%为催化活性蛋白,31.62%为其他各类蛋白。蛋白生物学过程分析结果显示8.14%的蛋白参与代谢,8.09%参与生物调控,10.34%和7.12%的蛋白分别参与细胞过程和应激。草酸钙结石蛋白成分中多为结合功能蛋白,提示其在结石基质形成过程中可能起主要作用。尿常规阳性的草酸钙结石与尿常规阴性的结石在质谱分析中结石蛋白成分无明显差异。
3 讨论
近年来,随着经济、环境与饮食结构等改变,我国泌尿系结石的发病率正逐年升高,尤其是南方地区更是严重,已严重影响了健康与社会经济发展[3]。泌尿系结石主要包含草酸钙结石、磷酸盐结石、尿酸结石、胱氨酸结石等。其中以草酸钙结石最为常见,约占80%以上[4]。本研究通过手术随机收集的20例结石样本中含草酸钙成分的结石样本有18例(90%),进一步验证了草酸钙结石的常见性。该类结石形成被认为主要与患者草酸和钙代谢异常相关[5,6]。
临床上泌尿系结石和尿路感染常合并存在,两者可能为互促因素[7]。国内众多研究发现革兰氏阴性菌是泌尿系感染的主要致病菌,其中大肠埃希氏菌最为常见[8,9]。Kaneko等研究发现肾结石内含抗菌肽、溶菌酶等蛋白质[10]。抗菌肽与溶菌酶是细菌感染灶周围相关的炎症细胞所分泌[11]。据此可推断泌尿系结石的形成与泌尿系细菌入侵有关,且结石内的蛋白质成份之一可能含有细菌蛋白质。本研究通过比对大肠埃希氏菌蛋白与草酸钙结石蛋白条带,发现两者间存在重叠,草酸钙结石的蛋白成分中可能含有大肠杆菌蛋白成分。
此外,本研究通过对草酸钙结石进行质谱分析,发现草酸钙肾结石内以结合功蛋白为主,其中包括炎症相关蛋白 (纤维连接蛋白、角蛋白、S100A8和S100A9等)。而纤维蛋白、炎症蛋白在草酸钙结石中存在,提示炎症与结石发病有一定联系。事实上,近些年来研究发现,结石成分或细菌感染介导的炎症-氧化应激反应会造成肾小管上皮细胞损伤,后者被认为是泌尿系结石形成的重要机制。Saeed等研究发现肾小管上皮细胞内吞草酸钙晶体可激活溶酶体释放大量活性酶和氧自由基,进而导致细胞损伤[12]。另有研究发现一水草酸钙晶体会明显抑制体外培养的肾小管上皮细胞的增殖;而且上皮细胞的凋亡率也会随着晶体浓度的升高而增加[13]。肾小管上皮细胞损伤后形成的细胞碎片可为结石形成时的成核过程提供核心;肾小管上皮细胞的损伤破坏了肾小管正常的重吸收和分泌功能,从而可能导致尿液中成石物质的过饱和;当上皮细胞存在损伤时,成石物质在较低浓度时即可粘附形成结晶[14]。研究发现活性氧(ROS)及其产生的氧化应激也参与了结石的形成[12,15]:结石晶体诱导上皮细胞产生 ROS,氧化应激启动P38 MAPK/JNK等信号通路,激活形成大量转录与生长因子,包括NFκB、TGFβ等,这些炎症介质会造成上皮细胞过氧化损伤与死亡。暴露的基底膜则有利于结晶的黏附与停留,进而在集合管末端形成肾钙斑 (Randall’splaques);同时,ROS诱导的炎症反应导致胶原蛋白沉积并形成纤维化。由此可见,炎症反应及其形成的诸多蛋白产物是结石形成的重要成因。
当今主流观点认为泌尿系结石的形成是环境、饮食、代谢、遗传与感染等共同作用的结果。除了前文述及的结石促成因素之外,在人体内存在着较多的结石抑制物:大分子物质(核糖核酸、黏液素、酸性黏多糖、肾钙素、蛋白多糖、骨桥蛋白(OPN)、非集合TH蛋白、间-α-胰蛋白酶抑制物等)和小分子物质(镁、枸橼酸盐、α-亚麻酸、焦磷酸盐等),均具有一定的抑制晶体形成的作用[16-18]。结石抑制物与结石促成物相互之间往往会由于机体功能异常而失衡,进而诱发结石形成。
本研究存在的局限性是随机获得的结石样本例数少,而且结石样本在储存、研磨及蛋白提取过程中受到环境的影响,这也可能造成有效蛋白成分的丢失,这也直接影响了蛋白电泳结果与质谱分析结果。
总之,国内外众多研究业已证实结石基质蛋白可通过多种机制参与泌尿系结石的形成。但是,不同结石成分的蛋白来源、是否有异同性、如何参与结石成核、生长、又是如何参与抑制结石形成的机制尚未阐明。泌尿系结石的形成机制观点众多,但可以肯定的是目前尚无任何一种机制能够完全解释结石的形成。泌尿系感染在结石的形成过程中肯定扮演重要的角色,但其具体的机制仍需要我们进一步研究及探讨。
[1]叶章群.泌尿系结石研究现况与展望[J].中华实验外科杂志,2005,22(3):261-262.
[2]Hussain M1,Rizvi SA,Askari H,et al.Management of stone disease:17 years experience of a stone clinic in a developing country[J].J Pak Med Assoc,2009,59(12):843-846.
[3]叶章群,刘浩然.泌尿系结石的诊断治疗进展[J].临床外科杂志,2017,25(2):85-88.
[4]李笑然,岳中瑾,裴薇,等.4种大鼠肾草酸钙结石模型的比较[J].现代泌尿外科杂志,2013,18(4):329-331,338.
[5]Hayatdavoudi P,Khajavi Rad A,Rajaei Z,et al.Renal injury,nephrolithiasis and Nigella sativa:A mini review[J].Avicenna J Phytomed,2016,6(1):1-8.
[6]Prezioso D,Strazzullo P,Lotti T,et al.Dietary treatment of urinary risk factors for renal stone formation.A review of CLU Working Group[J].Arch Ital Urol Androl,2015,87(2):105-120.
[7]罗湘蓉,郑朋玉,袁军,等.泌尿道结石患者尿道感染病原菌分布及耐药性分析[J].中国医科大学学报,2015,44(11):1031-1034.
[8]廖晚珍,胡雪飞,贾坤茹,等.江西省2009年细菌耐药监测调查分析[J].江西医药,2010,45(9):860-864.
[9]罗晓明,李军华,傅斌.泌尿系感染多重耐药性致病菌耐药分析及治疗[J].江西医药,2015,50(4):366-368.
[10]Kaneko K,Yamanobe T,Onoda M,et al.Analysis of urinary calculi obtained from a patient with idiopathic hypouricemia using micro area x-ray diffractometry and LC-MS[J].Urol Res,2005,33(6):415-21.
[11]Clark RI1,Tan SW,Péan CB,et al.MEF2 is an in vivo immunemetabolic switch[J].Cell,2013,155(2):435-447.
[12]Khan SR.Reactive oxygen species,inflammation and calcium oxalate nephrolithiasis[J].Transl Androl Urol,2014,3(3):256-276.
[13]吴浩然,胡波,施国伟.草酸钙结晶-肾小管细胞损伤机制研究进展[J].临床泌尿外科杂志,2014,29(4):365-367.
[14]ThamilselvanV,MenonM,ThamilselvanS.Oxalateat physiological urine concentrations induces oxidative injury in renal epithelial cells:effect of α-tocopherol and ascorbic acid[J].BJU Int,2014,114(1):140-150.
[15]Okumura N,Tsujihata M,Momohara C,et al.Diversity in protein profiles of individual calcium oxalate kidney stones[J].PLoS One,2013,8(7):e68624.
[16]ChutipongtanateS,ChaiyaritS,ThongboonkerdV.Citrate,not phosphate,can dissolve calcium oxalatemonohydrate crystals and detach these crystals from renal tubular cells[J].Eur J Pharmacol,2012,689(1-3):219-225.
[17]Krieger NS,Asplin JR,et al.Effect of potassium citrate on calcium phosphate stones in a model of hypercalciuria[J].J Am Soc Nephrol,2015,26(12):3001-3008.
[18]王施广,王振,王养民,等.枸杞、泽泻及其混合物对大鼠泌尿系结石形成的影响[J].解放军医药杂志,2014,26(9):8-12.

