甘薯羽状斑驳病毒RT-LAMP快速检测方法的建立
姜珊珊,冯佳,张眉,王升吉,辛志梅,吴斌,辛相启
甘薯羽状斑驳病毒RT-LAMP快速检测方法的建立
姜珊珊,冯佳,张眉,王升吉,辛志梅,吴斌,辛相启
(山东省农业科学院植物保护研究所植物病毒学实验室,济南 250100)
【】甘薯羽状斑驳病毒(,SPFMV)侵染甘薯造成重要危害,本研究旨在利用反转录环介导等温扩增技术(reverse transcription loop-mediated isothermal amplification,RT-LAMP)建立一种快速、高效检测SPFMV的方法。【】从GenBank上获得SPFMV外壳蛋白(coat protein,CP)基因的核苷酸序列,利用Primer Explorer V4设计4条RT-LAMP特异性引物SPFMV-FIP(5′-TAAGCGCGGCTGCC TTCATC-CATTCAACCACCCCTGCA-3′)、SPFMV-BIP(5′-TCGGTTGTTTGGTTTGGACGGA-ATCAGTTGTCGTGTGCCTC-3′)、SPFMV-F3(5′-GAGTCTTGCGCGATATGCA-3′)和SPFMV-B3(5′-ACCCCTCATTCCTAAGAGGT-3′),同时设计2条反转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)的特异性引物SPFMV-F(5′-TCTAATGAGAACACTGAA TT-3′)和SPFMV-R(5′-TTGCACACCCCTCATTCCTAAG-3′)。分别设置F3/B3﹕FIP/BIP引物浓度比(1﹕1、1﹕2、1﹕4、1﹕6、1﹕8和1﹕10),dNTPs浓度梯度(0.025、0.125、0.225、0.325、0.425、0.525、0.625、0.725和0.825 mmol·L-1),Betaine浓度梯度(0.4、0.7、1.0、1.3和1.6 mol·L-1),反应温度(59、61、63、65、67和69℃)和反应时间(20、30、40、50、60、70、80和90 min),对RT-LAMP反应体系各条件进行优化,确定最佳反应体系。通过测序及酶切对RT-LAMP产物进行鉴定。以携带SPFMV、甘薯C病毒(C,SPVC)、甘薯褪绿矮化病毒(,SPCSV)、甘薯病毒2(2,SPV2)、甘薯潜隐病毒(,SPLV)、甘薯G病毒(G,SPVG)、甘薯褪绿斑病毒(,SPCFV)和健康甘薯叶片的总RNA为模板,分别进行RT-LAMP和RT-PCR特异性检测;带有SPFMV的甘薯总RNA进行10倍梯度稀释,以RNA原液、10-1、10-2、10-3、10-4、10-5、10-6和10-7稀释液为模板进行RT-LAMP和RT-PCR灵敏度测定。最后利用优化的RT-LAMP体系对山东省多地采集的SPFMV疑似病样进行检测,加入SYBR green I进行可视化检测。【】建立了SPFMV的RT-LAMP快速特异性检测方法,优化的反应体系:引物SPFMV-FIP/SPFMV-BIP为0.8 µmol·L-1,SPFMV-F3/SPFMV-B3为0.2 µmol·L-1,dNTPs为0.325 mmol·L-1,Betaine为1 mol·L-1;65℃反应70 min。特异性试验显示本研究建立的RT-LAMP只对携带SPFMV的RNA能够扩增出典型的梯状条带。RT-LAMP最低可检测的RNA浓度为121.6×10-4ng·μL-1,而RT-PCR最低能检测的RNA浓度为121.6×10-3ng·μL-1,表明RT-LAMP的灵敏度比RT-PCR高10倍。田间样品检测,RT-LAMP扩增结果与可视化检测结果一致,表明本研究建立的RT-LAMP快速检测方法可有效应用到SPFMV的田间检测。【】建立的RT-LAMP快速检测方法灵敏度高、特异性好,适用于SPFMV的田间快速检测。
甘薯;甘薯羽状斑驳病毒;反转录环介导等温扩增技术;检测
0 引言
【研究意义】甘薯()是继小麦、水稻、玉米、马铃薯、大麦和木薯之后的世界第七大粮食作物,同时也是重要的饲料和轻工业原料[1-3]。病毒病是威胁甘薯生产的重要病害,全世界因病毒病造成的甘薯损失每年高达30%—50%,在中国每年造成的经济损失达40亿元[4-5]。甘薯羽状斑驳病毒(,SPFMV)是甘薯上的重要病毒,属于马铃薯Y病毒属()成员,通过汁液或蚜虫以非持久性方式传播,在世界主要甘薯产区几乎均有发现[6-8]。SPFMV可侵染甘薯等8种旋花科植物,在植株不同的生长时期表现的症状也不相同,严重危害甘薯的产量和品质[9]。近年来,SPFMV在中国多省(市)均有发生,且分布地区呈逐年扩展的趋势[2-3,9]。因此建立一种简单、快速的检测方法对SPFMV的早期预警以及了解发病规律具有重要意义。【前人研究进展】2010年,张业辉等[10]建立了包括SPFMV在内的3种甘薯病毒的多重PCR检测方法,随后针对SPFMV的ELISA[11]、RT-PCR[2,11]、荧光定量RT-PCR[12-13]、反向斑点杂交[14]等检测方法被逐步建立。笔者实验室前期已通过生物学鉴定、电镜观察及RT-PCR等多种技术对山东地区的SPFMV等多种甘薯病毒进行了检测[2]。以上几种检测方法均为了解SPFMV的田间发病情况提供了技术保证。反转录环介导等温扩增技术(reverse transcription loop-mediated isothermal amplification,RT-LAMP)是2000年由Notomi 开发的一种新型核酸扩增方法,该技术针对目的序列设计4条引物,特异性识别6个序列区,利用DNA链置换聚合酶(BstDNA polymerase)在60—65℃恒温条件下进行高效扩增[15]。RT-LAMP已广泛应用于人类[16-17]、动物[18-19]、植物[20-30]病原菌的检测中,在粮食[20-22,27]、蔬菜[23-26]、果树[28]以及经济作物[29-30]的病毒病害检测工作中发挥了重要作用。乔奇等[27]建立了针对甘薯褪绿矮化病毒(,SPCSV)的RT-LAMP检测技术。迄今国内外还未见利用该技术检测SPFMV的报道。【本研究切入点】现有RT-PCR和荧光定量PCR等分子检测技术虽然已有高特异性和灵敏度的特点,但需要特定的仪器和专业的实验人员来完成,不适用基层检测。血清学检测需要特异性抗血清,制作过程繁杂、成本昂贵,易出现假阳性。生物学鉴定和电镜观察费时费工,需要检测样品中病毒含量高。RT-LAMP作为一种新型的检测技术,具有简便、快速、特异等特点,不需要对模板进行热变性,可在等温条件下进行,短时间内即可获得试验结果[15]。基于此,本研究建立针对SPFMV的RT-LAMP快速检测技术。【拟解决的关键问题】对SPFMV RT-LAMP检测技术的各反应条件进行优化,验证RT-LAMP扩增的特异性和灵敏度,建立一种SPFMV的新型、快速、灵敏的检测技术,为甘薯病毒病害的监测防控提供技术支持。
1 材料与方法
试验于2016年5月至2017年9月在山东省农业科学院植物保护研究所植物病毒学实验室完成。
1.1 材料
1.1.1 植物材料 从山东临沂地区甘薯苗床采集具有典型病毒病症状的甘薯样品,种植于防虫温室中;经RT-PCR检测确定甘薯病毒种类后,置于-80℃保存备用。选取经RT-PCR检测不含病毒的甘薯脱毒苗作为阴性对照。
1.1.2 主要试剂 TransZol Plant多糖植物总RNA提取试剂盒、dNTPs购自北京全式金生物技术有限公司;HiScript®II 1st Stand cDNA Synthesis Kit购自诺唯赞生物公司;DL 2000 DNA Marker、M-MuLV反转录酶、RNase酶抑制剂购自TaKaRa公司;2×Es Taq MasterMix(Dye)购自康为世纪生物公司;Bst DNA大片段聚合酶、10×Thermopol Reaction Buffer、TⅠ和Ⅰ购自NEB,特异性引物由生工生物工程(上海)股份有限公司合成;SYBR Green I核酸染料购自Solarbio公司;其他生化试剂及普通化学试剂均为进口或国产分析纯。
1.2 方法
1.2.1 引物设计 根据GenBank中SPFMV的CP基因序列(登录号:FJ155666),利用LAMP引物设计软件Primer Explorer V4设计RT-LAMP扩增引物SPFMV-F3、SPFMV-B3、SPFMV-FIP、SPFMV-BIP共4条;同时利用DNAMAN设计RT-PCR扩增引物SPFMV-F和SPFMV-R共2条,引物序列见表1。
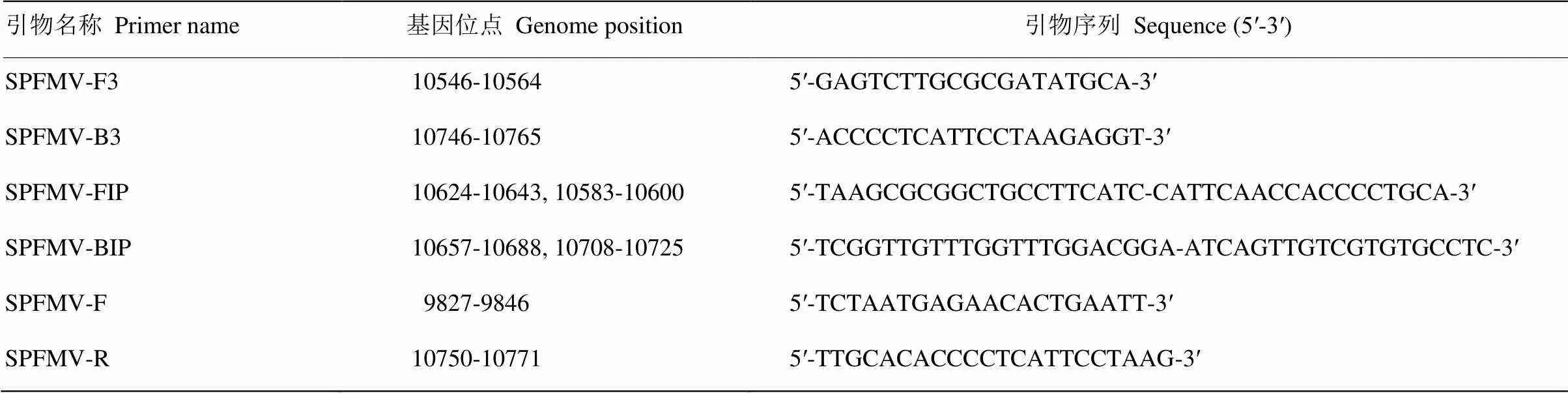
表1 RT-LAMP和RT-PCR特异性检测SPFMV的引物
1.2.2 总RNA提取及cDNA合成 称取甘薯样品叶片约0.1 g,液氮冷冻后迅速研磨,按TransZol Plant多糖植物总RNA提取试剂盒说明书提取叶片总RNA,保存于-80℃备用。按照HiScript®II 1st Stand cDNA Synthesis Kit说明书,以RNA为模板合成cDNA,保存于-20℃备用。
1.2.3 RT-PCR检测 RT-PCR扩增体系:2×Es Taq MasterMix 7.5 µL,SPFMV-F/R(10 µmol·L-1)引物各0.2 µL,cDNA 0.5 µL,ddH2O补足总体积至15 µL。反应条件:预变性94℃3 min,变性94℃30 s,退火50℃ 30 s,延伸72℃1 min,循环35次,终延伸72℃10 min。阴性样品叶片总RNA反转录的cDNA作为阴性对照的模板,ddH2O为空白对照模板。扩增产物经琼脂糖凝胶电泳检测。
1.2.4 RT-LAMP反应条件优化和检测体系的建立 RT-LAMP反应体系:SPFMV-FIP和SPFMV-BIP引物各1.2 µmol·L-1,SPFMV-F3和SPFMV-B3引物各0.2 µmol·L-1,dNTPs 0.125 mmol·L-1,Betaine 1 mol·L-1,1×Thermo Polreaction buffer,RNA酶抑制剂40 U,Bst DNA polymerase 8 U,M-MLV 200 U;RNA模板1 µL,补充ddH2O至25 µL(RNA模板为经RT-PCR检测及测序鉴定的感染SPFMV甘薯叶片总RNA)。RT-LAMP 反应条件:65℃ 1 h,85℃5 min。健康甘薯叶片总RNA反转录的cDNA作为阴性对照的模板,ddH2O为空白对照模板。设置SPFMV F3/B3﹕FIP/BIP引物浓度比梯度(1﹕1、1﹕2、1﹕4、1﹕6、1﹕8和1﹕10),dNTPs浓度梯度(0.025、0.125、0.225、0.325、0.425、0.525、0.625、0.725和0.825 mmol·L-1),Betaine浓度梯度(0.4、0.7、1.0、1.3和1.6 mol·L-1),不同的反应温度(59、61、63、65、67和69℃)和反应时间(20、30、40、50、60、70、80和90 min)。利用琼脂糖凝胶电泳检测反应产物。
1.2.5 RT-LAMP产物鉴定 将RT-LAMP产物经琼脂糖电泳分离后,切取大小200 bp左右的条带,回收纯化后连接于pMD18-T载体,连接产物转化大肠杆菌感受态DH5,PCR鉴定后送阳性克隆到进行测序。利用BLAST对测序结果与GenBank已报道序列进行比对。
用DNAMAN软件分析RT-LAMP扩增片段序列,选用Ⅰ(GAATGCN½)和TⅠ(C½TTAAG)进行酶切鉴定,Ⅰ理论酶切片段大小为97和102 bp,TⅠ理论酶切片段大小为75和124 bp。利用苯酚和异丙醇回收纯化RT-LAMP扩增产物,取1μg扩增产物分别进行TⅠ和Ⅰ单酶切,反应体系参照酶试剂盒说明书。取20 µL酶切产物用3%琼脂糖凝胶电泳进行分析。
1.2.6 RT-LAMP特异性、灵敏度测定及荧光染料检测RT-LAMP产物 以分别携带SPFMV、甘薯C病毒(C,SPVC)、SPCSV、甘薯病毒2(2,SPV2)、甘薯潜隐病毒(,SPLV)、甘薯G病毒(G,SPVG)和甘薯褪绿斑病毒(,SPCFV)的甘薯叶片总RNA为模板,利用优化好的反应体系进行RT-LAMP扩增和电泳检测,并与RT-PCR扩增结果进行对比。
将感染SPFMV的甘薯叶片总RNA用无RNA酶的水分别进行10-1、10-2、10-3、10-4、10-5、10-6和10-7的倍比稀释,以稀释后的RNA作为模板进行RT-LAMP和RT-PCR灵敏度对比试验,琼脂糖凝胶电泳检测扩增产物。
1.2.7 RT-LAMP方法的应用 提取从山东省采集的疑似SPFMV甘薯植株叶片总RNA,分别用优化后的RT-LAMP方法和普通RT-PCR方法进行检测,琼脂糖凝胶电泳分别检测反应产物。向RT-LAMP反应产物中加入0.1 µL SYBR green I 核酸染料,直接观察检测结果,阳性为绿色,阴性为橙色[27-28]。
2 结果
2.1 RT-LAMP反应体系优化
为了建立最优的RT-LAMP检测体系,对引物浓度、dNTPs浓度、Betaine浓度、反应温度和反应时间进行优化。引物优化结果显示,SPFMVF3/B3与FIP/BIP的浓度比例在1﹕4、1﹕6、1﹕8时能检测到条带,1﹕4时条带最亮,即F3/B3和FIP/BIP的引物浓度分别为0.2和0.8 µmol·L-1(图1-A)。对dNTPs浓度进行调整,结果显示dNTPs浓度为0.125—0.525mmol·L-1时可检测到条带,其中以0.325和0.425 mmol·L-1效果最佳,本着节俭成本的原则确定dNTPs浓度为0.325mmol·L-1(图1-B)。进一步设置不同的Betaine浓度,结果表明在0.4、0.7、1.0和1.3 mol·L-1时均能检测到条带,浓度为1.0 mol·L-1时,扩增效果最佳(图1-C)。设置不同的反应温度,在59—67℃均有条带,65℃时条带最为清晰(图1-D)。最后对反应时间进行优化,反应持续40 min时可观察到扩增条带,70 min时扩增条带最亮(图1-E)。综上,最终确定SPFMV最优的RT-LAMP检测体系为SPFMV-FIP和SPFMV-BIP引物各0.8 µmol·L-1,SPFMV-F3和SPFMV-B3引物各0.2 µmol·L-1,dNTPs 0.325 mmol·L-1,Betaine 1 mol·L-1。RT-LAMP反应条件为65℃70 min,85℃5 min。
2.2 RT-LAMP产物鉴定
将200 bp左右的RT-LAMP扩增条带进行测序,并与GenBank已报道序列进行比对。结果显示,序列与SPFMV(登录号AF015540.1)的核苷酸序列同源性为99%,说明本体系扩增序列为SPFMV的基因序列。RT-LAMP产物酶切结果显示,Ⅰ酶切产生条带为97和102 bp,TⅠ酶切产生的条带为75和124 bp(图2),与理论值相符,进一步证明该体系扩增产物为SPFMV CP基因序列。
M:DL2000 DNA marker;1、2:阴性对照和空白对照Negative control and blank control。A:F3/B3和FIP/BIP引物浓度比The ratio of primer concentration, 3-8: 1﹕1 (0.2 µmol·L-1﹕0.2 µmol·L-1), 1﹕2 (0.2 µmol·L-1﹕0.4 µmol·L-1), 1﹕4 (0.2 µmol·L-1﹕0.8 µmol·L-1), 1﹕6 (0.2 µmol·L-1﹕1.2 µmol·L-1), 1﹕8 (0.2 µmol·L-1﹕1.6 µmol·L-1), 1﹕10 (0.2 µmol·L-1﹕2.0 µmol·L-1);B:dNTPs浓度梯度The gradient of dNTPs concentration,3-11: 0.025, 0.125, 0.225, 0.325, 0.425, 0.525, 0.625, 0.725, 0.825 mmol·L-1;C:Betaine浓度梯度The gradient of Betaine concentration,3-7: 0.4, 0.7, 1.0, 1.3, 1.6 mol·L-1;D:温度梯度The gradient of temperature,3-8: 59, 61, 63, 65, 67, 69℃;E:时间梯度The gradient of time,3-10:20, 30, 40, 50, 60, 70, 80, 90 min
2.3 特异性检测
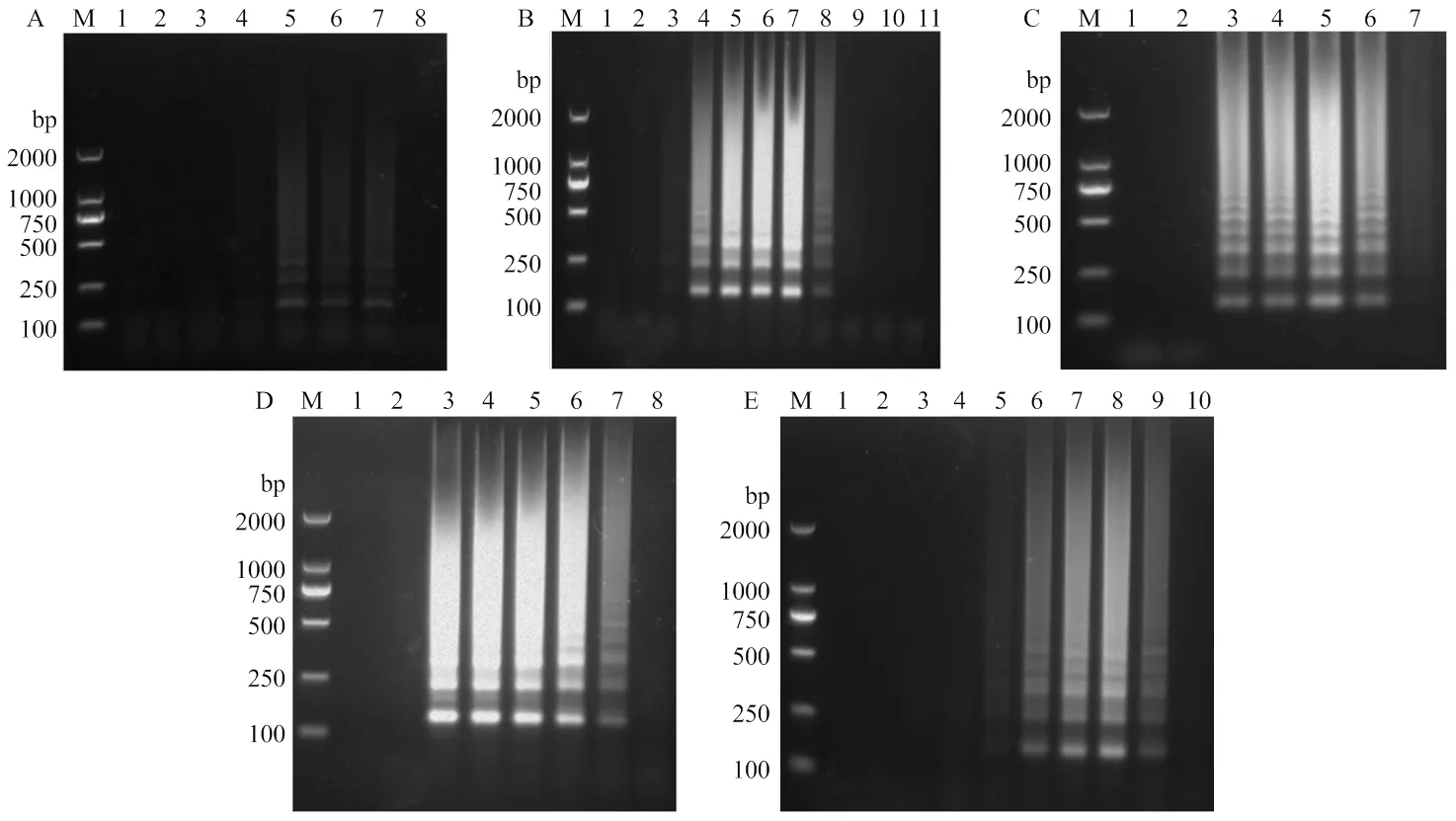
以分别含有SPVC、SPCSV、SPV2、SPLV、SPVG、SPCFV以及SPFMV病毒甘薯叶片的RNA为模板,利用普通RT-PCR和2.1优化的RT-LAMP两种方法进行扩增。结果显示,RT-LAMP和RT-PCR的扩增结果一致,并且只能在携带SPFMV的甘薯样品中扩增出条带,而携带其他病毒的甘薯样品皆没有扩增到条带(图3),表明建立的SPFMV RT-LAMP检测体系具有很好的特异性。
2.4 RT-LAMP与RT-PCR灵敏度比较
提取感染SPFMV甘薯叶片总RNA,用紫外分光光度计测定其浓度为121.6 ng·L-1。将RNA按10倍梯度进行稀释,分别进行RT-LAMP和RT-PCR扩增。结果显示,RT-LAMP在RNA原液、10-1—10-4稀释液为模板下可扩增到条带,即本研究建立的SPFMV RT-LAMP方法检测到目标病毒的叶片RNA浓度最低为121.6×10-4ng·μL-1(图4-A),而RT-PCR能在RNA原液、10-1—10-3稀释液模板中扩增到条带,即RT-PCR方法检测到目的病毒的叶片RNA浓度最低为121.6× 10-3ng·μL-1(图4-B)。表明本研究建立的RT-LAMP方法较普通RT-PCR方法检测灵敏度高10倍。
2.5 RT-LAMP技术的田间检测应用
对采自山东的甘薯疑似病株分别进行RT-LAMP和RT-PCR检测,结果显示,12份样品中(部分结果)利用RT-LAMP检测方法检测出7份SPFMV阳性样品(图5-B),与RT-PCR检测结果一致(图5-A)。往RT-LAMP产物中加入SYVR green I核酸荧光染料,电泳检测有条带的样品迅速变为绿色,无条带的样品为橙色(图5-C),与RT-LAMP和RT-PCR检测结果一致。综上,表明本研究建立的RT-LAMP检测方法可用于田间甘薯样品SPFMV检测。

M:DL2000 DNA marker;1、2:阴性对照和空白对照Negative control and blank control;3-9: SPFMV, SPVC, SPCSV, SPV2, SPLV, SPVG, SPCFV
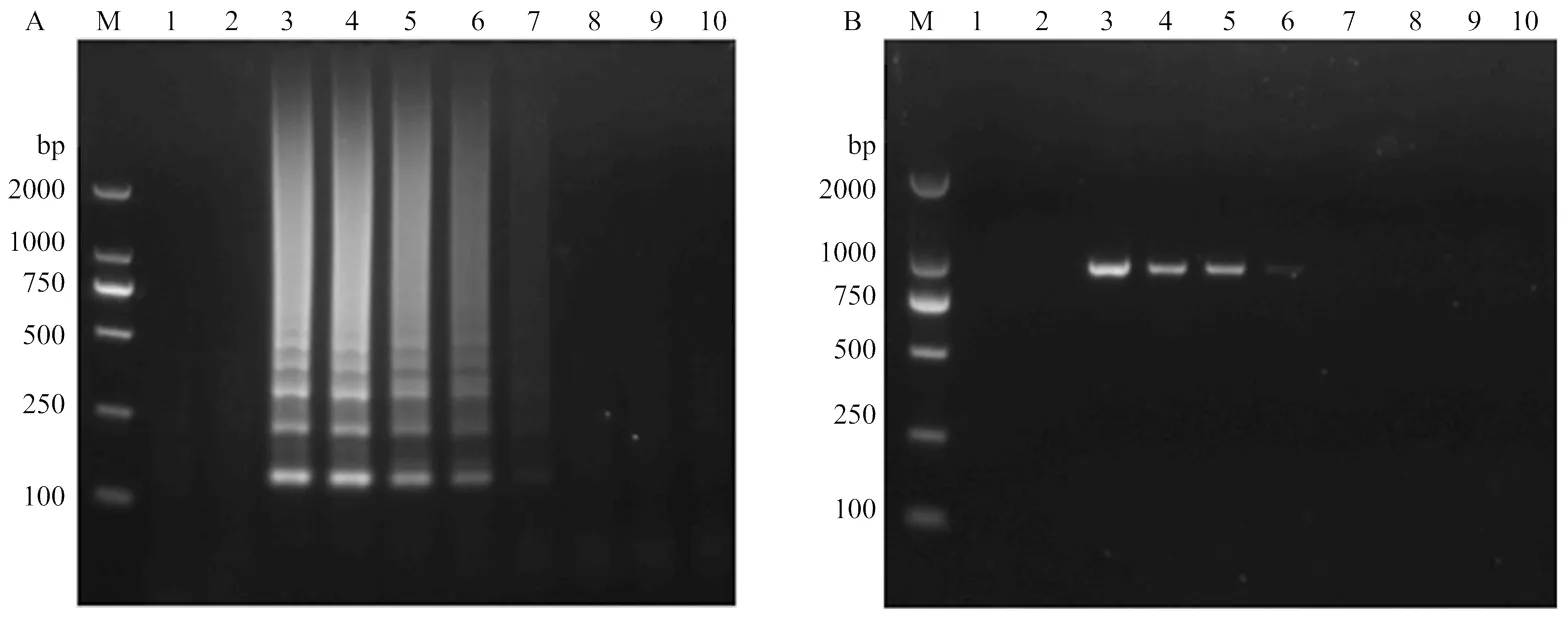
M:DL2000 DNA marker;1、2:阴性对照和空白对照Negative control and blank control,3—10:RNA浓度分别为121.6、121.6×10-1、121.6×10-2、121.6×10-3、121.6×10-4、121.6×10-5、121.6×10-6和121.6×10-7 ng·μL-1 The concentration of RNA is 121.6, 121.6×10-1, 121.6×10-2, 121.6×10-3, 121.6×10-4, 121.6×10-5, 121.6×10-6 and 121.6×10-7 ng·μL-1, respectively
3 讨论
SPFMV是全球影响甘薯的最具破坏性的病毒之一,其寄主植物广泛,对甘薯的危害尤其严重[1-9]。由于甘薯主要为营养繁殖,容易造成病毒的逐年积累,造成甘薯产量降低,品质变劣和种性退化,严重危害甘薯产业发展。近年来地域间种质资源的频繁交流,也促使甘薯病毒病发生扩散[1-3]。因此,加强早期预警和种薯种苗的检验检疫,对防止甘薯病毒病的传播具有重要意义。目前,针对SPFMV的检测技术已经有很多,包括常规RT-PCR、荧光定量PCR、血清学检测等,但多有操作繁杂、耗时较长等特点[10-14]。RT-LAMP检测技术是一种新型的检测技术,具有快速、简单、灵敏等特点,已广泛应用于人类和动植物的各种病原微生物的快速诊断和检测[16-30]。2013年,乔奇等[27]建立的SPCSV RT-LAMP检测方法,实现了对SPCSV的快速检测。本研究建立了针对SPFMV的RT-LAMP检测体系,仅需70 min即可获得检测结果,并可通过荧光显色剂直接观察结果,不需要借助复杂仪器设备,节约了大量的成本和检测时间,适合在基层检测部门中广泛应用。

M:DL2000 DNA marker;1、2:阴性对照和空白对照Negative control and blank control;3—14:田间采集的甘薯样品sweet potato samples collected in the field
多种甘薯病毒共同侵染时,一般具有协生作用[31-34]。作为中国甘薯的主要病毒,SPFMV常与其他多种病毒发生复合侵染现象,导致叶片扭曲、畸形和植株矮化等严重症状,使甘薯产量损失严重,对甘薯造成毁灭性危害[1,4-5]。但当SPFMV单独侵染甘薯时,植株体内病毒含量较低,引起的症状轻微,难以直接进行诊断鉴定[34]。对SPFMV的发生进行早期预警,可有效减少甘薯病毒病害造成的损失。本研究建立并优化的RT-LAMP体系具有高特异性和灵敏度,针对同属病毒侵染的样品,也实现了准确检测,且比常规RT-PCR检测方法的灵敏度高10倍。笔者实验室利用RT-LAMP对山东多地采集的145份甘薯疑似病样进行鉴定,其中检测到SPFMV阳性样品83份,发病率达57.24%(完整结果未提供),对病毒含量较低的样品也可有效检测。表明建立的SPFMV RT-LAMP检测方法具有快速、高效的特点,为种薯、种苗和脱毒苗的检测和鉴定提供了有利的技术支持。
4 结论
建立了SPFMV的RT-LAMP检测体系,实现了检测结果的可视化,具有简单、快速、特异和高灵敏度等优点,不需要复杂的仪器设备,适于科研机构和基层检测部门使用。
[1] Clark C A, Davis J A, Abad J A, Cuellar W J, Fuentes S, Kreuze J F, Gibson R W, Mukasa S B, Tugume A K, Tairo F D, VALKONEN J P T. Sweetpotato viruses: 15 years of progress on understanding and managing complex diseases., 2012, 96(2): 168-185.
[2] 姜珊珊, 谢礼, 吴斌, 辛相启, 陈剑平, 赵玖华. 山东甘薯主要病毒的鉴定及多样性分析. 植物保护学报, 2017, 44(1): 93-102.
JIANG S S, XIE L, WU B, XIN X Q, CHEN J P, ZHAO J H. Identification and genetic diversity analysis on sweet potato viruses in Shandong Province., 2017, 44(1): 93-102. (in Chinese)
[3] 包改丽, 左瑞娟, 饶维力, LI Ru-Hui, 李凡. 云南甘薯病毒的检测及主要病毒的多样性分析. 微生物学通报, 2013, 40(2): 236-248.
BAO G L, ZUO R J, RAO W L, LI R H, LI F. Detection of sweet potato viruses in Yunnan and genetic diversity analysis of the common viruses., 2013, 40(2): 236-248. (in Chinese)
[4] Gutiérrez D L, Fuentes S, Salazar L F. Sweetpotato virus disease (SPVD): distribution, incidence, and effect on sweetpotato yield in Peru., 2003, 87(3): 297-302.
[5] Loebenstein G. Control of sweet potato virus diseases., 2015, 91: 33-45.
[6] Moyer J W, CaliB B. Properties ofRNA and capsid protein., 1985, 66(5): 1185-1189.
[7] Souto E R,Sim J, Chen J, Valverde R A, Clark C A. Properties of strains ofand two newly recognized potyviruses infecting sweet potato in the United States., 2003, 87(10): 1226-1232.
[8] 王升吉, 尚佑芬, 杨崇良, 李长松, 赵玖华, 路兴波, 孙红炜. 甘薯羽状斑驳病毒分子生物学研究概况. 山东农业大学学报 (自然科学版), 2001, 32(4): 539-543.
WANG S J, SHANG Y F, YANG C L, LI C S, ZHAO J H, LU X B, SUN H W. Research advances on molecular biology of., 2001, 32(4): 539-543. (in Chinese)
[9] 林林, 陈炯, 郑红英, 陈剑平. 甘薯羽状斑驳病毒分离物的基因组3′-末端序列测定与分析. 浙江农业学报, 2003, 15(4): 211-214.
LIN L, CHEN J, ZHENG H Y, CHEN J P. Determination and analysis of 3′-terminal genomic sequence of., 2003, 15(4): 211-214. (in Chinese)
[10] 张业辉, 张振臣, 蒋士君, 秦艳红, 张德胜, 乔奇, 王永江. 3种甘薯病毒多重RT-PCR检测方法的建立. 植物病理学报, 2010, 40(1): 95-98.
ZHANG Y H, ZHANG Z C, JIANG S J, QIN Y H, ZHANG D S, QIAO Q, WANG Y J. Development of a multiplex RT-PCR detection method for three sweet potato potyviruses., 2010, 40(1): 95-98. (in Chinese)
[11] 许泳清, 李华伟, 刘中华, 邱永祥, 罗文彬, 纪荣昌, 汤浩, 邱思鑫, 余华. 甘薯羽状斑驳病毒(SPFMV) ELISA鉴定及RT-PCR检测方法的建立. 福建农业学报, 2013, 28(12): 1267-1272.
XU Y Q, LI H W, LIU Z H, QIU Y X, LUO W B, JI R C, TANG H, QIU S X, YU H. ELISA identification and development of RT-PCR detection of., 2013, 28(12): 1267-1272. (in Chinese)
[12] 王丽, 王振东, 乔奇, 秦艳红, 张德胜, 田雨婷, 王爽, 张立军, 张振臣. 甘薯羽状斑驳病毒实时荧光定量PCR检测方法的建立. 沈阳农业大学学报, 2013, 44(2): 129-135.
WANG L, WANG Z D, QIAO Q, QIN Y H, ZHANG D S, TIAN Y T, WANG S, ZHANG L J, ZHANG Z C. Development of real-time fluorescent quantitative PCR assay for detection of., 2013, 44(2): 129-135. (in Chinese)
[13] 卢会翔, 吕长文, 吴正丹, 罗凯, 尹旺, 杨航, 王季春, 张凯. 甘薯羽状斑驳病毒(SPFMV)和甘薯褪绿矮化病毒(SPCSV)荧光定量RT-PCR检测方法的建立. 中国农业科学, 2016, 49(1): 90-102.
LU H X, LÜ C W, WU Z D, LUO K, YIN W, YANG H, WANG J C, ZHANG K. Development of detection method for(SPFMV) and(SPCSV) through fluorescence quantitative RT-PCR., 2016, 49(1): 90-102. (in Chinese)
[14] 何海旺, 何虎翼, 谭冠宁, 刘义明, 何新民, 唐洲萍, 李丽淑, 王晖. 反向斑点杂交法快速检测甘薯羽状斑驳病毒和甘薯G病毒. 南方农业学报, 2014, 45(1): 43-48.
HE H W, HE H Y, TAN G N, LIU Y M, HE X M, TANG Z P, LI L S, WANG H. Detection of SPFMV and SPVG by using reverse dot blot hybridization system., 2014, 45(1): 43-48. (in Chinese)
[15] NotoMi T, Okayama H, Masubuchi H, Yonekawa T, Watanabe K, Amino N, Hase T. Loop-mediated isothermal amplification of DNA., 2000, 28(12): e63.
[16] Poon L L, Leung C S, Tashiro M, Chan K H, Wong B W, Yuen K Y, Guan Y, Peiris J S. Rapid detection of the severe acute respiratory syndrome (SARS) coronavirus by a loop-mediated isothermal amplification assay., 2004, 50(6): 1050-1052.
[17] Uemura N, Makimura K, Onozaki M, Otsuka Y, Shibuya Y, Yazaki H, Kikuchi Y, Abe S, Kudoh S. Development of a loop-mediated isothermal amplification method for diagnosingpneumonia., 2008, 57(1): 50-57.
[18] Ohtsuka K, Yanagawa K, Takatori K, Hara-Kudo Y. Detection ofin naturally contaminated liquid eggs by loop-mediated isothermal amplification, and characterization ofisolates., 2005, 71(11): 6730-6735.
[19] Suzuki R, Yoshikawa T, Ihira M, Enomoto Y, Inagaki S, Matsumoto K, Kato K, Kudo K, Kojima S, Asano Y. Development of the loop-mediated isothermal amplification method for rapid detection of cytomegalovirus DNA., 2006, 132(1/2): 216-221.
[20] Le D T, Netsu O, Uehara-Ichiki T, Shimizu T, Choi I R, Omura T, Sasaya T.Molecular detection of nine rice viruses by a reverse-transcription loop-mediated isothermal amplification assay., 2010, 170(1/2): 90-93.
[21] ZhangZY, LiuXJ, LiDW, Yu JL, HanCG. Rapid detection ofby reverse transcription loop-mediated isothermal amplification., 2011, 8: 550.
[22] 周彤, 杜琳琳, 范永坚, 周益军.水稻黑条矮缩病毒RT-LAMP快速检测方法的建立.中国农业科学, 2012, 45(7): 1285-1292.
ZHOU T, DU L L, FAN Y J, ZHOU Y J. Development of a RT-LAMP assay for rapid detection of., 2012, 45(7): 1285-1292. (in Chinese)
[23] Lee M S, Yang M J, Hseu Y C, Lai G H, Chang W T, Hsu Y H, Lin M K. One-step reverse transcription loop-mediated isothermal amplification assay for rapid detection of., 2011, 173(1): 43-48.
[24] Peng J, Shi M, Xia Z, Huang J, Fan Z F. Detection ofisolates from banana by one-step reverse transcription loop-mediated isothermal amplification.y, 2012, 157(11): 2213-2217.
[25] Fukuta S, Takeyama K, Suzuki M, Shichi A, Ichikawa K, Nakanishi H. Detection offrom soil by the immunocapture reverse transcription loop-mediated isothermal amplification reaction., 2012, 11(2): 51-59.
[26] Ju H J. Simple and rapid detection ofby reverse transcription loop-mediated isothermal amplification., 2011, 27(4): 385-389.
[27] 乔奇, 张振臣, 秦艳红, 张德胜, 田雨婷, 王爽, 王永江.甘薯褪绿矮化病毒西非株系RT-LAMP检测方法的建立.中国农业科学, 2013, 46(18): 3939-3945.
QIAO Q, ZHANG Z C, QIN Y H, ZHANG D S, TIAN Y T, WANG S, WANG Y J. Detection ofstrain WA by reverse transcription loop-mediated isothermal amplification reaction., 2013, 46(18): 3939-3945. (in Chinese)
[28] 王永江, 周彦, 李中安, 苏华楠, 黄爱军, 唐科志, 周常勇.柑橘衰退病毒RT-LAMP快速检测方法的建立.中国农业科学, 2013, 46(3): 517-524.
WANG Y J, ZHOU Y, LI Z A, SU H N, HUANG A J, TANG K Z, ZHOU C Y. A RT-LAMP assay for detection of., 2013, 46(3): 517-524. (in Chinese)
[29] Zhao L, Cheng J, Hao X, Tian X, Wu Y. Rapid detection of tobacco viruses by reverse transcription loop-mediated isothermal amplification., 2012, 157(12): 2291-2298.
[30] 李曼, 辛言言, 朱水芳, 李志红, 郭立新, 张永江. 棉花皱叶病毒LAMP检测方法的建立. 西北农业学报, 2014, 23(2): 85-91.
LI M, XIN Y Y, ZHU S F, LI Z H, GUO L X, ZHANG Y J. Detection ofby loop-mediated isothermal amplification., 2014, 23(2): 85-91. (in Chinese)
[31] Clark C A, Hoy M W. Effects of common viruses on yield and quality of beauregard sweetpotato in Louisiana., 2006, 90(1): 83-88.
[32] Untiveros M, Fuentes S, Salazar L F. Synergistic interaction of() with carla-, cucumo-, ipomo-, and potyviruses infecting sweet potato., 2007, 91(6): 669-676.
[33] NJERU R W, MBURU M W K, CHERAMGOI E, GIBSON R W, KIBURI Z M, OBUDHO E, YOBERA D. Studies on the physiological effects of viruses on sweet potato yield in Kenya., 2004, 145(1): 71-76.
[34] 谢礼, 吕明芳, 王芳, 季志仙, 吴列洪, 严成其, 陈剑平. 甘薯羽状斑驳病毒和甘薯褪绿矮化病毒复合侵染甘薯引起的细胞病理学研究. 电子显微学报, 2013, 32(6): 485-491.
XIE L, LÜ M F, WANG F, JI Z X, WU L H, YAN C Q, CHEN J P. Cyto-pathology study of sweet potato induced by synergetic infection ofand., 2013, 32(6): 485-491. (in Chinese)
(责任编辑 岳梅)
Development of RT-LAMP Assay for Rapid Detection of(SPFMV)
JIANG ShanShan, FENG Jia, ZHANG Mei, WANG ShengJi, XIN ZhiMei, WU Bin, XIN XiangQi
(Laboratory of Plant Virology, Institute of Plant Protection, Shandong Academy of Agricultural Sciences, Ji’nan 250100)
【】(SPFMV) is an important virus infecting sweet potato plants. The objective of this study is to establish a rapid and efficient method for the detection of SPFMV by using reverse transcription loop-mediated isothermal amplification (RT-LAMP) method.【】Four specific RT-LAMP primers for SPFMV detection including SPFMV-FIP (5′-TAAGCGCGGCTGCCTTCATC-CATTCAACCACCCCTGCA-3′), SPFMV-BIP (5′-TCGGTTGTTTGGT TTGGACGGA-ATCAGTTGTCGTGTGCCTC-3′), SPFMV-F3 (5′-GAGTCTTGCGCGATATGCA-3′) and SPFMV-B3 (5′-ACCCC TCATTCCTAAGAGGT-3′) were designed by Primer Explorer V4 according to the nucleotide sequence of SPFMV coat protein (CP) gene in GenBank as well as two specific reverse transcription polymerase chain reaction (RT-PCR) primers for SPFMV detection including SPFMV-F (5′-TCTAATGAGAACACTGAATT-3′) and SPFMV-R (5′-TTGCACACCCCTCATTCCTAAG-3′). Different reaction conditions were optimized in the RT-LAMP in order to improve specificity and sensitivity of the detection, including the primers concentration ratios of F3/B3 to FIP/BIP (1﹕1, 1﹕2, 1﹕4, 1﹕6, 1﹕8 and 1﹕10), dNTPs concentrations (0.025, 0.125, 0.225, 0.325, 0.425, 0.525, 0.625, 0.725 and 0.825 mmol·L-1), Betaine concentrations (0.4, 0.7, 1.0, 1.3 and 1.6 mol·L-1), reaction temperatures (59, 61, 63, 65, 67 and 69℃) and reaction times (20, 30, 40, 50, 60, 70, 80 and 90 min). The best reaction conditions were confirmed according to the test results of agarose gel electrophoresis. The RT-LAMP products were identified by sequencing and enzyme analysis. The detection specificity of RT-LAMP was tested by using different RNA templates from SPFMV,C (SPVC),(SPCSV),2 (SPV2),(SPLV),G (SPVG),(SPCFV) and leaf sample of healthy sweet potato plant. The sensitivities of RT-LAMP and RT-PCR for detecting SPFMV were compared by using ten-fold serially diluted RNA templates of SPFMV (including original RNA, 10-1, 10-2, 10-3, 10-4, 10-5, 10-6and 10-7dilutions). Finally, the optimized RT-LAMP and RT-PCR were used to detect the samples of SPFMV collected from Shandong Province. 【】The RT-LAMP rapid detection method of SPFMV was established and the optimal amplification was achieved by incubation of 0.8 µmol·L-1SPFMV-FIP/SPFMV-BIP, 0.2 µmol·L-1SPFMV-F3/SPFMV-B3, 0.325 mmol·L-1dNTPs, 1 mol·L-1Betaine with template RNA at 65℃ for 70 min. The specificity test showed that the RT-LAMP method established in this study could amplify the typical ladder-like bands only to the RNA carrying SPFMV. The lowest detectable RNA concentration of RT-LAMP was 121.6×10-4ng·μL-1, while the lowest detectable RNA concentration of RT-PCR was 121.6×10-3ng·μL-1, indicating that the sensitivity of RT-LAMP was 10 times higher than RT-PCR for detecting SPFMV. The optimized RT-LAMP method was applied to the detection of SPFMV in field samples and the results were consistent with the visual inspection of RT-LAMV products. It suggested that the RT-LAMP detection method could be applied to detect the SPFMV in the field.【】The RT-LAMP established in this study has high sensitivity and specificity, and is suitable for rapid detection of SPFMV in the field.
sweet potato;(SPFMV); RT-LAMP; detection
2017-09-29;
2017-12-12
山东省重点研发计划(2016GNC111003)、国家公益性行业(农业)科研专项(201303028)、山东省农业科学院农业科技创新工程(CXGC2016B11)
姜珊珊,E-mail:shanshan2113@163.com。
辛相启,E-mail:xinxiangqi@126.com

