赤拟谷盗章鱼胺受体3(TcOctβR3)cDNA克隆、表达及功能
刘小强,蒋红波,李慧敏,熊英,王进军
赤拟谷盗章鱼胺受体3()cDNA克隆、表达及功能
刘小强,蒋红波,李慧敏,熊英,王进军
(西南大学植物保护学院昆虫学及害虫控制工程重庆市市级重点实验室,重庆 400716)
【】章鱼胺信号系统在调节昆虫行为和生理过程中具有至关重要的作用。赤拟谷盗()作为一种模式昆虫,被广泛用于解析昆虫生长发育及生理等调控机制的研究工作。本研究以赤拟谷盗为对象,旨在明确章鱼胺受体在调节赤拟谷盗行为和生理方面的功能。【】根据GenBank登录的相关序列信息(XP_008198078),利用RT-PCR技术克隆赤拟谷盗章鱼胺受体基因的cDNA序列。利用在线生物信息学分析软件预测该基因的开放阅读框、编码的氨基酸序列以及跨膜结构域等信息,基于邻接法构建该基因与其他昆虫相关序列的系统发育树,明确系统进化关系。分别提取赤拟谷盗各发育阶段(卵、幼虫、蛹和成虫)、不同组织(中枢神经系统、脂肪体、中肠、后肠、马氏管、精巢和卵巢)以及饥饿胁迫后的RNA,以赤拟谷盗核糖体蛋白S3()为内参基因,采用实时定量PCR技术分析该基因在赤拟谷盗不同发育阶段、不同组织以及在饥饿胁迫下的表达模式。运用哺乳动物异源表达系统在人胚胎肾细胞HEK293中瞬时表达TcOctR3,进而利用第二信使cAMP含量测定技术分析TcOctR3与配体的结合能力。最后,通过体外合成赤拟谷盗的双链RNA,利用RNA干扰以及轨迹球行为分析等技术探究该基因的生理功能。【】序列分析结果表明,赤拟谷盗开放阅读框全长1 305 bp,编码434个氨基酸,序列中含有G蛋白偶联受体典型的7个跨膜结构域。基于邻接法构建的系统发育树表明,该基因编码的蛋白质与小蜂甲()的OctR3亲缘关系最近。实时定量PCR分析结果表明,在赤拟谷盗各发育阶段均有表达,尤其在低龄幼虫期转录水平最高,而在其他发育阶段表达量无显著差异;在赤拟谷盗不同组织中,在中枢神经系统的表达量显著高于其他组织;赤拟谷盗幼虫在经饥饿处理24 h的过程中,的表达量呈先下降后上升的趋势,且在处理6 h的表达量最低,为对照的0.47倍,在16 h表达量最高,为对照的1.80倍,最后恢复到正常水平。通过HEK293细胞异源表达TcOctR3后,cAMP测定结果表明章鱼胺(OA)呈浓度依赖性地激活TcOctR3,其EC50为8.68×10-7mol·L-1,萘甲唑啉(NA)的激动活性最高,其有效中浓度EC50为8.56×10-8mol·L-1。4种供试生物胺激动剂活性强弱为:萘甲唑啉>酪胺(TA)>章鱼胺>多巴胺(DA)。进一步采用RNA干扰技术的分析结果表明,注射dsRNA能有效抑制的表达,沉默效率高达61.5%,但干扰该基因表达后不会影响赤拟谷盗成虫的爬行速度和产卵量。【】在赤拟谷盗中枢神经系统可能发挥重要作用,能调节幼虫对饥饿胁迫的响应。明确了TcOctR3的分子生物学特性,可为将来以其为靶标筛选高效激动剂和抑制剂提供理论依据。
赤拟谷盗;章鱼胺受体;表达模式;生物活性;生理功能
0 引言
【研究意义】赤拟谷盗()属鞘翅目拟步甲科,是一类在全球范围内广泛分布的仓储害虫。同时,因赤拟谷盗繁殖能力强、易于饲养及遗传操作,被广泛地用于昆虫的生长发育、繁殖等方面的基础研究。2008年,赤拟谷盗基因组测序完成[1],进一步推动了该虫作为模式昆虫的地位,同时赤拟谷盗功能基因组学等各个领域的研究也蓬勃发展。章鱼胺(octopamine,OA)是一种在无脊椎动物神经系统普遍存在的微量生物胺,可调控昆虫的学习和记忆、节律、嗅觉、好斗与飞行等重要生理功能[2]。OA作为昆虫体内重要的神经活性物质(如神经调质、神经递质、神经激素)[3-4],被相应的神经元释放,并通过与其受体(章鱼胺受体,octopamine receptors,OctRs)结合进而发挥其生理功能[3,5]。由于章鱼胺信号传递系统在昆虫生命活动中的重要生理功能,其一直被视为新型杀虫剂潜在的作用靶标而备受关注。开展赤拟谷盗章鱼胺受体基因分子生物学特性研究,可为进一步深入揭示赤拟谷盗章鱼胺受体的生理功能打下基础,同时也将丰富对昆虫章鱼胺受体生理功能的认识。【前人研究进展】章鱼胺受体是典型的G蛋白偶联受体(G-protein coupled receptor,GPCR)。自第一个章鱼胺受体基因从黑腹果蝇()[6]中克隆以来,研究人员在多种昆虫中成功克隆了章鱼胺受体基因,如烟草天蛾()、家蚕()[7]、二化螟()[8]和橘小实蝇()[9]等。根据章鱼胺受体的氨基酸序列和信号通路与哺乳动物肾上腺素受体的相似性,目前已鉴定的章鱼胺受体分为3类:-adrenergic-like octopamine receptors (OctRs)、-adrenergic-like octopamine receptors (OctRs)和octopamine/tyramine receptors(TyrRs)。在章鱼胺受体的转导途径中,OctRs被激活后最初引起细胞内钙离子浓度增加,同时细胞内环腺苷酸(cAMP)的浓度也会有轻微的升高[10-11];OctRs的3种类型被激活后均能够增加细胞内cAMP的浓度[12];TyrRs与脊椎动物2肾上腺素受体的结构和药理学相似,它被Tyr激活后诱导细胞内cAMP水平的降低[13]。近年来,对于昆虫体内的章鱼胺受体研究日益增多,Evans等[14]对其药理学研究较为深入,对章鱼胺受体特异、高效的激动剂和拮抗剂的筛选,有可能以章鱼胺受体作为一种潜在的药剂靶标来防控害虫[3,15]。【本研究切入点】章鱼胺受体在昆虫体内具有重要作用,而模式昆虫赤拟谷盗有关章鱼胺受体的研究未见报道。【拟解决的关键问题】利用qPCR技术,克隆赤拟谷盗cDNA全序列,解析其时空表达模式,借助异源表达系统和RNAi技术,明确其在昆虫体内的功能,丰富对昆虫章鱼胺受体生理功能的认识。
1 材料与方法
试验于2016年5月至2017年3月在西南大学昆虫分子生态实验室完成。
1.1 供试昆虫与试剂
赤拟谷盗GA1品系源自美国农业部仓储害虫研究课题组Richard Beeman实验室,由河南工业大学鲁玉杰教授馈赠。在实验室内以人工饲料(全麦粉﹕酵母粉=1﹕1),在恒温30℃、相对湿度为60%—70%、全黑暗的条件下饲养。
高保真DNA聚合酶PrimerSTARTMMax Premix及PCR相关试剂均购自TakaRa公司,Trizol试剂以及细胞培养相关试剂购自Life Technologies公司,反转录试剂盒、克隆载体pGEM®-T Easy、T4 DNA ligase、GlosensorTMcAMP Reagent购自Promega公司,iQTMSYBR®Green Supermix购自Bio-rad公司,T7体外转录试剂盒购自Thermo Scientific公司,限制性内切酶I-HF购自NEB公司,HEK293细胞、质粒Glosensor、pcDNA3.1(+)由美国堪萨斯州州立大学Yoonseong Park教授馈赠,转染试剂TransIT-LT1购自Mirus Bio LLC公司,PCR引物合成和测序工作均由Invitrogen公司完成。
1.2 TcOctβR3 cDNA克隆
挑取4头赤拟谷盗第7日龄成虫,加入Trizol试剂充分研磨,参照Trizol试剂说明书提取样品的总RNA,使用RQ1 Rnase-Free Dnase去除基因组DNA,并经过琼脂糖凝胶电泳和Nanodrop检测,按照反转录试剂盒说明书进行反转录合成第一链cDNA,在-20℃冰箱中保存备用。
根据GenBank中的序列信息(XP–008198078),利用Oligo 6.0软件和Primer premier 5.0软件设计赤拟谷盗的全长引物(表1),并用DNAMAN 6.0对所设计的引物进行评价。以反转录合成的第一链cDNA为模板,采用巢式PCR扩增,体系为25 μl:cDNA 1 μl、ddH2O 9.5 μl、PrimerSTAR Max 12.5 μl、上下游引物各1 μl。反应条件:98℃预变性3 min,98℃变性10 s,55℃退火15 s,72℃延伸90 s,进行35个循环,最后72℃后延伸10 min。用1.5%琼脂糖凝胶电泳检测,并按照TaKaRa胶回收试剂盒回收目的条带,将回收产物连接到pGEM®-T Easy载体上,并转化到感受态大肠杆菌(DH5)中,过夜培养挑取白斑菌落,进行菌液PCR检测,挑选阳性克隆测序(Invitrogen)。

表1 本研究所用引物序列
1.3 序列分析
序列分析通过DNAMAN、EdiSeq等软件完成。利用NCBI ORF finder (http://www.ncbi.nlm.nih.gov/ gorf/gorf.html)确定开放阅读框(ORF),用在线工具TMHMM(http://www.cbs.dk/services/TMHMM)进行跨膜结构域预测,利用MEGA 5.1软件构建系统进化树。
1.4 TcOctβR3表达模式分析
赤拟谷盗不同发育阶段和不同组织表达模式的样品收集参照JIANG等[16]方法,具体如下:不同发育阶段选取早期卵(<1 d)、晚期卵(>2 d)、早期幼虫(<1 d)、老熟幼虫(>5龄)、早期蛹(<1 d)、晚期蛹(>3 d)、早期成虫(<1 d)、老熟成虫(7 d);选取羽化后7日龄未交配的成虫解剖不同组织,包括中枢神经系统、脂肪体、中肠、后肠、马氏管、精巢和卵巢。每个样品3个生物重复,总RNA提取和cDNA合成参照1.2节。
根据1.2节中测序获得的序列设计赤拟谷盗特异性qPCR引物,同时选择赤拟谷盗核糖体蛋白S3()为内参基因(表1)。qPCR反应体系如下:cDNA 1 μl、GoTaq®qPCR Master Mix 10 μl、ddH2O 7 μl、上下游引物各1 μl。反应条件:95℃预变性2 min,95℃变性15 s,60℃退火30 s,60℃延伸30 s,进行40个循环,最后95℃后延伸30 s。每次试验技术重复3个,设置生物重复3次。利用2-∆∆Ct法[17]对数据进行分析。
1.5 饥饿胁迫
分别挑取4头正常饲养和饥饿处理6、12、16、24 h的赤拟谷盗孵化后10—15日龄的幼虫,加入Trizol充分研磨,总RNA提取和cDNA合成参照1.2节,每个处理3个生物重复。
1.6 异源表达及活性测定
利用限制性内切酶I-HF单酶切pcDNA3.1(+)载体和pGEM-T-TcOctR3质粒,于37℃孵育20 h以保证酶切效率。反应结束后琼脂糖凝胶电泳,进行目的条带分离和纯化。用FastAP(Fermentas)去磷酸化,防止载体pcDNA3.1(+)自连,随后进行纯化备用。将酶切后的目的基因与去磷酸化的pcDNA3.1(+)载体通过T4 Ligase连接,将连接产物转入感受态细胞DH5中,接种到含有氨苄青霉素(Ampicillin)的培养基,于37℃过夜培养后,在平板上挑取单菌落,PCR菌液检测后送Invitrogene公司测序,确保获得正确的pcDNA3.1(+)-TcOctR3重组表达质粒。
用转染试剂TransIT-LT1共转染pcDNA3.1(+)- TcOctR3质粒和GloSensor质粒到HEK293细胞中,30 h后收集细胞。活性测定参照LI等[9]的方法,略有改动。在收集的细胞中加入1% GloSensor试剂,置于磁力搅拌器上孵育2 h,利用微量滴度荧光发光检测仪自动加样,加50 μl细胞(浓度约为105个/50 μl)到96孔板中,然后测定化学发光值的变化。测试配体有章鱼胺盐酸盐(OA)、萘甲唑啉盐酸盐(NA)、酪氨盐酸盐(TA)和多巴胺盐酸盐(DA),供试配体按照10倍浓度梯度稀释。每个浓度设定3个技术重复和3个生物重复,在供试4种配体中,以NA在10 μmol·L-1的发光值为基准,数据经logistic模型拟合后计算有效中浓度EC50,所有计算使用Origin 8.6(OriginLab)软件。
1.7 RNA干扰
赤拟谷盗的dsRNA特异性引物序列见表1。参照T7体外转录试剂盒(Thermo Scientific)的说明书合成dsRNA,经琼脂糖凝胶电泳检测后备用。dsRNA注射方法参照Bucher等[18]法。挑选化蛹时间24 h内的蛹注射dsRNA,每头注射200 ng(浓度为2 000 ng·μl-1),待蛹羽化5—7 d提取4头(2雌2雄)成虫的RNA,检测沉默效率,注射相同体积的PBS为对照。
待蛹羽化后第5天,用昆虫轨迹球行为记录仪测试赤拟谷盗的爬行速度。具体的试验方法参照使用说明书和Thiery等[19]方法。简言之,在测试的过程中,球体转动的方向与昆虫爬行的方向相反,但是速度始终保持一致。连续记录2 min,用TrackSphere软件处理数据。羽化第7天,将雌虫和雄虫单对配对放入装有面粉、直径3.5 cm的塑料养虫盒中,饲养5 d后记录每头雌虫的产卵量[20],共处理25对。所得产卵量使用SPSS 16.0进行统计分析(<0.05)。
2 结果
2.1 赤拟谷盗TcOctβR3序列分析及系统进化关系分析
利用RT-PCR技术,克隆获得了赤拟谷盗cDNA全长序列(GenBank登录号:XP–008198078)。cDNA全长1 305 bp,编码434个氨基酸。TMHMM 2.0蛋白跨膜结构预测软件分析结果表明,具有7个螺旋跨膜区(图1),是典型的G蛋白偶联受体。进一步分析结果表明,跨膜区氨基酸的位置分别位于第49—71、83—105、125—147、167—189、209—231、346—368和383—405位,且每一个跨膜域都包含23个氨基酸。该序列与鞘翅目、双翅目、鳞翅目、半翅目、直翅目和膜翅目等6个目昆虫的章鱼胺受体进行同源性比较分析并构建系统发育树(图2),结果显示,与所有类受体聚为一簇,并且与红斑尼埋葬甲()及小蜂甲()等类受体关系较近。

2.2 TcOctβR3表达模式
在赤拟谷盗的不同发育阶段包括卵、幼虫、蛹和成虫中均有所表达,在幼虫期的表达水平最高(图3-A)。在所测定的成虫各组织中也均有所表达,尤其在中枢神经系统的表达量最高,其余组织表达量从高到低依次为精巢、脂肪体、卵巢、后肠、中肠和马氏管(图3-B)。
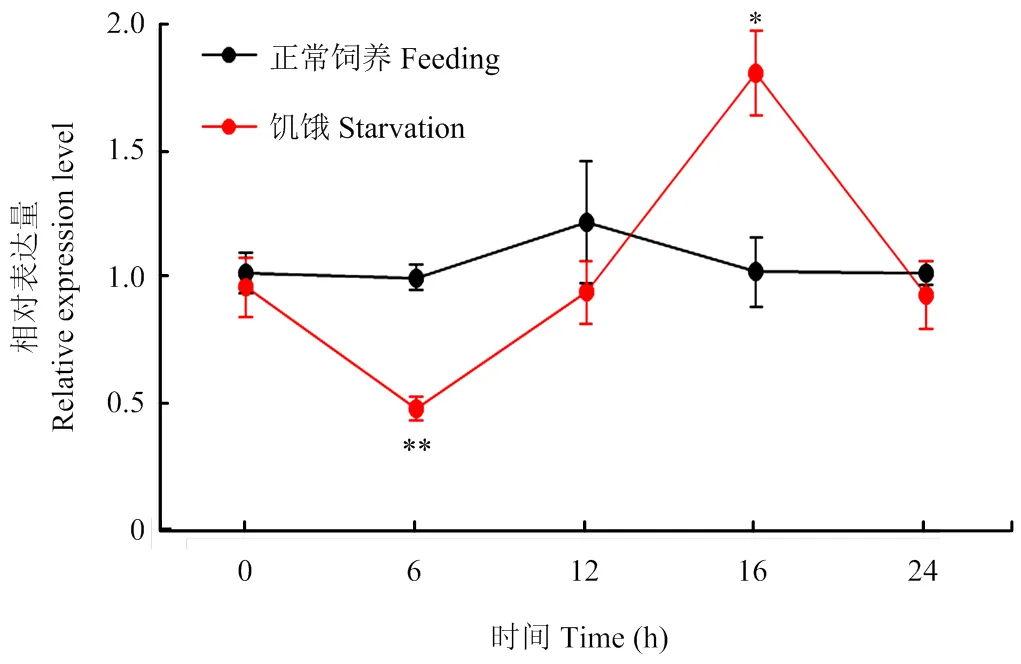
2.3 TcOctβR3在饥饿胁迫下的表达模式
赤拟谷盗幼虫在饥饿胁迫下,表达量发生明显变化(图4)。饥饿6 h,的相对表达量为0.47,极显著低于对照(<0.01);随着饥饿时间不断延长,的表达量逐渐上升,在16 h最大达1.80,显著高于对照(<0.05);饥饿24 h后,表达量又恢复到正常水平。
2.4 TcOctβR3活性测定
HEK293细胞异源表达TcOctR3后,4种供试生物胺均能呈浓度依耐性激活TcOctR3,引起细胞内cAMP的变化(图5)。其中,NA对该受体的激动活性最高,其有效中浓度EC50为8.56×10-8mol·L-1,而模式配体OA的激动剂活性相对较弱,EC50为8.68×10-7mol·L-1,TA和DA的EC50分别为4.92×10-7、1.22×10-5mol·L-1。因此,4种供试配体激动活性由强到弱为NA>TA>OA>DA。
2.5 RNA干扰后表型观察
采用半定量和实时定量PCR技术分析了注射dsOctR3后的表达变化情况(图6-A、6-B),结果显示,注射dsOctR3后,靶标基因的表达量极显著下调(<0.01),与注射PBS相比,沉默效率为61.5%。同时,赤拟谷盗羽化后第5天,用昆虫轨迹球行为记录仪测定试虫的爬行速度,结果显示,注射dsOctR3试虫的平均爬行速度为10.30 mm·s-1,注射PBS试虫的平均爬行速度为11.61 mm·s-1,二者无显著差异(>0.05)(图6-C)。在羽化后第7天进行雌雄配对,结果显示(图6-D),注射dsOctR3后,赤拟谷盗雌虫在5 d内的平均产卵量为35粒,而对照的产卵量为32粒,二者亦无显著差异(>0.05)。

生物胺受体来源及GenBank登录号:The origin of the amine receptors and their GenBank accession numbers。红斑尼埋葬甲Nicrophorus vespilloides NvesOctβR1 (AHN85841.1), NvesOctβR2 (AHN85842.1), NvesOctβR3 (AHN85843.1), NvesOctR1 (AHN85844.1), NvesTAR1 (AHN85845.1), NvesTAR2 (AHN85846.1), NvesDAR1 (XP_017775810.1), NvesDAR2 (XP_017775018.1);豌豆蚜Acyrthosiphon pisum ApisOctβR1 (XP_001947781.1), ApisOctβR3 (XP_001948521.2), ApisOctR1 (XP_016658387.1);黑腹果蝇Drosophila melanogaster DmelOctβR1 (Q9VCZ3.1), DmelOctβR2 (Q4LBB9.2), DmelOctβR3 (Q4LBB6.4), DmelOctR1 (NP_732541.1), DmelTAR1 (BAB71788.1), DmelTAR2 (NP_650652.1), DmelDAR1 (CAA54451.1);家蚕Bombyx mori BmorOctβR2 (BAJ06526.1), BmorOctR1 (BAF33393.1), BmorTAR1 (BAD11157.1), BmorTAR2 (BAI52937.1), BmorDAR1 (NP_001108459.1), BmorDAR2 (NP_001108338.1);冈比亚按蚊Anopheles gambiae AgamOctR1 (EAA06361.5);小蜂甲Aethina tumida AtumOctβR3 (XP_019864626.1);意大利蜜蜂Apis mellifera AmelOctR1 (NP_001011565.1);沙漠蝗Schistocerca gregaria SgreOctβR2 (ADD91575.1);赤拟谷盗Tribolium castaneum TcasOctβR1 (NP_001280514.1), TcasOctβR2 (NP_001280501.1), TcasOctβR3 (XP_008198078.1), TcasTAR1 (NP_001164312.1), TcasDAR1 (NP_001280543.1), TcasDAR2 (NP_001280503.1)。标尺代表遗传距离 The scale in the figure represents genetic distance

EE:早期卵Early egg;OE:老熟卵Old egg;EL:早期幼虫Early larva;OL:老熟幼虫Old larva;EP:早期蛹Early pupa;OP:老熟蛹Old pupa;EA:早期成虫Early adult;OA:老熟成虫Old adult;CNS:中枢神经系统Central nervous system;FB:脂肪体Fat body;HG:后肠Hindgut;MG:中肠Midgut;MT:马氏管 Malpighian tubule;OV:卵巢Ovary;TE:精巢Testis。柱上不同的字母表示经Duncan新复极差测验比较后差异显著Different letters on the bar indicate significant difference by Duncan’s multiple range tests (P<0.05)
*:在P<0.05水平差异显著significant difference at P<0.05 level;**:在P<0.01水平差异显著significant difference at P<0.01 level

图5 4种配体对表达TcOctβR3细胞内cAMP的影响
3 讨论
本研究克隆获得了赤拟谷盗cDNA序列,预测其编码的蛋白质有7个螺旋跨膜区域,属于典型的G蛋白偶联受体,预示在调控赤拟谷盗生理活动过程中具有重要作用。通过与其他昆虫章鱼胺受体氨基酸序列比较发现,赤拟谷盗、红斑尼埋葬甲、小蜂甲等昆虫的单独聚为一簇,这种结果可能是由它们的亲缘关系和基因结构决定的。

A:半定量检测RNA干扰后TcOctβR3的相对表达量 Semi-quantitative RT-PCR detection of TcOctβR3 levels after RNA interference;B:实时荧光定量分析RNA干扰后TcOctβR3的转录水平,以注射PBS的相对表达量作为基准进行统计学分析。**表示t 检验存在显著差异(P<0.01)qRT-PCR analysis of TcOctβR3 transcriptional level after RNA interference. With relative expression after injecting phosphate-buffered saline (PBS) as a benchmark for statistical analysis. ** indicates significant difference at P<0.01 level by Student t-test;C:注射dsOctβR3后赤拟谷盗成虫爬行速度的变化,t检验无显著性差异(P>0.05)The changes of the walking speed of T. castaneum adult after dsOctβR3 injection. There is no significant difference by Student t-test (P>0.05);D:注射dsOctβR3后赤拟谷盗产卵量的变化,t检验无显著性差异(P>0.05)The changes of egg numbers of T. castaneum after dsOctβR3 injection. There is no significant difference by Student t-test (P>0.05)
本研究发现在赤拟谷盗不同发育阶段均有所表达,尤其在幼虫期高表达,这与棉铃虫()[21]、二化螟[8]体内的表达模式相似,暗示章鱼胺在幼虫阶段发挥重要的作用。在赤拟谷盗成虫不同组织中,在中枢神经系统的表达量占主导地位,表明该受体可能在神经系统扮演着重要角色。在黑腹果蝇中,主要在脑部高表达[22],在沙漠蝗()体内,在中枢神经系统高表达,而在飞行肌高表达[23],这预示着不同类型的章鱼胺受体承担着不同的生理功能。近年来一些研究表明,在饥饿条件下,昆虫体内血淋巴中章鱼胺含量会发生明显变化,同时活跃度也会增加[24-25]。与此相似,橘小实蝇在饥饿条件下表达量显著上调[9],暗示章鱼胺受体在饥饿调节过程中发挥着重要作用。本研究结果显示,赤拟谷盗幼虫在饥饿过程中,表达量起初呈现出显著性下调,而后又显著性上调,最后恢复正常水平,暗示参与了饥饿调节过程。
赤拟谷盗是一种世界性仓储害虫,可通过系统RNAi研究其基因的功能[26]。沉默赤拟谷盗,成虫爬行速度与对照相比并无显著性差异,这一结果与[27]、[22]在胸部肌肉组织低表达相似,表明可能不参与昆虫的运动过程。注射dsOctR3后,雌虫产卵量不受影响,这一结果与在卵巢中的表达模式相似[27],预示可能与产卵无关。
近年来,对于昆虫体内章鱼胺受体的药理学研究日益增多,很多对章鱼胺受体有高度特异的激动剂和拮抗剂用于害虫的防治,例如杀虫脒和双甲脒[3],同时它们可以作为增效剂来筛选新型药剂,可有效防治埃及伊蚊()幼虫[15]。借助异源表达系统,类章鱼胺受体的活性在多种昆虫中得到验证,如DmOctR3与DmOctR1活性相似,激动剂活性均为NA>OA,而DmOctR2则是OA>NA[14],对于BdOctR1,激动剂活性为NA>OA[9]。本研究测试配体对TcOctR3的激动剂活性发现强弱为NA>OA,与DmOctR3相似[14]。OA对赤拟谷盗TcOctR3有效中浓度EC50为8.68×10-7mol·L-1,其激动活性弱于果蝇DmOctR3, EC50为1.40×10-8mol·L-1[12],这种结果可能是由于不同昆虫OctR3敏感差异所致。
目前对章鱼胺受体的亚型是如何调节章鱼胺的研究具有局限性,对果蝇、家蚕类受体研究较多,而对鞘翅目昆虫章鱼胺受体的研究极少,仅Cunningham等阐释了亚社会性昆虫红斑尼埋葬甲6种章鱼胺受体基因的表达模式[27-28],而在鞘翅目模式昆虫赤拟谷盗则未见报道。本研究从生物信息学和转录方面分析了赤拟谷盗的一些基本特性,丰富了对昆虫章鱼胺受体生理功能的认识。由于章鱼胺在昆虫体内重要的生理作用及其在脊椎动物中含量极少的特性,以其受体为靶标将有助于开发出更为高效安全的新型药剂[29]。因此,对赤拟谷盗和其他受体的功能和调控机制仍需进一步研究。
4 结论
赤拟谷盗为典型的G蛋白偶联受体,其基因的表达具有发育阶段和组织特异性,主要在幼虫期和中枢神经系统中高表达;可能参与饥饿调节过程,但与运动和产卵无关;章鱼胺可有效激活TcOctR3,表明具有良好的控制剂靶标潜力。
[1]Genome Sequencing Consortium. The genome of the model beetle and pest., 2008, 452(7190): 949-955.
[2] Roeder T. Octopamine in invertebrates., 1999, 59(5): 533-561.
[3] Roeder T. Tyramine and octopamine: ruling behavior and metabolism., 2005, 50: 447-477.
[4] Verlinden H, Vleugels R, Marchal E, Badisco L, Pfluger H J, Blenau W, Broeck J V. The role of octopamine in locusts and other arthropods., 2010, 56(8): 854-867.
[5] Blenau W, Baumann A. Molecular and pharmacological properties of insect biogenic amine receptors: lessons fromand., 2001, 48(1): 13-38.
[6] Han K A, Millar N S, Davis R L. A novel octopamine receptor with preferential expression inmushroom bodies., 1998, 18(10): 3650-3658.
[7] Dacks A M, Dacks J B, Christensen T A, Nighorn A J. The cloning of one putative octopamine receptor and two putative serotonin receptors from the tobacco hawkmoth,., 2006, 36(9): 741-747.
[8] Wu S F, Yao Y, Huang J, Ye G Y. Characterization of a-adrenergic-like octopamine receptor from the rice stem borer ()., 2012, 215(15): 2646-2652.
[9] Li H M, Jiang H B, Gui S H, Liu X Q, Liu H, Lu X P, Smagghe G, Wang J J. Characterization of a-adrenergic-like octopamine receptor in the oriental fruit fly,(Hendel)., 2016, 17(10): 1577.
[10] Balfanz S, Strünker T, Frings S, Baumann A. A family of octopamine receptors that specifically induce cyclic AMP production or Ca2+release in., 2005, 93(2): 440-451.
[11] Jia H, Hamasaki T, Ozoe Y. Pharmacological characterization of a-adrenergic-like octopamine receptor stably expressed in a mammalian cell line., 2010, 73(2): 74-86.
[12] Maqueira B, Chatwin H, Evans P D. Identification and characterization of a novel family ofbeta-adrenergic-like octopamine G-protein coupled receptors., 2005, 94(2): 547-560.
[13] Rotte C, Krach C, Balfanz S, Baumann A, Walz B, Blenau W. Molecular characterization and localization of the first tyramine receptor of the American cockroach ()., 2009, 162(4): 1120-1133.
[14] Evans P D, Maqueira B. Insect octopamine receptors: a new classification scheme based on studies of clonedG-protein coupled receptors., 2005, 5(3/4): 111-118.
[15] Ahmed M A, Vogel C F. Synergistic action of octopamine receptor agonists on the activity of selected novel insecticides for control of dengue vector(Diptera: Culicidae) mosquito., 2015, 120: 51-56.
[16] Jiang H, Kim H G, Park Y. Alternatively spliced orcokinin isoforms and their functions in., 2015, 65: 1-9.
[17] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-∆∆Ctmethod., 2001, 25: 402-408.
[18] Bucher G, Scholten J, Klingler M. Parental RNAi in(Coleoptera)., 2002, 12(3): R85-86.
[19] Thiery D, Visser J H. Masking of host plant odour in the olfactory orientation of the Colorado potato beetle., 1986, 41(2): 165-172.
[20] Jiang H, Lkhagva A, Daubnerova I, Chae H S, Simo L, Jung S H, Yoon Y K, Lee N R, Seong J Y, Zitnan D, Park Y, Kim Y J. Natalisin, a tachykinin-like signaling system, regulates sexual activity and fecundity in insects., 2013, 110(37): 3526-3534.
[21] 吴凤明, 巫鹏翔, 王璇, 闫硕, 李贞, 张青文, 刘小侠. 棉铃虫章鱼胺受体2基因的分子鉴定. 应用昆虫学报, 2016, 53(5): 972-981.
Wu F M, Wu P X, Wang X, Yan S, Li Z, Zhang Q W, Liu X X. Molecular identification of octopamine receptor 2 in(Lepidoptera: Noctuidae)., 2016, 53(5): 972-981. (in Chinese)
[22] El-Kholy S, Stephano F, Li Y, Bhandari A, Fink C, Roeder T. Expression analysis of octopamine and tyramine receptors in., 2015, 361(3): 669-684.
[23] Verlinden H, Vleugels R, Marchal E, Badisco L, Tobback J, Pfluger H J, Blenau W, Vanden Broeck J. The cloning, phylogenetic relationship and distribution pattern of two new putative GPCR-type octopamine receptors in the desert locust ()., 2010, 56(8): 868-875.
[24] Davenport A P, Evans P D. Changes in haemolymph octopamine levels associated with food deprivation in the locust,., 1984, 9(3): 269-274.
[25] Yang Z, Yu Y, Zhang V, Tian Y, Qi W, Wang L. Octopamine mediates starvation-induced hyperactivity in adult., 2015, 112(16): 5219-5224.
[26] Brown S J, Denell R E, Beeman R W. Beetling around the genome., 2003, 82(3): 155-161.
[27] Cunningham C B, Douthit M K, Moore A J. Expression of octopaminergic receptor genes in 4 nonneural tissues in femalebeetles., 2015, 22(4): 495-502.
[28] Cunningham C B, Douthit M K, Moore A J. Octopaminergic gene expression and flexible social behaviour in the subsocial burying beetle., 2014, 23(3): 391-404.
[29] Ishaaya I, Horowitz A R.. Springer Netherlands, 2009.
(责任编辑 岳梅)
The cDNA Cloning, expression profiling and functional characterization of octopamine receptor 3 () in
LIU XiaoQiang, JIANG HongBo, LI HuiMin, XIONG Ying, WANG JinJun
(Key Laboratory of Entomology and Pest Control Engineering of Chongqing, College of Plant Protection, Southwest University, Chongqing 400716)
【】Octopaminergic signaling system plays a crucial role in the reregulation of behavioral and physiological processes in insects. The red flour beetle () is a model insect which has been widely used in the study of insect growth, development and physiology. The objective of this study is to utilizeas the research insect and elucidate the vital functions of octopamine receptors involved in the physiology and behavior【】Based on the sequence information in GenBank (XP_008198078), the cDNA of an octopamine receptor () was cloned by RT-PCR. The open reading frame (ORF), deduced amino acid sequence and the membrane structure domains were predicted by using online service, and phylogenetic tree associated withfrom other insects was constructed by using neighbor-joining method to clarity its phylogenetic relationship. In addition, the RNA was extracted from different developmental stages (egg, larva, pupa, and adult), different tissues (central nervous system, fat body, midgut, hindgut, malpighian tubule, testis and ovary), as well as the larvae under stress of starvation, respectively. Ribosomal protein S3 gene () was used as an internal reference. qRT-PCR (real-time quantitative PCR) was employed to determine its expression patterns in different developmental stages, different tissues as well as the induced expression profiles under the stress of starvation. TcOctR3 was transiently expressed in human embryonic renal cell (HEK293) by using heterologous expression system, and cAMP measuring method was performed to determine the activity of its ability to combine with ligands. Finally, the double stranded RNA ofwas synthesized, and the physiological functions were verified by track ball behavior analysis as well as RNA interference (RNAi) technology. 【】 A complete sequence ofwas cloned with open reading frame (ORF) of 1 305 bp, encoding 434 amino acids, with a signature of 7 transmembrane domains which belongs to the superfamily of G-protein coupled receptors. This gene exhibited a close relationship with thefrombased on neighbor-joining phylogenetic tree. qRT-PCR results indicated thatwas expressed at all tested developmental stages, particularly high at the early larval stage. However, the expression ofwas not significantly different from other developmental stages. Besides, the expression ofwas remarkably higher in the central nervous system (CNS) than that in other tissues. In the process of starvation for 24 h, the expression ofsignificantly fluctuated and then returned to the normal level. The lowest expression ofwas 0.47 fold at 6 h and the highest expression was 1.80 folds at 16 h compared with control, respectively. Based on cyclic AMP response assay, it was found that TcOctR3 could be activated by octopamine (OA) in a dose-dependent manner with a median effective concentration (EC50) of 8.68×10-7mol·L-1after heterogenous expression in HEK293 cells. Naphazoline (NA) strongly activated this receptor with EC50of 8.56×10-8mol·L-1compared with other ligands. Generally, the rank order for the potency of 4 tested ligands was naphazoline>tyramine (TA)>octopamine>dopamine (DA). RNAi results indicated that the transcript level ofwas significantly knocked down 61.5% by injected the targeted dsRNA. However, no effect on the walking speed and fecundity ofadults was observed. 【】plays an important role in the central nervous system, which modulates the response of the beetle larvae upon starvation. The molecular characterizations were determined based on a cAMP assay, which will provide a solid basis for the future screening of its high efficiency agonists and inhibitors.
; octopamine receptor; expression profile; biological activity; physiological function
2017-10-30;
2017-11-24
国家自然科学基金面上项目(31772233)
刘小强,E-mail:liukf@foxmail.com。
王进军,E-mail:wangjinjun@swu.edu.cn

