茶树小G蛋白CsRAC5基因的克隆与低温胁迫下的表达分析
叶小丽,潘俊廷,朱姣姣,疏再发,崔传磊,邢安琪,农寿华,朱旭君,房婉萍,王玉花
茶树小G蛋白基因的克隆与低温胁迫下的表达分析
叶小丽,潘俊廷,朱姣姣,疏再发,崔传磊,邢安琪,农寿华,朱旭君,房婉萍,王玉花*
南京农业大学园艺学院,江苏 南京 210095
小G蛋白是一类重要的信号转导蛋白,参与植物的各项生命活动,但目前在茶树中的研究尚少。本研究以茶树品种龙井长叶为实验材料,克隆获得1个小G蛋白基因,命名为。序列分析显示,含有597 bp,编码198个氨基酸,具有Rho蛋白的保守结构域;序列多重比对发现,该序列与其他物种序列的一致性高达95.96%。CsRAC5蛋白质的相对分子质量为21.79 kDa,为亲水性蛋白;烟草瞬时表达实验显示,CsRAC5定位于细胞膜和细胞核中。荧光定量PCR结果显示,在茶树中的表达具有明显的组织特异性,其中在叶片中的表达最高,在花粉中的表达最低;低温(4℃)胁迫抑制茶树叶片中的表达。
茶树;;生物信息学分析;低温胁迫;表达分析
小G蛋白家族(Small GTPase family)是普遍存在于真核细胞中的1个GTP结合蛋白家族,是真核生物中成员数量较多的一类信号转导蛋白,有100多种,参与调控细胞的多种生命活动[1-2]{!!! INVALID CITATION !!!, ;Bourne, 1990 #79}。根据序列结构和细胞功能的相似处,小G蛋白超家族可以分为Ras(Sarcoma)、Rho(Ras homolog)、Rab(Rat brain)、Arf(ADP ribosylation factor)和Ran(Ras-related nuclear)5个亚家族[1]。植物中存在一种特殊的小G蛋白ROPs(Rho-related GTPase from plants)是Rho家族成员,由于植物中ROPs跟Rho家族成员中Rac非常相似,所以植物中特有的一类小G蛋白Rac-like GTPase or ROPs(Rho-related GTPases from plants)(RAC/ROPs)也可以称之为RACs[2]。ROP是植物中的分子开关,参与感受胞外刺激,如激素、病原体激发子以及非生物胁迫等信号,并且能够通过不同的细胞内信号转导来响应这些信号。
茶树[(L.) O.Kuntze]作为南方丘陵的一种多年生经济作物,性喜温[3]。我国许多地区的茶树受初冬骤至的寒流或早春“倒春寒”等气候的影响,茶树萌芽推迟,生长缓慢;零度以下的冻害使茶叶产量下降,成叶边缘变褐,叶片呈紫褐色,嫩叶出现“麻点”、“麻头”[4],这些成为制约广大茶区产业发展的重要问题。研究茶树对低温的响应机理对保障茶树安全越冬、预防“倒春寒”和茶树引种都具有重要意义。目前,虽然未见小G蛋白参与茶树低温胁迫的研究,但是低温胁迫可以通过诱导一系列信号转导途径,与下游的顺式作用元件特异性结合,激活下游与抗逆相关的基因的表达来提高植物的抗性。这些基因的表达受Ca2+调控[5]。一些二级信号分子,如ABA[6]、ROS[7]也可通过诱导细胞内Ca2+流动从而引发低温胁迫信号应答。越来越多的研究表明ROPs参与细胞骨架的组织动态与囊泡运输,响应激素信号[8-12],保卫细胞开放和闭合[13],H2O2的产生[14]。更重要的是植物特有蛋白家族RIC(ROP-interactive CRIB-containing protein)是RAC/ROP的下游效应因子[15],AtROP1能够激活AtRIC3通过一条Ca2+依赖的途径导致F-肌动蛋白的分解[16]。所以我们推测小G蛋白与低温胁迫之间可能存在相应的联系。
本实验从茶树品种龙井长叶的cDNA中克隆得到1个小G蛋白基因,通过生物信息学的方法对其氨基酸序列进行比对分析,并采用荧光定量PCR,探讨该基因在茶树不同组织部位的表达差异和低温胁迫下表达变化情况,为茶树在低温条件下的分子育种提供进一步的理论依据。
1 材料与方法
1.1 试验材料
本实验选用江苏省雅润茶苗繁育中心两年生龙井长叶(cv)水培苗为研究对象,取幼嫩叶提取RNA,用于后续克隆实验。另外,取栽植于南京市中山陵茶厂的5年生龙井长叶的根、茎、叶、老叶、花、果实、种子和花粉,用于后续基因表达实验。茶花采于2016年10月—11月上旬盛花期间,下午16~17时采摘处于蕾白期的花,花粉的收集方法参照陈暄等[17]报道的方法。2016年10月20日将茶苗放入RXZ型人工智能气候箱,昼夜温度25℃/20℃,光周期与暗培养周期为12 h/12 h,光照强度30 klx,相对湿度75%~80%,培养2周后将茶苗放入4℃人工气候箱低温处理。分别于处理0、1、4、8、12、24 h后取茶苗中部成熟叶片,放入液氮速冻,–70℃冰箱保存备用。
EASYspin plus植物RNA提取试剂盒和EASYspin植物快速提取试剂盒购于北京艾德莱生物科技有限公司;Taq DNA聚合酶、dNTPs、Marker、PMD®19-T Vector、RNA酶抑制剂、SYBR®Premix Ex TaqⅡ、反转录试剂盒等均购于宝生物工程(大连)有限公司。Agarose Gel DNA Purification Kit购于美国OMEGA Biotek公司。其余试剂为国产分析纯试剂。大肠杆菌菌株DH5α由南京农业大学茶叶科学研究所保存。
1.2 总RNA的提取及cDNA的合成
利用EASYspin植物快速提取试剂盒,按照说明书提取龙井长叶幼嫩叶的总RNA,并利用NanoDrop测得RNA浓度,1%的琼脂糖胶检测RNA的完整性,观察18 S、28 S条带。使用PrimeScriptTMRT reagent Kit试剂盒反转录成cDNA。
1.3 CsRAC5基因的克隆
利用本课题组已有转录组数据库[18],通过Blast比对,将推测的ROP序列与拟南芥的11个ROP氨基酸序列进行比对,发现1个目标序列与拟南芥的AtRAC5(登录号:AT1G75840)序列高度同源,命名其基因为。利用DNAMAN6.0设计ORF区全长引物,引物序列为-F:5′-ATGAGT GCTTCGAGGTTCATC-3′,-R:5′-ACAAGATACTGCAATTTTTTTG。PCR的扩增体系为20 μL:酶10 μL,ddH2O 7 μL,上游引物1 μL,下游引物1 μL,模板cDNA 1 μL。反应条件为:94℃预变性3 min;94℃变性30 s,56℃退火30 s,72℃延伸1 min,共35个循环;72℃延伸10 min。取5 μL产物进行0.8%琼脂糖凝胶电泳鉴定。按照Agarose Gel DNA Purification Kit试剂盒说明书回收PCR产物,连接到PMD-19T载体,转化到大肠杆菌DH5α。取部分菌液委托南京金斯瑞公司测序。
1.4 序列分析
将公司测序的结果,利用NCBI中的生物软件(https://www.ncbi.nlm.nih.gov)进行比对分析。使用相关程序(https://blast.ncbi.nlm.nih. gov/Blast.cgi)对获得的氨基酸序列和蛋白序列进行BLAST比对搜索和保守结构域与功能域的预测;序列多重比对使用DNAMAN6.0;蛋白质的组成成分与理化性质使用EXPASY(http://www.expasy.org)软件;ProtScale(http://web.expasy.org/cgi-bin/protscale/protscale.pl)分析其亲/疏水性质;利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)在线程序预测CsRAC5蛋白的α-螺旋、β-折叠和其他二级结构;利用COILS(http://embnet.vital-it.ch/ software/COILS_form.html)预测它们的卷曲螺旋(Coils)区域;利用TMHMM Server.2.0(http://www.cbs.dtu.dk/services/TMHMM)预测它们的跨膜结构域;利用SignalIP4.1 Server(http://www.cbs.dtu.dk/services/SignalP)进行信号肽预测。利用TargetP1.1 Server- predition results(http://www.cbs.dtu.dk/services/ ChloroP)预测它们在细胞中的定位。利用Swiss-Model(http://www.Swissmodel.expasy.org)构建蛋白质的三维结构模型。
1.5 CsRAC5亚细胞定位
将不含有终止密码子的连接到植物瞬时表达载体p576,构建由Ubiquitin启动子启动的pGreenⅡ-Hyg-UBQ10-RAC5-eGFP融合蛋白表达载体。采用冻融法将融合表达载体转入农杆菌()GV3101-pSoup中,参照Spaekes等[19]的方法侵染烟草表皮细胞,25℃暗培养3 d后使用共聚焦显微镜观察荧光信号。
1.6 CsRAC5组织表达特异性与低温处理下的表达分析
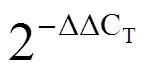
2 结果与分析
2.1 CsRAC5基因的扩增
通过本课题组原有的转录组数据,将推测的ROP序列与拟南芥的11个ROP氨基酸序列进行比对,发现一个目标序列与拟南芥的AtRAC5(登录号:AT1G75840)序列高度同源。以龙井长叶的幼嫩叶cDNA为模板,以-F和-R引物,经过PCR扩增得到一个600 bp左右的片段(图1),序列测定与分析结果表明,基因片段为597 bp,编码198个氨基酸(图2)。
2.2 生物信息学分析
2.2.1 序列比对与进化树分析
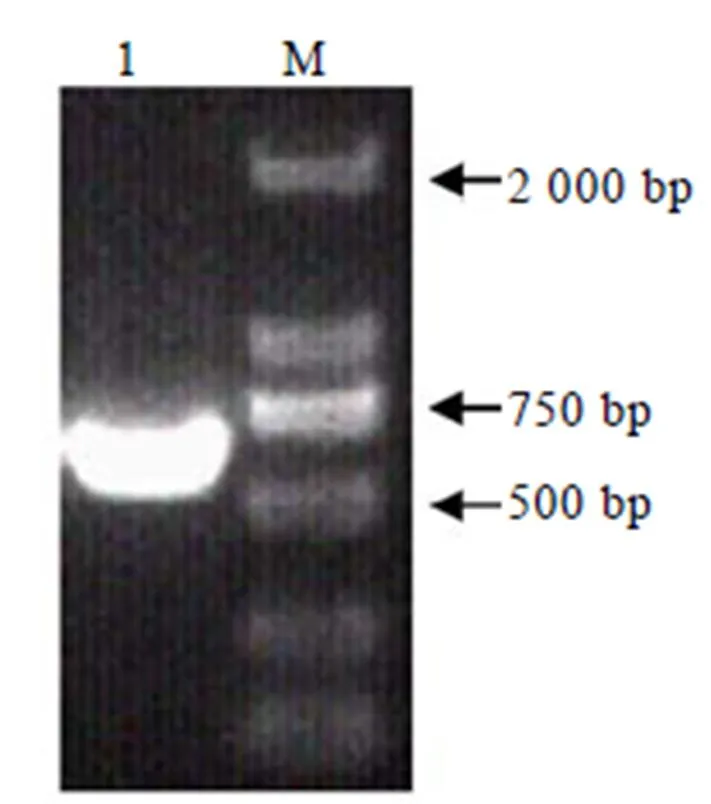
利用BLAST-conserved domains search对基因的氨基酸保守域预测(图3),CsRAC5拥有Rop-like保守结构域,9~178之间是一个Rho结合域,Rho结构域中含有GTP/GDP结合区域、Effector(下游效应因子)区域,Rho插入区域、丝氨酸/苏氨酸磷酸化位点,碱性氨基酸区域以及与碱性氨基酸区域紧邻位于C末端保守的异戊烯基化位点等保守结构。符合小G蛋白家族基因的保守区域结构特性。
注:M表示marker,1表示CsRAC5基因。

注:下划线标注的氨基酸序列为Rop-like结构域。Note: The amino acid sequences underlined mean Rop-like domain.
利用BLAST进行同源序列比对,将茶树的基因与胡杨()、巨桉()、小果野芭蕉()、油棕()、芝麻()RAC5进行多重序列比对,结果显示同源性达95.96%(图4)。
利用MEGA7.0软件将CsRAC5与拟南芥11个RAC/ROP构建系统进化树(图5),结果表明CsRAC5与AtRAC5亲缘关系最近,属于RAC/ROP四类分类法中的第Ⅳ类,此类主要调控肌动蛋白骨架组装、细胞的极性生长以及激素信号转导等[23]。
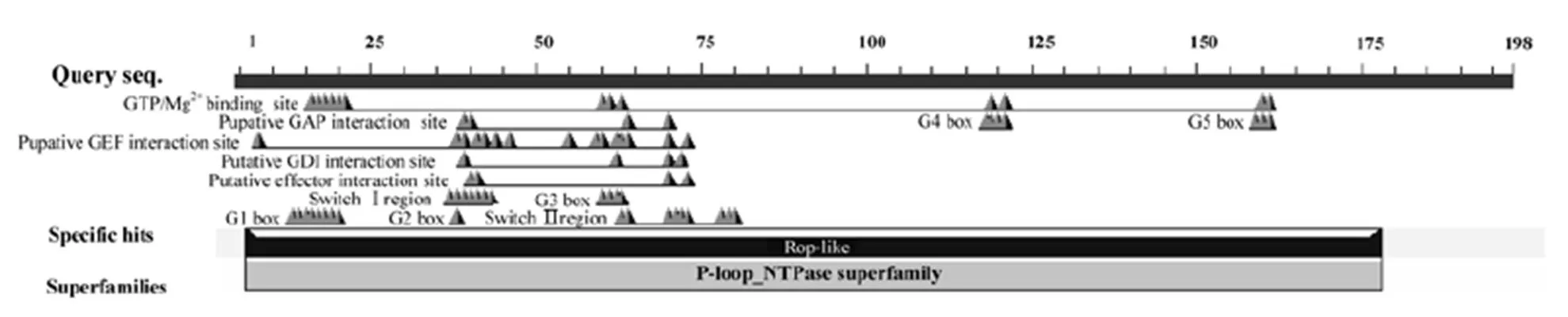
图3 CsRAC5的保守区预测

图4 茶树CsRAC5与其它物种的多序列比对
图5 茶树CsRAC5与拟南芥RAC/ROP基因的同源进化树分析
2.2.2 氨基酸组成、理化性质分析及结构预测
根据BLAST同源比对的结果,挑选不同物种中ROP相似度较高的序列,利用ExPASy- ProtParam对挑选的序列进行氨基酸组成和理化性质的分析。结果显示(表1),这些植物中小G蛋白的氨基酸数量为196~198,相对分子质量在21 500左右,理论等电点在9.3左右,正电荷氨基酸25左右,负电荷氨基酸17左右,不稳定系数在39左右,这些蛋白都属于稳定蛋白,总平均疏水性(GRAVY)均为负值,表明这些蛋白均为亲水性蛋白。
KinasePhos软件分析显示CsRAC5有11个丝氨酸(S)激酶、12个苏氨酸(T)激酶、17个酪氨酸(Y)激酶潜在磷酸化位点,0个组氨酸(H)磷酸化位点。TMHMM跨膜结构预测显示,CsRAC5不具备跨膜螺旋区。
Predict Protein蛋白质二级结构预测显示,CsRAC5含有α-螺旋(Hh)34处,延伸链(Ee)61处,β-转角(Tt)0处,无规则卷曲(Cc)103处,分别占总氨基酸的17.17%,30.81%,0,52.02%。另外,同源建模发现,CsRAC5蛋白与AtRAC5蛋白的相似性达到90%以上(图6)。
2.2.3 CsRAC5的信号肽分析和亚细胞定位
SignalIP信号肽预测显示,在CsRAC5中,C最大值出现在94位,该位置最可能出现剪切位点;S最大值出现在91位,表明该位置为信号肽部分,Y的最大值出现在94位。所以可以判断最理想的剪切位点位置在93与94之间,成熟蛋白启动的位置为94。CsRAC5蛋白质线粒体靶向肽(mTP)为0.142;叶绿体靶向肽(cTP)为0.086;分泌通路信号肽(SP)为0.367;其他形式的肽分别为0.601,说明其为其他形式的肽的可能性较大。
为了进一步阐明CsRAC5蛋白在何处发挥其生物学功能,利用农杆菌侵染烟草叶片,进行瞬时表达CsRAC5-eGFP融合蛋白。利用激光共聚焦显微镜对绿色荧光蛋白观察发现,绿色荧光信号定位在细胞核和细胞膜中(图7),我们推测CsRAC5可能在细胞核和细胞膜上行使生物学功能。
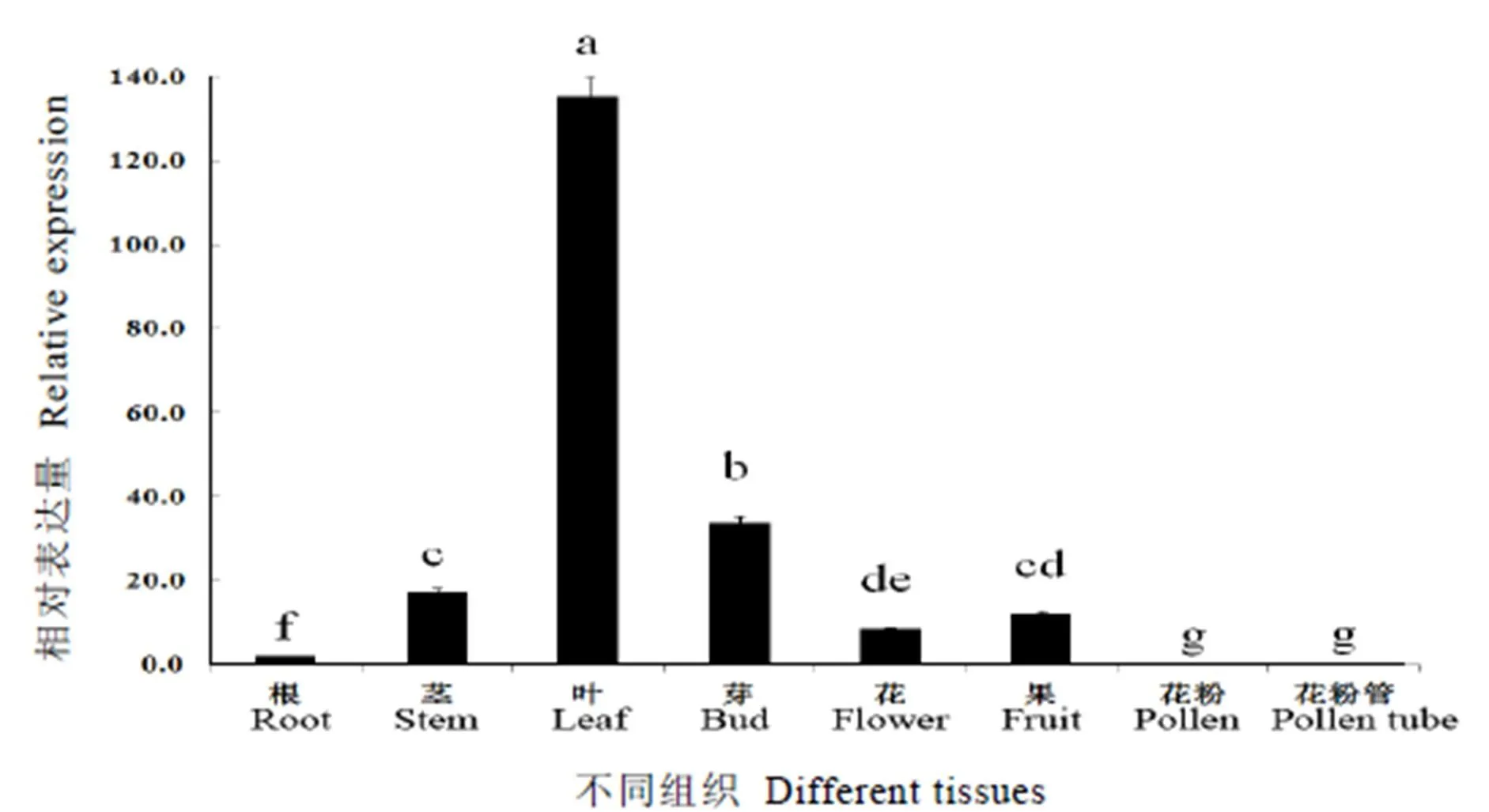
2.3 CsRAC5基因的组织特异性表达分析
提取龙井长叶的根、茎、叶、芽、花、果、花粉、花粉管的RNA,进行荧光定量PCR,分析在茶树各组织中的相对表达水平,结果显示,在叶片中的表达水平最高,其次是芽、茎、果、花、根、花粉、花粉管(图8)。表明在茶树各组织器官的表达呈现组织特异性。

图6 CsRAC5的三维结构预测

注:A:明图视野,B:荧光图,C:叠加图。Note: A: Bright field, B: Green fluorescence, C: Merge.
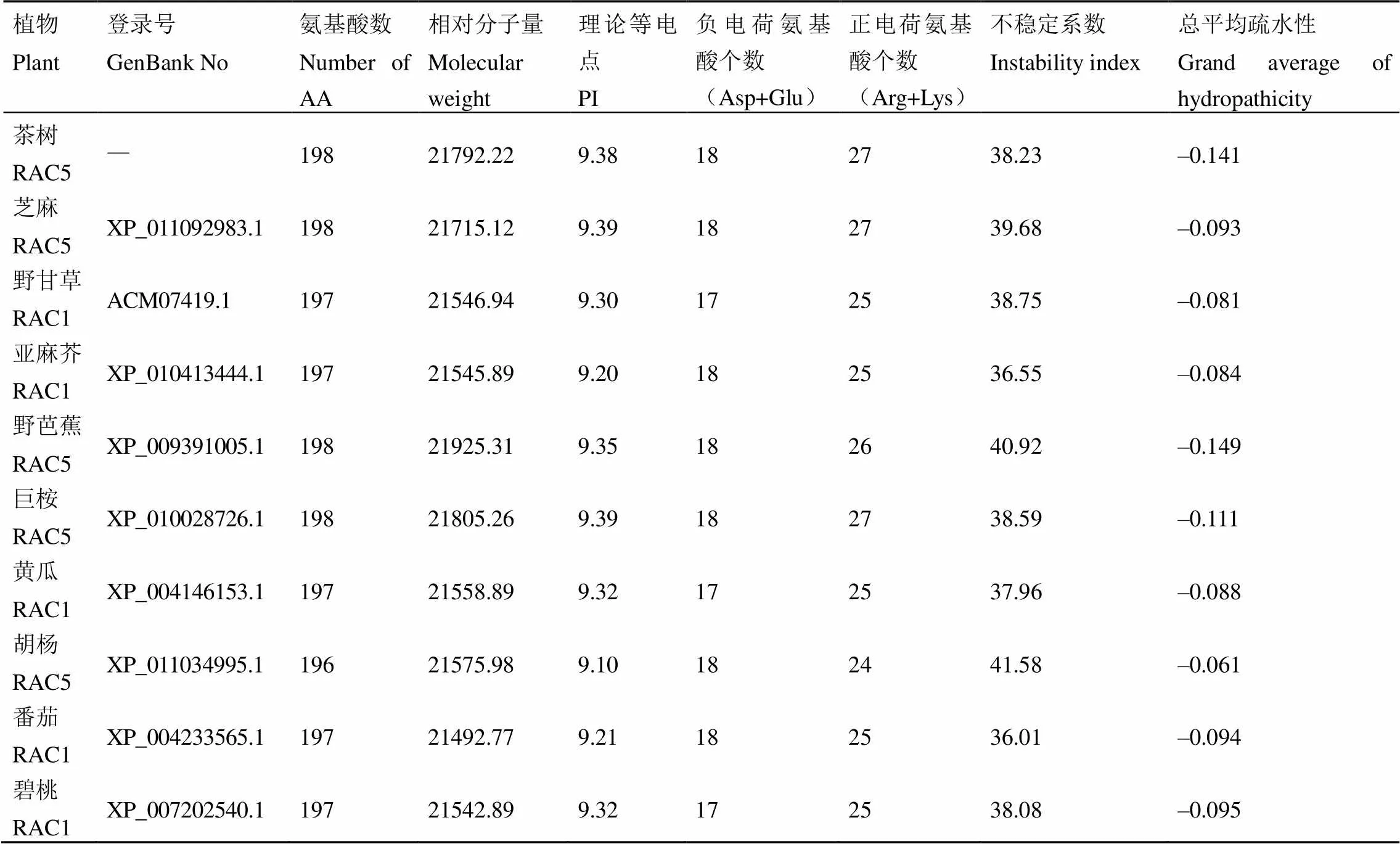
表1 不同物种中RAC氨基酸组成成分及理化性质分析
注:不同字母代表显著性差异,下同。
2.4 低温处理下CsRAC5表达量变化情况
低温处理龙井长叶水培苗1、4、8、12、24 h后的表达量与对照(0 h)相比,发现的表达量呈现先下降后上升然后相对稳定的情况(图9)。
3 讨论
通过同源序列比对和RT-PCR的方法克隆得到茶树1个小G蛋白基因,它具有典型的Rop蛋白的特征结构域,与其他植物中的Rop基因高度相似性。属于P-loop_NTPase超家族,P-loop包含三核苷酸水解酶,具有Rop-like特异性结合位点。每个小G蛋白氨基酸包含7个典型的功能区,4个保守的鸟嘌呤核苷酸结合区域,多个与下游效应分子结合位点(GAP、GEF、GDI)以及Rho插入区和膜定位信号[8]。ROP GTPase在GDP结合的非活性形式和GTP结合的活性形式之间不断转化,其活性可以受到GEFs、GAPs、GDIs的精密调控[15, 24]。ROP通过这3种蛋白的调控,介导胞外信号到胞内的传递[25]。该超家族具有特定的核苷磷酸结合形式。在其保守区域内含有鸟苷酸和5个GTPase活化位点(GⅠ-GⅣ),并且包括1个效应器分子结合域E(effector domain)和C-末端的异戊烯基化位点,Rho Insert为Rho GTPase特有的结构,另外包括switchⅠ和switchⅡ2个开关转换区域,为蛋白的2个表面环区,当围绕着GTP的γ-磷酸根结合后,蛋白就会发生构象的改变,这让鸟嘌呤核苷酸的结合区在空间上的结构更接近[25]。

图9 低温对茶树CsRAC5表达水平的影响
生物信息学分析表明CsRAC5是非跨膜的分泌型蛋白,含有多个磷酸化位点和信号肽,表明它拥有细胞信号转导功能,与茶树的生命活动以及逆境胁迫和非逆境胁迫密切相关。同源性结果表明,与同源性最高。亚细胞定位分析CsRAC5蛋白定位在细胞膜和细胞核上。组织特异性结果发现该基因在叶片中的表达水平最高,花粉管中最低,这与其他物种中该基因的组织特异性表达量不尽一致[27]。
低温处理抑制基因的表达,这一结果与王伟东等[18]的研究中低温能够抑制花粉管中该基因的表达以及Jin等[28]玉露桃冷害胁迫后ROP基因表达量显著降低相一致,ROP基因与NADPH oxidase和CCR相互作用,参与植物的冷害胁迫。我们从在低温处理过程中表达量先下降后上升,逐渐趋于平稳的表达趋势推测可能参与了茶树抵抗低温胁迫的前期信号调控,是低温胁迫下的一个短时应激蛋白,但具体调控机制还需要进一步研究。
[1] Bischoff F, Molendijk A, Rajendrakumar C S V, et al. GTP-binding proteins inplants [J]. Cellular and molecular life sciences: CMLS, 1999, 55(2): 233-256.
[2] Xu T, Wen M, Nagawa S, et al. Cell surface- and rho GTPase-based auxin signaling controls cellular interdigitation in[J]. Cell, 2010, 143(1): 99-110.
[3] 汪云刚, 矣兵, 冉隆珣, 等. 云南茶树种质资源的抗性鉴定和评价[J]. 中国农学通报, 2011, 27(13): 86-91.
[4] 杨新国. 茶树冻害发生原因及防御补救措施[J]. 现代农业科技, 2011(21): 198-198.
[5] Ma Y, Dai X, Xu Y, et al. COLD1 Confers chilling tolerance in rice [J]. Cell, 2015, 160(6): 1209-1221.
[6] Xiong L, Ishitani M, Lee H, et al. Thelocus encodes a molybdenum cofactor sulfurase and modulates cold stress- and osmotic stress-responsive gene expression [J]. The Plant cell, 2001, 13(9): 2063-2083.
[7] Lee B H, Lee H, Xiong L, et al. A mitochondrial complex I defect impairs cold-regulated nuclear gene expression [J]. Plant Cell, 2002, 14(6): 1235-1251.
[8] Bloch D, Lavy M, Efrat Y, et al. Ectopic expression of an activated RAC indisrupts membrane cycling [J]. Molecular Biology of the Cell, 2005, 16(4): 1913-1927.
[9] Lin D, Ren H, Fu Y. ROP GTPase-mediated auxin signaling regulates pavement cell interdigitation inthaliana [J]. Chinese Journal of Plant Ecology, 2015, 57(1): 31-39.
[10] Huang J B, Liu H, Chen M, et al. ROP3 GTPase contributes to polar auxin transport and auxin responses and is important for embryogenesis and seedling growth in[J]. Plant Cell, 2014, 26(9): 35013518.
[11] Xin Z, Zhao Y, Zheng ZL. Transcriptome analysis reveals specific modulation of abscisic acid signaling by ROP10 small GTPase in[J]. Plant physiology, 2005, 139(3): 1350-1365.
[12] Tao L Z, Cheung A Y, Wu H M. Plant Rac-like GTPases are activated by auxin and mediate auxin-responsive gene expression [J]. Plant Cell, 2002, 14(11): 2745-2760.
[13] Hong D, Jeon B W, Kim S Y, et al. The ROP2-RIC7 pathway negatively regulates light-induced stomatal opening by inhibiting exocyst subunit Exo70B1 in[J]. New Phytologist, 2016, 209(2): 624-635.
[14] Baxterburrell A, Yang Z, Springer P S, et al. RopGAP4-dependent Rop GTPase rheostat control ofoxygen deprivation tolerance [J]. Science, 2002, 296(5575): 2026-2028.
[15] Berken A. ROPs in the spotlight of plant signal transduction [J]. Cellular & Molecular Life Sciences Cmls, 2006, 63(21): 2446-2459.
[16] Huang S, Robinson R C, Gao L Y, et al.VILLIN1 generates actin filament cables that are resistant to depolymerization [J]. Plant Cell, 2005, 17(2): 486-501.
[17] 陈暄, 彭英, 郝姗, 等. 茶树花粉的离体萌发研究[J]. 江苏农业科学, 2010(6): 233-235.
[18] Wang W, Sheng X, Shu Z, et al. Combined cytological and transcriptomic analysis reveals a nitric oxide signaling pathway involved in cold-inhibitedpollen tube growth [J]. Frontiers in Plant Science, 2016, 7(342): 456. doi: 10.3389/fpls.2016.00456.
[19] Sparkes I A, Runions J, Kearns A, et al. Rapid, transient expression of fluorescent fusion proteins in tobacco plants and generation of stably transformed plants [J]. Nature Protocols, 2006, 1(4): 2019-2025.
[20] 孙美莲, 王云生, 杨冬青, 等. 茶树实时荧光定量PCR分析中内参基因的选择[J]. 植物学报, 2010, 45(5): 579-587.
[21] 史成颖, 李正国, 徐乾, 等. 茶愈伤组织实时定量PCR分析中内参基因的选取[J]. 安徽农业大学学报, 2014, 41(6): 905-910.
[22] Pfaffl M W. A new mathematical model for relative quantification in real-time RT–PCR [J]. Nucleic Acids Research, 2001, 29(9): e45.
[23] Zheng Z L, Yang Z B. The Rop GTPase: an emerging signaling switch in plants [J]. Plant Molecular Biology, 2000, 44(1): 1-9.
[24] Nibau C, Wu H M, Cheung A Y. RAC/ROP GTPases: 'hubs' for signal integration and diversification in plants [J]. Trends in Plant Science, 2006, 11(6): 309-315.
[25] Yang Z. Small GTPases: versatile signaling switches in plants [J]. The Plant cell, 2002, 14(Sl): S375-S388.
[26] Molendijk A J, Bischoff F, Rajendrakumar C S V, et al.Rop GTPases are localized to tips of root hairs and control polar growth [J]. Embo Journal, 2001, 20(11): 2779-2788. DOI: 10.1093/emboj/20.11.2779.
[27] 梁卫红, 李辉, 李佳佳, 等. 非生物胁迫和植物激素对与水稻OsRac5结合的含CC域蛋白编码基因和表达的影响[J]. 中国生物化学与分子生物学报, 2013, 29(4): 368-376.
[28] Jin W W, Xu C J, Xian L, et al. Expression of ROP/RAC GTPase genes in postharvest loquat fruit in association with senescence and cold regulated lignifications [J]. Postharvest Biology & Technology, 2009, 54(1): 9-14.
Cloning and Expression Analysis of Small GTPase () under Cold Stress in Tea Plant ()
YE Xiaoli, PAN Junting, ZHU Jiaojiao, SHU Zaifa, CUI Chuanlei, XING Anqi, NONG Shouhua, ZHU Xujun, FANG Wanping, WANG Yuhua*
College of Horticulture, Nangjing Agricultural University, Nanjing 210095, China
Small GTPase binding proteinsare a kind of important signal transduction proteins, which are involved in various life activities of plants.However, few relative studies were reported in tea plants (). Here, a small GTPase binding protein namedwas cloned by using a cDNA template from tea cultivar ‘Longjingchangye’. The results showed that the length of its open reading frame (ORF) is 597 bp, encoding 198 amino acids.It has a conserved Rho domain which belongs to ROP family. Multiple alignment of CsRAC5 with homologue genes in other plant species showed that their identity could reach 95.96%. CsRAC5 is a hydrophilic protein with the theoretical relative weight of 21.79 kDa. The subcellular assay showed that CsRAC5 was localized in the nuclear and membrane. In addition, the results of RT-PCR analysis showed that the highest expression level ofwas in leaves but the lowest in pollen. Theexpression level ofwas decreased undercold stress.
,, bioinformatics analysis,cold stress, expression analysis
S571.1;Q52
A
1000-369X(2018)02-146-09
2017-10-09
2017-11-25
国家自然科学基金(31770733,31370014)、连云港市科技计划项目(SF1502)、南京市科技计划项目(201608068)
叶小丽,女,硕士研究生,主要研究方向为茶树栽培育种。
wangyuhua@njau.edu.cn

