复方芦荟胶囊对消化道肿瘤患者盐酸羟考酮缓释片引起便秘的影响
李 梅
(聊城市中医医院药剂科,山东 聊城 252000)
世界卫生组织的一项调查统计数据发现,全世界每日至少有5万肿瘤患者正忍受着疼痛的折磨[1]。为了降低疼痛程度,大多数的肿瘤患者会采用阿片类药物治疗。盐酸羟考酮缓释片作为一种临床上常用的阿片类止痛药,在肿瘤患者的疼痛治疗中具有较为显著的临床效果,但极易引发药物性便秘[2-4]。盐酸羟考酮缓释片引发的便秘是不可耐受的,且伴随着止痛治疗过程,对消化道肿瘤患者的生活质量造成严重的不良影响,成为患者拒绝接受继续治疗的常见原因。本研究探讨了复方芦荟胶囊对消化道肿瘤患者盐酸羟考酮缓释片引起便秘的影响。现报告如下。
1 资料与方法
1.1 一般资料 选择2016年7月-2017年6月在我院由于服用盐酸羟考酮缓释片而引起便秘的60例消化道肿瘤患者,根据就诊先后顺序编号,采用奇偶数法随机分为2组。观察组30例,男11例,女19例;年龄36~79岁,平均(53.24 ± 12.15)岁;其中,胃癌 13例,食管癌1例,胰腺癌 2例,肝癌 7例,结 / 直肠癌 7例。对照组30例,男12例,女18例;年龄36~80岁,平均(53.92 ± 11.45)岁;其中,胃癌 12例,食管癌1例,胰腺癌 3例,肝癌 8例,结 / 直肠癌 6例。本研究获得我院伦理委员会批准,所有患者均签署知情同意书。2组的基线资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 研究方法 对照组常规口服乳果糖口服溶液(国药准字H20093300,大连美罗中药厂有限公司,100 mL:50 g),15 mL/次,3 次/d;观察组联合口服复方芦荟胶囊(国药准字Z13020306,河北万邦复临药业有限公司,0.43 g/粒), 2粒/次, 2次/d。2组均治疗1周。
1.3 疗效标准 参照《2013年中国慢性便秘诊治指南》[5],治愈:治疗后患者大便性状和次数均恢复正常;显效:治疗后患者大便性状和次数有一项恢复正常;有效:治疗后患者大便性状和次数均尚未恢复到正常水平,但与治疗前相比有一定程度的好转;无效:临床症状和体征均无明显改变。制定便秘症状评估表对2组便秘情况进行评估,评分值越高表明便秘症状越严重。包括:1)排便时间;2)排便频率;3)粪便性状。
1.4 统计学方法 采用SPSS 15.0软件,2组间计量资料对比用t检验,计数资料用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 2组临床疗效结果比较 见表 1。
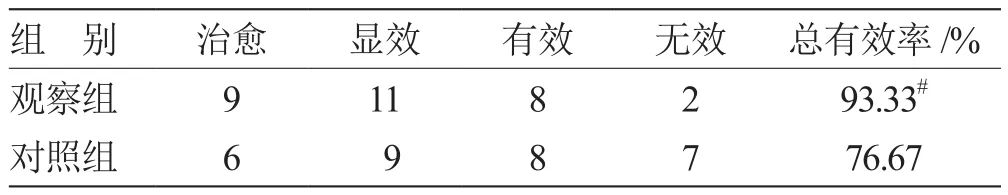
表1 2组临床疗效结果比较(n = 30) 例
2.2 2组排便时间、频率和性状计分比较 见表2。
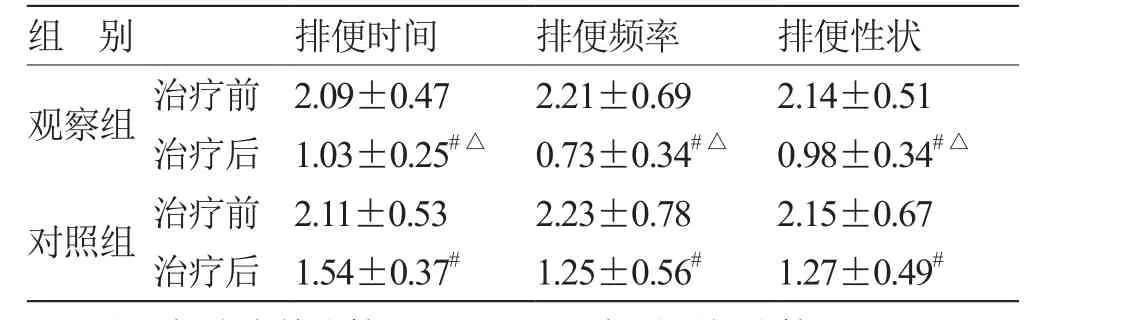
表 2 2组排便时间、频率和性状计分比较(x ± s ,n = 30) 分
3 讨论
临床上治疗便秘不能一味采用甘油灌肠或者番泻叶、大黄等泻药方法[6-12]。一方面,肿瘤患者往往身体素质较为虚弱,无法承受灌肠或泻药治疗方法;另一方面,长时间使用番泻叶或大黄,会导致大部分患者在服用时出现恶心感,特别是胃肠道反应在化疗的过程中极为明显,服用泻药不仅会产生依赖性,还会随着服药时间的增加,剂量逐渐升高,但临床治疗效果却出现显著的降低[13-15]。中医学认为,便秘主要包括阳结和阴结2种,其证治分类包括热、寒、实、虚4个方面。便秘的发病机制为大肠传导失常,其发生与脾、肺、胃、肾、肝的功能障碍具有紧密的相关性。
复方芦荟胶囊是一种国家中药保护品种,主要由青黛、芦荟、琥珀以及朱砂四味中药药材加工而成。其中,青黛具有凉血消斑,清热解毒,泻火定惊之功效,芦荟具有解毒、泻火、杀虫、化瘀之功效,琥珀具有散瘀止血、镇惊安神、利水通淋之功效,朱砂具有镇静催眠、解毒防腐之功效。诸药合用,共奏清热润肠、调肝益肾以及宁心安神之功效,临床上常用于治疗大便燥结、习惯性便秘以及由于大便多日不通导致的腹痛和腹胀等。本研究对照组常规口服乳果糖口服溶液,观察组联合口服复方芦荟胶囊,结果发现,观察组治疗的总有效率明显高于对照组,表明复方芦荟胶囊可以提高对于消化道肿瘤患者盐酸羟考酮缓释片引起的便秘的治疗效果,且在改善便秘时间、排便频率、排便性状方面较对照组显示出明显的优势。
综上所述,复方芦荟胶囊对消化道肿瘤患者盐酸羟考酮缓释片引起的便秘具有较满意的治疗效果,可以显著提高治疗有效率,改善患者的便秘症状,值得临床推广应用。
参考文献:
[1]KAASA S. Is cancer pain control improved by a simple WHO pain analgesic ladder approach combined with Tumor-Directed treatment?[J]. Journal of Clinical Oncology: Offi cial Journal of the American Society of Clinical Oncology, 2016,34(5):399-400.
[2]TOYAMA K, FURUIE H, KURODA K, et al. Pharmacokinetic bioequivalence studies of an Extended-Release oxycodone hydrochloride tablet in healthy Japanese subjects under fasting and fed conditions without an opioid antagonist[J]. Drugs in R&D, 2017, 17(3):363-370.
[3]YU Shiying, SHEN Wei, YU Lu, et al. Safety and effi cacy of once-daily hydromorphone extended-release versus twicedaily oxycodone hydrochloride controlled-release in Chinese patients with cancer pain: a phase 3, randomized, doubleblind, multicenter study[J]. The Journal of Pain: Official Journal of the American Pain Society, 2014, 15(8):835-844.
[4]ARORA S, SETNIK B, MICHAEL D, et al. A multicenter,12-month, open-label, single-arm safety study of oxycodonehydrochloride/naltrexone-hydrochloride extended-release capsules (ALO-02) in patients with moderate-to-severe chronic noncancer pain[J]. Journal of Opioid Management,2014, 10(6):423-436.
[5]向雪莲,侯晓华.《2013 年中国慢性便秘诊治指南》重点解读[J].中国实用外科杂志, 2013, 33(11):940-942.
[6]HAO Guangtao, ZHOU Haiyan, GAO Hong-zhi, et al.Pharmacokinetics of oxycodone hydrochloride and three of its metabolites after intravenous administration in Chinese patients with pain[J]. Pharmacological Reports:PR, 2014,66(1):53-158.
[7]CALDWELL G W, GAUTHIER A D, VILLANI F J, et al. Carbonyl hydration of oxymorphone and oxycodone hydrochloride[J]. Tetrahedron Letters, 2012, 32(31):3763-3766.
[8]STEFANI S, SAGGIA M, NAVES A, et al. Extended-Release oxycodone hydrochloride (oxycontin®) for cancer pain management: a cost analysis from the Brazilian public and private healthcare systems perspectives[J]. Value in Health: the Journal of the International Society for Pharmacoeconomics and Outcomes Research, 2015, 18(7):A445.
[9]CUI N N, DONG J M. Oral oxycodone hydrochloride and morphine sulfate controlled-release tablets in the treatment for moderate and severe cancer pain: a meta-analysis[J]. Journal of Chinese Oncology, 2012, 31(4):793-804.
[10]BEN-JOSEPH R, CHEN Chichang, DE A P, et al.Consequences of patient access restrictions to branded oxycodone hydrochloride extended-release tablets on healthcare utilization and costs in US health plans[J]. Journal of Medical Economics, 2014, 17(10):708-718.
[11]LIU Jin, HUANG Xin’en. Efficacy of bifidobacterium tetragenous viable bacteria tablets for cancer patients with functional constipation[J]. Asian Pacific Journal of Cancer Prevention: APJCP, 2014, 15(23):10241-10244.
[12]LAUGSAND E A, SKORPEN F, KAASA S, et al. Genetic and Non-genetic Factors Associated With Constipation in Cancer Patients Receiving Opioids[J]. Clinical and Translational Gastroenterology, 2015, 6(6):e90.
[13]HANNON B, DYCK M, POPE A, et al. Modifi ed Edmonton symptom assessment system including constipation and sleep: validation in outpatients with cancer[J]. Journal of Pain and Symptom Management, 2015, 49(5):945-952.
[14]RAUCK R, SLATKIN N E, STAMBLER N, et al.Randomized, Double-Blind trial of oral methylnaltrexone for the treatment of Opioid-Induced constipation in patients with chronic noncancer pain[J]. Pain Practice: the Offi cial Journal of World Institute of Pain, 2017, 17(6):820-828.
[15]LIU Bin, KAPLAN S L, YANG Hua, et al. Constipation causing elevated Iodine activity in the rectum mimicking thyroid cancer metastases[J]. Clinical Nuclear Medicine,2015, 40(5):442-445.

