抗菌肽抗细菌机理研究进展
单安山,田昊天,邵长轩,谭 鹏,来振衡
(东北农业大学动物营养研究所,哈尔滨 150030)
2010年南亚发生“超级细菌”事件,2016年美国出现首例“超级细菌”感染者,标志细菌耐药性危机在世界范围内爆发。从公众到国家政策,“禁抗”呼声越来越高,一个一般性生产技术问题已经演变成公共安全问题。抗生素针对细菌特定靶点或代谢通路发挥抗菌作用,细菌易发生突变获得耐药性,威胁人类健康。因此,寻找新抗菌策略成为亟待解决问题[1]。抗菌肽(Antimicrobial pep⁃tides,AMPs)抗菌机理与抗生素不同,不易产生耐药性。AMPs由生物体内特定基因转录翻译生成,是宿主抵抗病原微生物入侵,清除体内变异细胞或致癌物质一类小分子蛋白。在众多抗生素替代剂中,AMPs分布广泛、有广谱抗菌活性、抗病毒和免疫增强等作用,备受关注[2-3]。AMPs通过物理性破坏细菌细胞膜结构,使细菌内容物外渗而死亡,细菌突变某一特定结合靶点较容易,而难以改变其全部细胞膜组成与结构,细菌不易对非特异性识别菌膜的破膜机制产生耐药性,此即AMPs有望解决耐药菌问题并替代抗生素成为新型抗菌剂重要原因[4]。AMPs种类繁多,针对不同种类细菌抑菌机理不同,人工模拟脂质环境与菌膜环境存在差异,研究方法不同,结论亦不同。目前尚无涵盖所有AMPs作用机理的理论成果,加深对AMPs抑菌机理研究有助于天然AMPs改造及AMPs全新设计,对于预防AMPs产生耐药性也有重要意义。文章重点阐述AMPs与细菌膜、细菌生物被膜、胞内物质作用产生抗菌效果作用机理。
1 AMPs与细菌膜作用
AMPs在宿主体内发挥作用的主要原因是细菌膜结构与宿主体细胞膜结构存在差异。细菌膜结构中带有阴离子脂质部分暴露于表面,在宿主体细胞中,阴离子脂质部分被分解为单层,朝向细胞内侧[5]。因此,具有阳离子性特征的AMPs对细菌膜具有高细胞选择性[6]。Teixeira等报道与细菌膜相互作用的AMPs结构特性[7]。目前,开发有效作用于细菌膜结构的AMPs是未来研究方向,对此,Shao等将β转角单元插入α-螺旋结构AMPs中,成功提高了AMPs细胞选择性[8]。
1.1 革兰氏阳性菌与阴性菌不同细菌膜结构
有些种类AMPs可直接靶向作用于革兰氏阴性菌和革兰氏阳性菌细胞膜质膜组分,其中很多环形或锁套形结构AMPs,具有可结合脂质组分刚性结合位点。这种特异性结合使AMPs可靶向作用于细胞膜,而对宿主体细胞无毒性。革兰氏阳性菌细胞膜与革兰氏阴性菌细胞膜的分子组成和分层形态均有差异。
如图1所示,两种类型细菌细胞壁均由肽聚糖组成[9]。除细胞壁外,革兰氏阴性菌被位于细胞壁内侧和外侧细胞质膜及外膜两层膜包围。膜外层含作为主要脂质成分的脂多糖(Lipopolysaccharide,LPS),也是革兰氏阴性菌特有脂质物质,越来越多抗菌剂被发现可抑制该脂质合成,动态光散射试验证明AMPs可解离LPS胶束[10]。
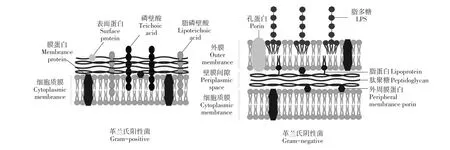
图1 革兰氏阳性菌与革兰氏阴性菌菌膜Fig.1 Schematic diagram comparing Gram-positive and Gram-negativebacterial cell membranes
AMPs可结合革兰氏阴性菌外膜,阻止周质和细胞外部溶质通过,产生细胞毒性。革兰氏阳性菌仅有一层细胞质膜,但其细胞壁较厚并含磷壁酸,主要细菌脂质组分磷脂酰甘油可通过细菌酶化学修饰,将脂质从阴离子转变为阳离子或两性离子形式,该过程中细菌对阳离子抗菌药物抗性增加,而AMPs酶抑制作用可抵抗由此产生的耐药性。细菌单层膜结构主要脂质成分包括磷脂酰甘油(Phos⁃phatidylglycerol,PG),磷脂酰乙醇胺(Phosphatidyl⁃ethanolamine,PE)和心磷脂(Cardiolipin,CL)[11]。不同种类细菌3种脂质成分含量和比例不同。除其他少量脂质成分,有些种类细菌还有大量糖基甘油二酯(Glycosyl diglycerides)。
AMPs作用机制与细菌菌膜结构关系紧密,天然AMPs大多数有一定比例正电荷氨基酸残基和疏水性氨基酸残基,几乎全部生物细胞膜结构均由磷脂类物质和膜蛋白组成,但细菌菌膜与宿主细胞膜组分存在差别,菌膜特殊结构为AMPs作用提供靶向目标。
1.2 AMPs与膜吸附结合与破坏外膜渗透性
AMPs在水溶液中不显示α-螺旋或β-折叠等典型结构,而在模拟菌膜阴性SDS溶液中则可螺旋、折叠成两亲性构象[12],AMPs与菌膜由于静电吸引作用而结合[13],这种吸引作用因革兰氏阳性菌与革兰氏阴性菌菌膜结构不同而存在差异,可解释不同细菌对AMPs敏感性不同[14]。这种菌膜与AMPs吸附结合作用,AMPs需借助菌膜多聚糖荚膜和其他结构组分,与革兰氏阴性菌外膜及革兰氏阳性菌质膜作用[15],对于革兰氏阴性菌,外膜比细胞膜更易渗透,因孔蛋白存在可渗透500Da分子[16]。AMPs首先竞争性替换与LPS相关Mg2+和Ca2+,打破菌膜结构骨架超分子组装体原有稳定性,内外膜打通。AMPs对细菌杀灭作用可能因革兰氏阴性细菌外膜渗透性反向变化引起,一般来说,所有细菌菌膜均维持一定程度渗透性,使细菌内部与细菌外介质之间交换离子和小分子,Epand等研究表明某些AMPs可通过阻断外膜渗透性从而杀灭细菌[17-18]。对于革兰氏阳性菌,其外膜结构不含LPS,而是含有带负电性磷壁酸与较厚肽聚糖层与AMPs作用。
1.3 阈浓度与构象迁移
AMPs与菌膜结合后在局部不断聚集,AMPs在细胞膜表面必须达阈浓度才能发挥杀菌作用[19]。阈浓度是指AMPs在靶目标表面发挥其生物学活性所需最低浓度,阈浓度根据不同细菌不同AMPs氨基酸组成、序列及空间构型等因素影响而变化。当小于阈浓度时,AMPs在脂质头基聚集并发挥作用,同时AMPs折叠吸附于脂质双分子层表面,与之成平行状态。当AMPs浓度增高,AMPs逐渐垂直插入、分配入双分子层疏水核心,其分配过程受AMPs浓度、菌膜组成、菌膜流动性、多聚体或自我装配偏好性、头基尺寸与化学性质、跨膜电位与pH等因素影响[20]。当高于阈浓度时,AMPs无论是深入膜定位还是连接状态下,均可促进构象变化,同样在双层拓扑结构上也能发生间接变化,如形成孔洞或衰变。当AMPs在膜表面达到破膜阈浓度时,即为最小抑菌浓度(Minimal inhibitory con⁃centration,MIC)。
AMPs与菌膜结合后,最重要过程之一是脂水界面间AMPs构象重排,目前α-螺旋结构AMPs这一过程最为清晰。根据基础热力学原理,可将AMPs与菌膜相互作用分为分配、折叠、迁移和耦合4个步骤。静电吸引和平面定位后,AMPs在菌膜上作一步关键分配和构象迁移,由此分配-折叠耦合过程形成二级结构可使AMPs分配的吉布斯自由能较低,肽键形成也会降低其分配吉布斯自由能,有助于AMPs在菌膜分配与迁移。α-螺旋结构形成受焓和ΔGhelix驱动,而熵和ΔShelix抑制α-螺旋结构形成。受分子内CO-NH中氢键形成影响,螺旋形成焓值与AMPs氨基酸序列无紧密关系。AMPs插入膜内疏水核心区域,有助于吉布斯自由能总体降低,α-螺旋和β-折叠AMPs分子内氢键能对肽键形成保护。还有其他重要因素需考虑,包括AMPs侧链填充、侧链对膜相对暴露、AMPs在膜上渗透程度等。相比之下,β-折叠AMPs通常在膜环境和水溶液中更加有序,原因在于二硫键束缚作用和β-折叠中存在固有刚性结构,而α-螺旋AMPs无此结构[21]。Catalina在两项研究中,第一次运用原子力学详细信息计算,确定地衣菌素与肽聚糖层脂质Ⅱ结构亚单位无偏相互作用途径及Cat⁃helicidins与膜表面相互作用途径[22]。
1.4 与磷脂作用造成膜物理损伤
AMPs可通过多种方式与菌膜磷脂作用,改变膜物理性质[23]。如图2所示,AMPs对磷脂作用方式主要有4种:①诱导膜物理曲率、固有曲率或流动性改变[24];②造成脂质聚集,菌膜脂质组分在膜结构中并非均匀分布,而在某些区域富集[25]。AMPs可改变脂质富集域分布,如多个带正电荷阳离子肽聚合阴离子脂质[26-28];③形成孔洞,破坏脂质与细胞膜其他分子组分相互作用及结构域,在聚集脂质和膜主体结构间形成界面断层,局部甚至全面破坏渗透屏障;④直接靶向影响细菌特定脂类。不同种类细菌膜脂质组分差别较大,细菌菌膜中CL、PG和PE与真核细胞中相应脂质有相同头基结构,但在细菌中,酰基链更短,更趋于饱和。此外,细菌菌膜阴离子脂质和PE暴露在细菌膜外表面上,在真核细胞膜中,被大量隔离于胞质表面。这些特征有助于设计针对细菌特定脂质AMPs,针对特定脂质AMPs可通过改变膜特性发挥作用。
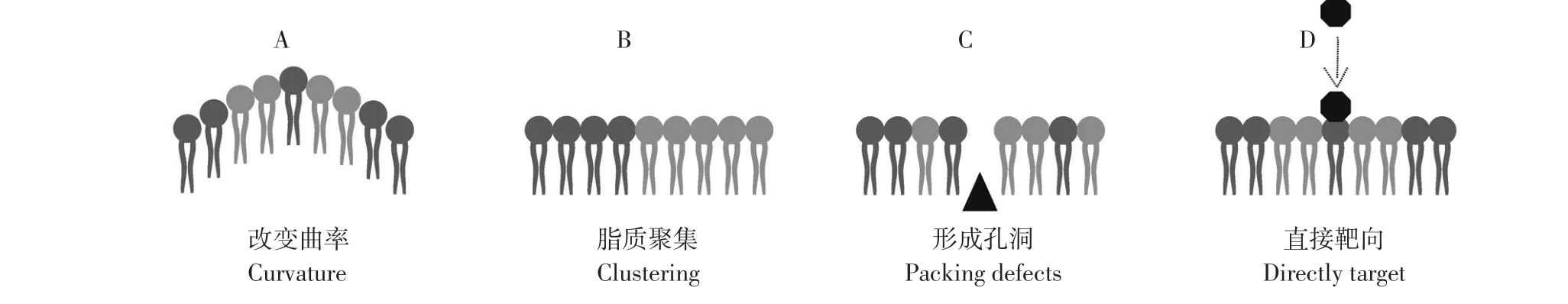
图2 AMPs对细菌细胞膜脂质成分作用方式Fig.2 Graphical representation of the different outcomes peptide antimicrobials can haveon propertiesof thebacterial cell membrane
AMPs对于菌膜脂质成分可能多种作用方式同时发生,且作用方式之间存在内在关联。例如,菌膜物理曲率改变可引起脂质聚集,形成膜孔洞,膜电位损失最终阻滞细胞新陈代谢,导致细胞死亡[29]。
1.5 AMPs破膜理论模型
不同来源AMPs对不同细菌破膜理论可能不同,AMPs由于静电吸引在细菌表面不断聚集[30-31],当菌膜上AMPs浓度达阈浓度时发生重排,由平行变为垂直于菌膜状态,AMPs由于菌膜诱导形成两亲性结构,随即插入菌膜结构中疏水核心区域,AMPs进入脂质双分子层数量和程度逐渐增加,破坏菌膜完整性,细菌细胞内容物渗出,最终死亡[32]。AMPs插入脂质双分子层,可与菌膜作用结合形成孔洞,孔洞为具导电性通道,可破坏菌膜内外跨膜电位和离子梯度浓度,导致菌体内容物渗出并死亡。
由于不同AMPs理化参数不同,机理也不同,目前有如下假说解释其破膜机理(如图3)。
①聚集通道模型:AMPs竞争性取代菌膜结构上LPS结合Mg2+和Ca2+,细胞表面超分子组成稳定性被破坏,AMPs可到达细菌外膜和内膜作用靶点,此模型中AMPs与菌膜形成极特殊脂-肽域,阴性磷脂表面两性离子被横向隔离,出现非片层脂相,干扰细胞膜,形成聚集通道。

图3 AMPs抑菌机理模型[38]Fig.3 Modelsof antimicrobial mechanism of antimicrobial peptides.
上述几种AMPs破膜理论模型假说并非完全不同,可能相互联系,菌膜孔洞形成可能是菌膜结构崩塌瓦解早期阶段,不同破膜理论模型因是AMPs作用程度不同而划分的几个连续阶段。
2 AMPs对细菌生物被膜抑制作用
细菌生物被膜(Bacterial Biofilm,BF)概念在1978年由Costerton等最早提出。通常情况下,单细菌以浮游菌形式存在,而在某些条件下,多细菌能以BF形式存在,BF指微生物群落附着于各种载体,形成多细胞结构,抵抗恶劣外界环境,细菌产生基质层可使更多细菌定植于其中,BF可附着于有机、无机物体表面,在临床治疗细菌感染上,由于BF产生抗生素耐药性对人类具有巨大威胁。AMPs对BF有破坏和抑制作用,与此同时,BF也是细菌抵抗AMPs发挥作用主要因素之一[39],近年众多研究针对AMPs对BF抑制作用,如AMPs与大肠杆菌(Escherichia coli,E.coli)、铜绿假单胞菌(Pseudomonasaeruginosa,P.aeruginosa)、变形链球菌(Streptococcus mutans,S.mutans)、牙龈卟啉单胞菌(Porphyromonasgingivalis,P.gingivalis)等菌种BF作用,对AMPs实际应用与预防AMPs耐药菌有重要意义,AMPs也有望成为治疗BF感染理想药物。
2.1 BF成因与组成
浮游细菌若附着在物体表面易形成BF,被细菌分泌的胞外黏质物(Extracellular slime substance,ESS)包裹。BF是一种高度组织化的多细胞结构,其中包含蛋白质、核酸、多糖、肽聚糖、磷脂、水通道等[40]。BF基质是胞外聚合物(Extracellular poly⁃meric substance,EPS),附着型微生物表面EPS由其自身分泌,可使营养物质、空气、水等通过,EPS包括胞外蛋白、胞外多糖和eDNA,EPS能增强微生物抗性,也与BF稳定性密切相关。其中胞外蛋白是EPS主要组分,使BF稳固形成。胞外多糖是一种巨大网型高分子聚合物骨架,可让蛋白质、脂类、核酸及碳水化合物等附着在其表面[41]。溶解细胞分泌eDNA与BF附着作用紧密相关[42]。
2.2 BF形成影响因素
探究BF形成因素及影响结构稳定性因素有助于设计对BF有抑制作用的AMPs。细菌与载体由于静电吸引而发生黏附,多数产生与形成BF细菌带有负电荷[43],因此,带有正电荷载体更易形成BF。细菌也可在带有正电荷载体表面聚集,细菌通过胞外细胞器克服静电排斥,如利用鞭毛等粘附于载体表面。现实中,细菌附着载体普遍处于离子浓度较高的溶液环境中,这些离子和小分子物质会吸附于载体表面,通过改变载体表面特性,影响细菌对载体表面静电吸附作用。若溶液中离子和小分子物质能够通过扩散及质量传递吸附使得载体带正电荷,细菌和载体作用增强,若使载体带负电荷,则吸附作用减弱。
载体表面疏水性也影响BF形成,但目前研究对此存在争议,一般疏水性界面不利于细菌黏附,BF形成与成熟速度也较慢。也有与此相悖研究结果,Heistad等研究表明,BF形成及其发展成熟与载体界面疏水性无显著关系[44]。不同研究结果与载体材料、菌种种类特性相关,应在特定条件下判定亲疏水性载体界面对BF形成及其结构稳定性影响。
载体界面形态结构即粗糙度对BF形成影响较大,在纳米与微米级条件下,增加载体界面与细菌接触面积可增强粘附作用,在液体流动相中,粗糙相对接触面使BF中细菌更加牢固,不易脱落。有些表面形态载体更不利于BF形成,如仿鲨鱼皮纳米级材料,细菌富集量甚至少于光滑界面载体,Hochbaum等研究也显示,载体界面一定程度空间阻隔会抑制细菌粘附与BF形成,这种形态的载体界面对BF抑制作用极具研究价值[45]。
2.3 AMPs对BF抑制机理
无耐药性菌种遇不利环境若形成BF,BF深处细菌难以杀灭,产生耐药性,说明多细胞结构是BF耐药性产生基础。采用耗散粒子动力学研究方法(DPD),发现包含带有正电荷并具两亲性的AMPs静电相互作用吸附到带有负电荷细菌细胞膜表面,结果显示AMPs通过疏水作用插入细胞膜形成孔洞,转移到BF内壁。AMPs对细菌细胞膜破坏可能导致BF屏障作用受损从而增加BF通透性。AMPs破坏BF结构,细菌从BF结构中脱落,成为浮游菌,对AMPs敏感性明显恢复。
当液体介质中AMPs浓度大于或等于最小抑菌浓度时,AMPs可杀死液体中悬浮细菌抑制BF形成,也可杀死液体流动相中由BF脱落的分离细菌。AMPs对BF形成影响可用结晶紫定量法与激光共聚焦染色法检测。当AMPs浓度低于最小抑菌浓度时,AMPs可通过与载体界面结合,或者与细菌表面、EPS组分结合抑制BF形成[46]。AMPs可通过干扰基因表达,如参与干扰修饰、基质合成等基因表达,使控制BF生存类型基因调节异常,也能针对产生严禁反应ppGpp信号分子等方式抑制BF形成[47]。
本实验室观察不同AMPs对大肠杆菌(Esche⁃richia coli,E.coli)、铜绿假单胞菌(Pseudomonas aeruginosa,P.aeruginosa)等在载体表面粘附性影响,由此探究AMPs能否抑制BF形成。随后分别利用结晶紫定量和激光共聚焦显微镜(Confocal laser scanning microscope,CLSM)测定AMPs对BF的作用。结晶紫能够与BF中胞外多糖及细胞壁物质结合,由结晶紫含量测定BF含量。用扫描电子显微镜观测BF细胞形态变化,研究表明,经优化AMPs序列抗BF活性较强[48]。
3 AMPs对细菌胞内杀伤作用机制
目前,大部分天然和改造AMPs或AMPs衍生物对细菌作用靶点在细胞膜,AMPs抑菌机理研究主要关注AMPs对细菌细胞膜作用,尽管形成膜孔洞可致细菌死亡,但越来越多研究表明AMPs抑菌机理不仅局限于此。AMPs具有多种作用模式,随研究不断深入,发现AMPs对菌膜作用只是第一步,近年有许多研究将AMPs作用靶位点指向胞内[49],包括抑制重要细胞功能,如作用于特异性酶或者抑制DNA转录和蛋白质翻译[50]。有些AMPs影响胞内蛋白质相互作用及酶促级联和胞质溶胶信号传导途径,或转位进入细胞并损害细胞内细胞器[51]。AMP-jsa9有多重作用模式,既能靶向作用于蜡状芽孢杆菌细胞壁和膜,破坏膜完整性,增加膜透性并增强细胞质泄漏,此外,AMP-jsa9还可结合DNA并分解蜡状芽孢杆菌生物膜[52]。
将来自牛的中性白细胞Bac7与大肠杆菌作用1~2 h,在活菌数减少2~5个数量级条件下,对大肠杆菌菌膜并无破坏作用。随研究不断深入,有些AMPs可通过膜转运穿透细胞膜进入细胞内部与生物大分子结合并发挥抗菌作用[53],如与核酸和蛋白质作用,从而调控细菌基因转录、翻译、表达[54],或抑制某些蛋白酶活性及某些功能发挥杀死细菌[55]。也有一些富含脯氨酸AMPs通过与细胞质结合导致细菌死亡,人类β-防御素3可通过激活特定抗原提呈细胞(单核细胞、树突状细胞),刺激适应性免疫表达,人嗜中性粒细胞肽1(Human neutrophil peptide-1,HNP1)及人 β-防御素 3(Hu⁃man beta-defensin 3,HBD3)均有与细菌细胞壁前体结合能力[56]。
3.1 AMPs对细菌核酸大分子作用
AMPs与胞内核酸大分子(DNA和RNA)靶点结合,是AMPs胞内作用最重要模式之一,可破坏细菌遗传系统,影响其复制、转录过程。不同AMPs对核酸大分子具体作用也不相同。
来源于牛的嗜中性粒细胞Indolicidin可与细菌DNA作用,有效阻断胸腺嘧啶结合,抑制DNA复制与合成,使大肠杆菌丝状化。基于Indolicidin改造得衍生肽IN3、IN4有更强DNA结合能力,同时抗菌活性更高[57]。
来源于新疆家蚕Cecropin-XJ可与金黄色葡萄球菌染色体DNA作用,使DNA紫外吸收值显著升高,且荧光强度显著增强,能够与溴化乙锭竞争性结合DNA,抑制金黄色葡萄球菌DNA复制。由此推测,Cecropin-XJ通过静电引力与DNA磷酸基团结合,由于结合体空间发生改变,与DNA双螺旋结构小凹槽结合,可全嵌入或半嵌入DNA中,产生增色效应[58]。本实验室应用凝胶阻滞试验检测AMPs能否与DNA结合,进而影响DNA在琼脂糖凝胶电泳中迁移率[59]。可与核酸作用AMPs种类较多,详见表1[60]。

表1 AMPs对细菌核酸作用Table 1 Action of AMPs against thenucleic acids of bacterium
3.2 AMPs对细菌胞内功能蛋白和酶作用
AMPs对胞内功能蛋白或酶作用可分为直接作用和间接作用两类。一类是AMPs与胞内核酸作用,影响功能蛋白或酶合成与修饰,最终影响其功能。例如来源于大肠杆菌编码细菌素MccJ25、Mukhopadhyay等被发现能够与RNA聚合酶结合,阻断RNA聚合酶中一条通道,此通道具有用来合成RNA所需碱基、排出合成代谢副产物双向运输作用,由于底物与酶活性中心无法结合,最终抑制RNA聚合酶活性。MccJ25还可抑制琥珀酸脱氢酶与NADH脱氢酶活性,这两种酶在呼吸链中发挥重要作用,改变氧消耗速率。
apidaecin、drosocin和pyrrhocoricin等一类富含脯氨酸AMPs与细菌胞内热休克蛋白Dnak靶向结合,并抑制其ATPase活性,分子伴侣协助功能蛋白质不能折叠,细菌最终死亡。
histatin5能穿透细胞质膜,在线粒体内聚集,破坏F1F0-ATPase活性,使线粒体内ATP合成减少[61]。另外发现apidaecin在抑制细胞分裂蛋白酶FTSH的同时增强UDP-3-O-酰基-N-乙酰氨基脱乙酰基酶活性,打破磷-脂比例平衡,造成细菌代谢状态紊乱[62]。AMPs可与酶或功能性蛋白直接作用,此类AMPs种类较多,代表性AMPs见表2[63]。
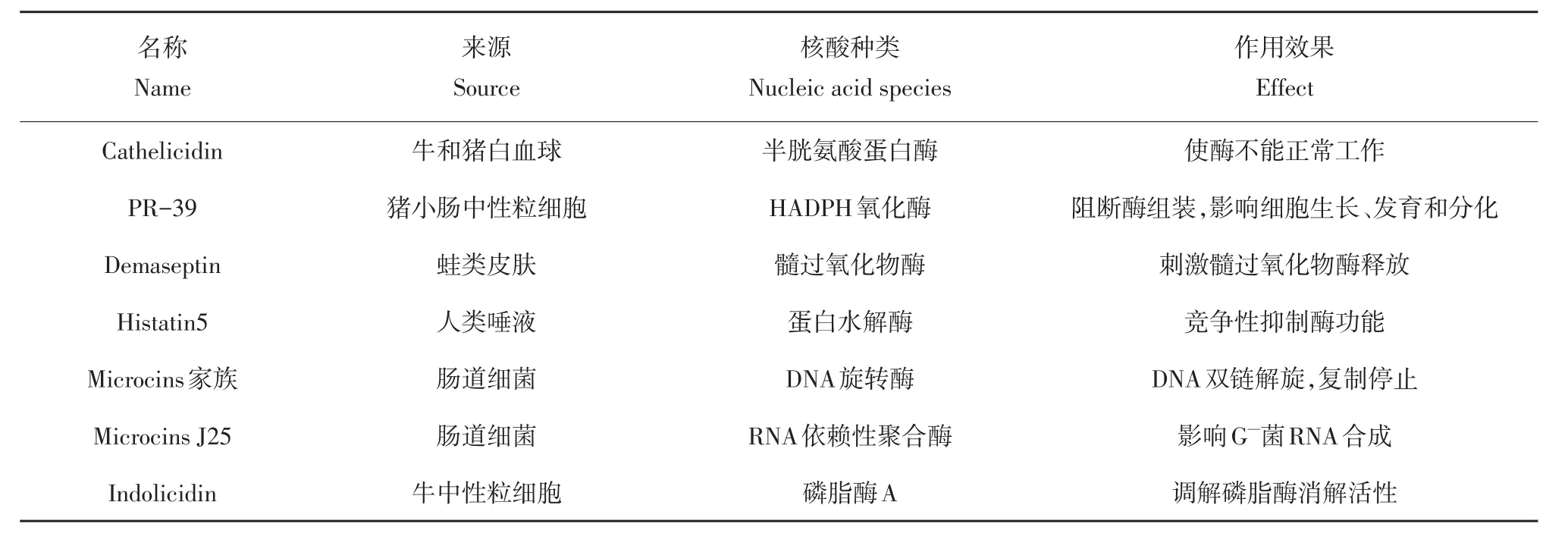
表2 AMPs对细菌酶作用Table 2 Action of AMPs against theenzymes of bacterium
4 小结与展望
综上所述,AMPs与抗生素相比有不同抗菌机理,细菌难以对AMPs产生耐药性。不同来源AMPs对于不同种类、不同状态菌种抑菌机理不同。有些AMPs可在菌膜模拟环境螺旋、折叠成两亲性构象,静电吸引使AMPs聚集于菌膜,在革兰氏阳性菌和革兰氏阴性菌菌膜结构中分别特有脂多糖和磷壁酸为AMPs作用提供靶向目标,而后AMPs可与磷脂作用造成膜物理损伤。有些种类AMPs可穿过菌膜,与胞内核酸、酶等生物大分子结合从而发挥抗菌作用。AMPs杀灭细菌也可通过胞内与胞外协同模式发挥作用。某些AMPs可破坏或抑制细菌生物被膜形成,对解决耐药性危机具有重要意义。
进一步探究AMPs抗菌机理有助于更深入理解不同类型AMPs发挥作用的微观过程,有助于解释组成AMPs蛋白质结构功能关系,有助于改造与设计杀菌效果好、细胞选择性高、难以产生耐药性应用型AMPs。AMPs作为新一代抗菌药物、饲料添加剂与食品添加剂应用前景广阔,有望与抗生素协同使用或全面替代抗生素,在医药卫生、畜牧、食品等领域发挥重要作用。
[参考文献]
[1] Reardon S.USvows to combat antibiotic resistance[J].Nature,2014,513(7519):471.
[2] 单安山,马得莹,冯兴军,等.新型抗生素替代品-重组抗菌剂类蛋白的研究[J].东北农业大学学报,2009,40(8):117-122.
[3] Da C J P,Cova M,Ferreira R,et al.Antimicrobial peptides:An alternative for innovative medicines?[J].Applied microbiology and biotechnology,2015,99(5):2023-2040.
[4] Deslouches B,Steckbeck JD,Craigo JK,et al.Engineered cationic antimicrobial peptides to overcome multidrug resistance by ES⁃KAPEpathogens[J].Antimicrobial agents and chemotherapy,2015,59(2):1329-1333.
[5] Alves D,Olívia PM.Mini-review:Antimicrobial peptides and en⁃zymes as promising candidates to functionalize biomaterial surfac⁃es[J].Biofouling,2014,30(4):483-499.
[6] Golbek T W,Franz J,Elliott F J,et al.Identifying the selectivity of antimicrobial peptides to cell membranes by sum frequency generation spectroscopy[J].Biointerphases,2017,12(2):406-419.
[7] Teixeira V,Feio M J,Bastos M.Role of lipids in the interaction of antimicrobial peptides with membranes[J].Progress in lipid research,2012,51(2):149-177.
[8] Shao C,Tian H,Wang T,et al.Centralβ-turn increases the cell selectivity of imperfectly amphipathicα-helical peptides[J].Acta Biomaterialia,2018,69:243-255.
[9]Epand R M,Walker C,Epand R F,et al.Molecular mechanisms of membrane targeting antibiotics[J].Biochimica et Biophysica Acta(BBA)-Biomembranes,2016,1858(5):980-987.
[10] Shen M,Dong W,Qian J,et al.Antimicrobial activity and mem⁃brane interaction mechanism of the antimicrobial peptides derived from Rana chensinensis with short sequences[J].Biologia,2017,72(9):1-13.
[11] Epand R M,Epand R F.Bacterial membrane lipids in the action of antimicrobial agents[J].Journal of Peptide Science,2011,17(5):298-305.
[12] Zhu X,Dong N,Wang Z,et al.Design of imperfectly amphipathic α-helical antimicrobial peptides with enhanced cell selectivity[J].Acta Biomaterialia,2014,10:244-257.
[13] Travkova OG,Brezesinski G.Adsorption of theantimicrobial pep⁃tide arenicin and its linear derivative to model membranes-A maximum insertion pressure study[J].Chemistry and Physics of Lipids,2013,167(1):43-50.
[14] Yount N Y,Yeaman M R.Peptide antimicrobials:Cell wall as a bacterial target[J].Annals of the New York Academy of Sciences,2013,1277(1):127-138.
[15] 单安山,吕希婷,马清泉,等.猪凝血酶C端衍生肽抑菌活性和膜作用机制研究[J].东北农业大学学报,2016,47(4):1-9.
[16] Lam N H,Ma Z,Ha B Y.Electrostatic modification of the lipo⁃polysaccharide layer:Competing effects of divalent cations and polycationic or polyanionic molecules[J].Soft Matter,2014,10(38):7528-7544.
[17]Epand RF,Mowery BP,Lee SE,et al.Dual mechanismof bacte⁃rial lethality for a cationic sequence-random copolymer that mim⁃ics host-defense antimicrobial peptides[J].Journal of Molecular Biology,2008,379(1):38-50.
[18] Epand R F,Sarig H,Mor A,et al.Cell-wall interactions and the selective bacteriostatic activity of a miniature oligo-acyl-lysyl[J].Biophysical Journal,2009,97(8):2250-2257.
[19] Melo M N,Ferre R,Castanho M A R B.Antimicrobial peptides:linking partition,activity and high membrane-bound concentra⁃tions[J].Nature Reviews Microbiology,2009,7(3):245.
[20] Teixeira V,Feio M J,Bastos M.Role of lipids in the interaction of antimicrobial peptides with membranes[J].Progress in Lipid Research,2012,51(2):149-177.
[21] Bechinger B.Rationalizing the membrane interactions of cationic amphipathic antimicrobial peptides by their molecular shape[J].Current Opinion in Colloid and Interface Science,2009,14(5):349-355.
[22] Catalina D M A.Elucidating the mechanism of action of antimi⁃crobial peptides by means of computational approaches[J].Tech⁃nische Universität Berlin,2017.
[23] Marquardt D,Kučerka N,Katsaras J,et al.α-Tocopherol's loca⁃tion in membranes is not affected by their composition[J].Lang⁃muir,2014,31(15):4464-4472.
[24] Epand R M,D'Souza K,Berno B,et al.Membrane curvature mod⁃ulation of protein activity determined by NMR[J].Biochimica ET Biophysica Acta,2015,1848(1):220-228.
[25]Epand R M,Epand R F.Domains in bacterial membranes and the action of antimicrobial agents[J].Molecular Biosystems,2009,5(6):580-587.
[26] Epand R M,Epand R F.Bacterial membrane lipids in the action of antimicrobial agents[J].Journal of Peptide Science,2011,17(5):298-305.
[27] Epand R F,Wang G,Berno B,et al.Lipid segregation explains selective toxicity of a series of fragments derived from the human cathelicidin LL-37[J].Antimicrobial Agents and Chemotherapy,2009,53(9):3705-3714.
[28] Epand R M,Rotem S,Mor A,et al.Bacterial membranes as pre⁃dictorsof antimicrobial potency[J].Journal of the American Chem⁃ical Society,2008,130(43):14346-14352.
[29] Vineethkumar T V,George S.a review of the mechanism of ac⁃tion of amphibian antimicrobial peptides focusing on peptide-membrane interaction and membrane curvature[J].Current Pro⁃tein and Peptide Science,2017,18(12):1263-1272.
[30] Bugg T D H,Braddick D,Dowson C G,et al.Bacterial cell wall assembly:Still an attractive antibacterial target[J].Trends in Biotechnology,2011,29(4):167-173.
[31] Hanson B R,Neely M N.Coordinate regulation of Gram-positive cell surface components[J].Current Opinion in Microbiology,2012,15(2):204-210.
[32] Lai P K,Kaznessis Y.Insights into protegrin antimicrobial pep⁃tides membrane translocation by multistep molecular dynamics simulations[J].Bulletin of the American Physical Society,2018.
[33] Irudayam SJ,Berkowitz M L.Binding and reorientation of melit⁃tin in a POPC bilayer:Computer simulations[J].Biochimica et Biophysica Acta,2012,1818(12):2975-2981.
[34] Brogden K A.Antimicrobial peptides:Pore formers or metabolic inhibitors in bacteria?[J].Nature Reviews Microbiology,2005,3(3):238.
[35] Jenssen H,Hamill P,Hancock R E W.Peptide antimicrobial agents[J].Clinical microbiology reviews,2006,19(3):491-511.
[36] Manzini M C,Perez K R,Riske K A,et al.Peptide:lipid ratioand membrane surface charge determine the mechanism of action of the antimicrobial peptide BP100.Conformational and functional studies[J].Biochimica ET Biophysica Acta,2014,1838(7):1985-1999.
[37] Wimley W C.Describing the mechanism of antimicrobial peptide action with theinterfacial activity model[J].ACSchemical biology,2010,5(10):905-917.
[38] Jenssen H,Hamill P,Hancock R E W.Peptide antimicrobial agents[J].Clinical Microbiology Reviews,2006,19(3):491-511.
[39] Fuente-Núñez CDL,Reffuveille F,Fernández L,et al.Bacterial biofilm development as amulticellular adaptation:antibiotic resis⁃tance and new therapeutic strategies[J].Current Opinion in Micro⁃biology,2013,16(5):580-589.
[40] Rabin N,Zheng Y,Opoku-Temeng C,et al.Biofilm formation mechanisms and targets for developing antibiofilm agents[J].Future,2015,7(4):493-512.
[41] Nwodo U U,Green E,Okoh A I.Bacterial exopolysaccharides:functionality and prospects[J].International Journal of Molecular Sciences,2012,13(11):14002-14015.
[42] Das T,Sharma P K,Busscher H J,et al.Role of extracellular DNA in initial bacterial adhesion and surface aggregation[J].Applied and Environmental Microbiology,2010,76(10):3405-3408.
[43] Soni K A,Balasubramanian A K,Beskok A,et al.Zeta potential of selected bacteria in drinking water when dead,starved,or exposed to minimal and rich culture media[J].Current Microbi⁃ology,2008,56(1):93-97.
[44] Heistad A,Scott T,Skaarer A M,et al.Virus removal by unsatu⁃rated wastewater filtration:effects of biofilm accumulation and hydrophobicity[J].Water Science and Technology,2009,60(2):399-407.
[45] Hochbaum A I,Aizenberg J.Bacteria pattern spontaneously on periodic nanostructure arrays[J].Nano Letters,2010,10(9):3717-3721.
[46] 徐博成,王家俊,丑淑丽,等.细菌对AMPs的抗性及机理[J].动物营养学报,2017,29(6):1874-1883.
[47] Batoni G,Maisetta G,Esin S.Antimicrobial peptides and their interaction with biofilms of medically relevant bacteria[J].Biochi⁃mica ETBiophysica Acta,2016,1858(5):1044-1060.
[48]Xu W,Zhu X,Tan T,et al.Design of Embedded-Hybrid Antimi⁃crobial Peptides with Enhanced Cell Selectivity and Anti-Biofilm Activity[J].Plos One,2014,9(6):98935.
[49] Bahnsen JS,Franzyk H,Sayers E J,et al.Cell-penetrating anti⁃microbial peptides-prospectives for targeting intracellular infec⁃tions[J].Pharmaceutical Research,2015,32(5):1546-1556.
[50] Benincasa M,Runti G,Mardirossian M,et al.methods for eluci⁃dating the mechanism of action of proline-rich and other non-lyt⁃ic antimicrobial peptides[J].Methods Mol Biol,2017:283-295.
[51] Bastos P,Trindade F,Costa JD,et al.human antimicrobial pep⁃tides in bodily fluids:Current knowledge and therapeutic perspec⁃tives in the postantibiotic era[J].Medicinal Research Reviews,2018,38(1):101-146.
[52] Han J,Zhao S,Ma Z,et al.The antibacterial activity and modes of LI-F type antimicrobial peptides against Bacillus cereus in vitro[J].Journal of Applied Microbiology,2017,123(3):602-614.
[53] Lohner K.Membrane-active antimicrobial peptides as template structures for novel antibiotic agents[J].Current Topics in Medici⁃nal Chemistry,2017,17(5):508-519.
[54] Sharma A,Pohane A A,Bansal S,et al.Cell penetrating synthetic antimicrobial peptides(SAMPs)exhibiting potent and selective killing of Mycobacterium by targeting its DNA[J].Chemistry-A European Journal,2015,21(9):3540-3545.
[55] Scocchi M,Lüthy C,Decarli P,et al.The proline-rich antibacteri⁃al peptide Bac7 binds to and inhibits in vitro the molecular chap⁃erone DnaK[J].International Journal of Peptide Research and Therapeutics,2009,15(2):147-155.
[56] Leeuw E D,Li C,Zeng P,et al.Functional interaction of human neutrophil peptide-1 with the cell wall precursor lipidⅡ[J].Febs Letters,2010,584(8):1543-1548.
[57] Nan Y H,Park K H,Park Y,et al.Investigatingtheeffects of posi⁃tive charge and hydrophobicity on the cell selectivity,mechanism of action and anti-inflammatory activity of a Trp-rich antimicro⁃bial peptide indolicidin[J].Fems Microbiology Letters,2009,292(1):134-140.
[58] 刘忠渊.新疆家蚕AMPs结构与功能的关系及抗菌作用机理的研究[D].乌鲁木齐:新疆大学,2008:30-32.
[59] Wang J J,Chou S L,Xu L,et al.High specific selectivity and membrane-activemechanism of thesynthetic centrosymmetricαhelical peptides with gly-gly pairs[J].Scientific Reports,2015,5:1-19.
[60] 衣同辉.五种AMPs的设计、原核表达和抗菌作用机理研究[D].长春:吉林大学,2014.
[61] Luque-Ortega J R,van't Hof W,Veerman E C I,et al.Human antimicrobial peptide histatin 5 is a cell-penetrating peptide targeting mitochondrial ATP synthesis in Leishmania[J].The Faseb Journal,2008,22(6):1817-1828.
[62]Zhou Y,Chen WN.iTRAQ-coupled 2-D LC-MS/MSanalysis of membrane protein profile in Escherichia coli incubated with apidaecin IB[J].Journal of Proteomics,2011,75(2):511-516.
[63] 徐奇友.绿色饲料添加剂[M].哈尔滨:东北林业大学出版社,2008.

