美拉德反应对泥鳅蛋白酶解产物抗氧化性能的强化研究
,,,,, ,,*,,,
(1.浙江海洋大学食品与医药学院,浙江舟山 316022; 2.浙江海洋大学经济与管理学院,浙江舟山 316022; 3.浙江省海产品健康危害因素关键技术研究重点实验室,舟山市疾病预防控制中心,浙江舟山 316021)
泥鳅是我国主要的水产品之一,其蛋白质含量高达17.4%[1-3]。目前对泥鳅的功能性质的研究主要集中在其粘液[4-6]功能因子方面,对蛋白质的研究较少。现有的研究表明,从泥鳅中提取的蛋白、多糖、氨基酸等,具有提高机体免疫力、抗炎、抗氧化等作用[7-8]。游丽君[9]通过蛋白酶水解泥鳅蛋白,得到了具有较好抗氧化、抗肿瘤效果的肽类物质。但是,仅通过酶法水解得到的抗氧化功能物质稳定性较差,其后续的加工、利用率和推广都受到了限制。基于此,制备出具有显著抗氧化功效且性质稳定的酶解产物,对泥鳅蛋白的深度开发尤为重要。
美拉德反应又称为“非酶棕色化反应”,是羰基化合物(还原糖类)和氨基化合物(氨基酸和蛋白质)间的反应,由法国化学家L C Maillard在1912年提出[10]。由于很多美拉德反应产物(Maillard reaction products,MRPs)能够使食品增香增色且安全性较高,被广泛应用于食品加工中。此外,人们还发现美拉德反应产物中的还原酮、类黑精和一系列含硫、氮的挥发性杂环化合物具有很强的抗氧化性,有些甚至能和常用的食品抗氧化剂相媲美[11]。由于化学合成抗氧化剂本身具有一定程度的毒副作用,因此,目前将美拉德反应作为提高某些食品抗氧化功能的手段成为了趋势和研究热点[12]。大量研究证明,美拉德反应能有效提高酶解产物的功能活性[13-15],如秦晓辉[17]通过美拉德反应极大地提升了珍珠蚌多肽的抗氧化能力[16];陈贵堂等采用抗氧化肽与果糖美拉德反应提高灰树花多肽的抗氧化活性;李婷等[18]以黄鲫蛋白抗菌肽(HAHp)为底物,比较了HAHp-葡萄糖、HAHp-蔗糖、HAHp-麦芽糖和HAHp-乳糖的美拉德反应物抑菌活性;乔路等[19]用美拉德反应处理皱纹盘鲍脏器肽,与反应前相比,美拉德反应产物的DPPH自由基清除活性增强百倍,而羟自由基清除活性及还原活性也增强数十倍。然而,用美拉德反应来提高泥鳅肉水解产物的抗氧化活性的研究鲜有报道。因此,本研究利用木瓜蛋白酶和风味蛋白酶对泥鳅蛋白粉进行酶解,加入单种糖或混合糖与酶解产物(干基)以质量比1∶1进行美拉德反应,美拉德反应产生的香味物质还可掩盖泥鳅腥味。在此基础上,本研究以产物对羟基自由基、超氧阴离子自由基、DPPH·的清除率评价其抗氧化性能,通过正交实验研究最适的反应pH、温度和时间。以期获得对羟基自由基、超氧阴离子自由基、DPPH·的清除率均较好的泥鳅蛋白酶解产物,为后期筛选酶与糖的种类,混合糖比例等提供一定的理论基础。
1 材料与方法
1.1 材料与仪器
泥鳅粉饲养周期为60 d的市售台湾扁鳅去头去皮去骨,冷冻干燥[20-21]制得,舟山市新城区老碶菜场;风味蛋白酶(酶活力≥20 IU/mg)、木瓜蛋白酶(酶活力≥1000 IU/mg)上海金穗生物科技有限公司;无水葡萄糖、半乳糖、蔗糖、乳糖、木糖国药集团化学试剂有限公司;邻二氮菲、PBS、硫酸亚铁、双氧水、邻苯三酚、Tris-HCl、DPPH、无水乙醇均为国产分析纯。
DS-1型高速组织捣碎机、HWS-12型电热恒温水浴锅赛多利斯科学仪器有限公司;85-2型恒温磁力搅拌器、A-1502型紫外分光光度计上海精密科学仪器有限公司;PB-10酸度计上海科学仪器有限公司;IKAT18基本型漩涡振荡器德国IKA公司。
1.2 实验方法
1.2.1泥鳅蛋白酶解物制备泥鳅蛋白粉的酶解工艺:在游丽君[9]的研究基础上做了适当调整。根据每次实验条件需要,称取泥鳅蛋白粉0.100 g若干份,每份加入pH6.9的缓冲液50 mL,涡旋振荡后静置。加入木瓜蛋白酶与风味蛋白酶质量比为3∶25混合的复合酶5.5 mg。在55 ℃水浴条件下,酶解4.5 h,随后升温至100 ℃灭活,取出冷却后冷冻干燥。
1.2.2美拉德反应条件的筛选采用1.2.1中制得的泥鳅蛋白酶解物,以酶物质量与糖质量比为1∶1进行美拉德反应,冷却后以3000 r/min离心20 min,过滤取上层清液,即美拉德反应上清液,一部分-18 ℃保存,一部分用于检测。
1.2.2.1糖的筛选固定反应条件为加热温度50 ℃、加热时间30 min,反应pH为7,加入糖总质量为1.0 g,考察不同糖种类(无水葡萄糖、蔗糖、半乳糖、乳糖、木糖)对产物自由基清除率的影响;选择清除效果好的木糖、乳糖、蔗糖进行下一步实验,固定反应条件不变,考察不同糖组合(木糖和乳糖、木糖和蔗糖、乳糖和蔗糖分别以质量比1∶1混匀)对产物自由基清除率的影响;选择清除效果好的糖组合(木糖和乳糖)进行下一步实验,固定反应条件不变,考察不同糖配比(木糖和乳糖以质量比1∶1.5、1∶3、1∶4、1.5∶1、3∶1、4∶1混匀)对产物自由基清除率的影响。
1.2.2.2单因素实验固定反应条件为加热温度50 ℃、加热时间30 min、加入木糖和乳糖以质量比1∶3混匀的糖1.0 g,考察不同反应pH(2、4、6、7、8、10)对自由基清除率的影响;固定反应条件为加热时间30 min、反应pH为7、加入木糖和乳糖以质量比1∶3混匀的糖1.0 g,考察不同加热温度(40、50、60、70、80、90、100 ℃)对自由基清除率的影响;固定反应条件为加热温度50 ℃、反应pH为7、加入木糖和乳糖以质量比1∶3混匀的糖1.0 g,考察不同加热时间(15、30、45、60、90、120 min)对自由基清除率的影响。
1.2.3正交实验根据前期单因素实验的结果,以加热时间、加热温度、反应pH为实验因子,进行三因素三水平L9(34)的正交优化实验,以羟基自由基清除率、超氧阴离子自由基清除率、DPPH自由基清除率为指标,分别筛选出优化组合。各因素的三水平采用1、2、3进行编码,如表1。

表1 正交实验设计因素水平和编码Table 1 Independent variables and their levels used in the orthogonal design
1.2.4抗氧化性能测定
1.2.4.1羟自由基清除率测定采用邻二氮菲法[22],取0.75 mmol/L邻二氮菲1.0 mL,pH7.4的PBS 2.0 mL,蒸馏水1.0 mL,混合均匀,加入0.75 mmol/L硫酸亚铁1.0 mL,0.12%双氧水1.0 mL(新鲜配制),振荡混匀,记作Ap;以1.0 mL蒸馏水代替1.0 mL的0.12%的双氧水,其余条件同 Ap处理记作Ab;以1.0 mL美拉德反应上清液代替1.0 mL蒸馏水,其余条件同AP处理记作 As。Ap、Ab、As均在 37 ℃水浴锅中保温60 min,然后蒸馏水调零,测定536 nm处吸光度,并按照下面公式计算羟自由基清除率[23-24]:
1.2.4.2超氧阴离子自由基清除率的测定取邻苯三酚0.1 mL并加入Tris-HCl(pH8.2)缓冲溶液5 mL于试管中,加入美拉德反应上清液0.25 mL,迅速混匀,25 ℃水浴保温15 min后使用1 cm比色皿,以蒸馏水做空白对照,在320 nm处时测吸光度Ai,并测定本底扣除水解自身的干扰,水解液对超氧阴离子自由基清除率按照下面公式计算[25-26]。

式中:A0为试剂空白的吸光度值;Ai为样液的吸光度值;Aj为样液本底的吸光度值。
1.2.4.3DPPH自由基清除率的测定称取适量美拉德反应上清液备用,其中样品组为1 mL DPPH+1 mL样品;对照组1为1 mL 95%乙醇+1 mL样品;对照组2为1 mL蒸馏水+1 mL DPPH;调零组为95%乙醇。混合均匀,避光反应30 min。检测各组在波长535 nm处的吸光度,依次记为A1、A2、A3,按照下面公式计算清除率[27]。
1.3 数据分析
2 结果与讨论
2.1 糖的筛选
2.1.1糖种类的筛选如图1所示,加糖组的清除率均高于对照组,乳糖组对羟基自由基的清除率高于其他四组为36.96%±3.44%,其次是蔗糖组、木糖组、半乳糖组和无水葡萄糖组;木糖组对超氧阴离子自由基清除率显著高于其他四组为52.51%±3.13%,其次是蔗糖组、乳糖组、无水葡萄糖组和半乳糖组;蔗糖组的DPPH自由基清除率显著高于其他四组为63.62%±3.21%,其次是乳糖组、木糖组、半乳糖组、无水葡萄糖组。分别选出对羟基自由基、超氧阴离子自由基、DPPH自由基清除效果最好的乳糖、木糖、蔗糖,进行下一步实验。

图1 糖种类对抗氧化性能的影响Fig.1 Effect of different sugar on oxidant resistance
2.1.2组合糖的筛选选取木糖、蔗糖、乳糖这三种糖进行两两质量比1∶1组合,得到木糖-蔗糖、木糖-乳糖、蔗糖-乳糖三种组合糖。如图2所示,木糖-乳糖组对羟基自由基的清除率为42.68%±1.26%,高于蔗糖-乳糖组,低于木糖-蔗糖组;对超氧阴离子自由基清除率为60.85%±2.56%,高于木糖-蔗糖组和蔗糖-乳糖组;对DPPH自由基清除率为66.13%±3.05%,高于木糖-蔗糖组和蔗糖-乳糖组。综合考虑,选取木糖-乳糖组进行下一步实验。

图2 糖组合对抗氧化性能的影响Fig.2 Effect of compound sugar on oxidant resistance
2.1.3糖配比的筛选如图3所示,糖配比1∶3组对超氧阴离子自由基、DPPH自由基清除率均高于其它五组,分别为58.27%±2.19%和68.09%±1.33%;对羟基自由基效果最好的是糖配比1∶4组,清除率为47.41%±1.03%,糖配比1∶3组对羟基自由基的清除率为47.13%±2.24%。综合考虑选取木糖和乳糖以质量比为1∶3的比例混合而成的复合糖进行下一步实验。

图3 糖比例对抗氧化性能的影响Fig.3 Effect of sugar ratio on oxidant resistance
2.2 单因素实验
2.2.1pH的筛选图4所示在不同pH条件下反应产物对自由基的清除效果不同,pH=7时,羟基自由基清除率最大达到47.40%±2.01%;pH=8时超氧阴离子自由基清除率达到最佳,为62.95%±2.05%;pH=6时,DPPH自由基清除率达到最佳为75.36%±3.92%。实验数据表明,pH为6、7、8时三种自由基清除率在同组实验中均高于pH为2、4、10时的清除率。另外,本研究发现当反应体系在酸性范围时,MRPs对DPPH自由基的清除能力随着pH的增大而增强;当反应体系在碱性范围时,MRPs对DPPH自由基的清除能力随着pH的增大而降低,羟自由基清除率与超氧阴离子清除率也呈此规律,即MRPs表现出的抗氧化能力随着pH的上升呈现先上升后下降的趋势。这与朱敏等人的研究结果一致[28]。因此,选取pH6、7、8进行正交实验。
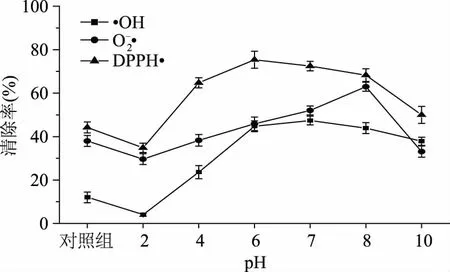
图4 pH对抗氧化性能的影响Fig.4 Effect of pH on oxidant resistance
2.2.2反应温度的筛选如图5所示,MRPs在不同反应温度下对自由基清除效果不同。40~90 ℃之间,MRPs对羟基自由基、超氧阴离子自由基、DPPH自由基的清除率均成上升趋势,这表明随反应温度增加,反应产物的抗氧化能力显著提升;90 ℃时,三种自由基清除率达到最高,分别为54.36%±2.58%、68.84%±3.20%、78.13%±3.10%;反应温度继续升至100 ℃时清除率稍有下降,但清除效果较好,可能是因为温度过高引起抗氧化活性降低。本研究发现,当反应温度达到90 ℃时抗氧化能力达到最高值。由此可见,常压下高温有利于泥鳅肉水解产物与糖进行美拉德反应。赵晶等采用酪蛋白与还原糖在不同温度下发生美拉德反应[29],也发现在一定范围内,温度越高反应产物的抗氧化能力越高。100 ℃的清除率稍低于90 ℃,仍高于40~80 ℃,故选取加热温度80、90、100 ℃作为美拉德反应的条件,进行下一步正交实验。
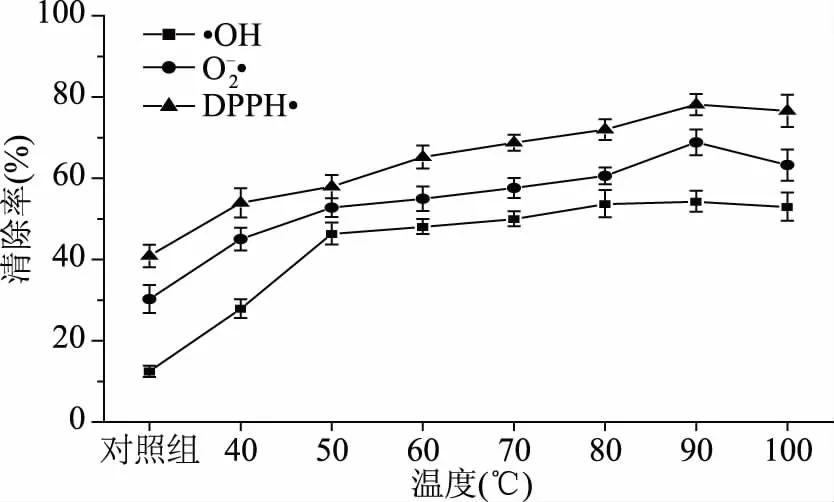
图5 温度对抗氧化性能的影响Fig.5 Effect of temperature on oxidant resistance
2.2.3反应时间的筛选由图6可知,进行美拉德反应的实验组,自由基清除率均高于对照组。0~15 min自由基清除率迅速上升,在反应初期MRPs表现出较高的清除力,这可能与泥鳅肌肉酶解液本身存在这样的能力有关;随着反应时间的增加,15~45 min泥鳅肌肉水解产物的抗氧化能力缓慢提升,MRPs对自由基清除率的增加逐渐趋于平缓,这一研究结果与Soottawat Benjakul等的结果相类似[30];当反应时间达到45 min时,抗氧化能力最强,羟基自由基、超氧阴离子自由基、DPPH自由基清除率分别为43.29%±3.40%、65.43%±4.22%、70.64%±2.08%;45 min后,基本保持不变,甚至出现负增长,清除率略小于45 min,其原因可能是泥鳅肌肉水解产物中的游离氨基酸或者肽类物质不断与还原糖发生美拉德反应,产生的还原性物质不断积累,因而表现出一段时间内抗氧化能力逐渐提升,然而随着加热时间的增加,部分还原性物质分解[31],因此抗氧化能力有所减小。综合效率和成本考虑,选择30、45、60 min三个时间,进行正交实验。

图6 时间对抗氧化性能的影响Fig.6 Effect of time on oxidant resistance
2.3 正交实验
实验结果如表2所示,三个因素对羟基自由基清除率的影响的主次顺序为C>B>A,反应pH对羟基自由基清除率的影响排第一,加热时间、加热温度次之。最佳组合为A1B2C2,即加热温度80 ℃,加热时间45 min,反应pH为7,对羟基自由基的清除率效果最佳为58.86%。三个因素对超氧阴离子自由基清除率的影响的主次顺序为A>C>B,加热温度对超氧阴离子自由基清除率的影响排第一,反应pH、加热时间次之。最佳组合为A3B2C1即加热温度100 ℃,加热时间45 min,反应pH为6,对超氧阴离子自由基的清除率效果最佳为70.63%。三个因素对DPPH自由基清除率的影响的主次顺序为A>C>B,加热温度对DPPH自由基清除率的影响排第一,反应pH、加热时间次之,与影响超氧阴离子自由基清除率的主次顺序相同。由表3可知,经验证实验最佳组合为A2B3C3,即加热温度90 ℃,加热时间60 min,反应pH为8,对DPPH自由基的清除率效果最佳为85.40%。

表2 正交实验设计及自由基清除率Table 2 Orthogonal design and free radical scavenging rate

表3 DPPH·清除率验证实验Table 3 DPPH-clearance rate verification test
3 结论
本研究结果表明,加入单种糖进行反应的产物抗氧化性能低于混合糖,其中又以木糖和乳糖质量比1∶3混合效果最佳,对羟基自由基、超氧阴离子自由基、DPPH自由基的清除率分别为47.13%±2.24%、58.27%±2.19%、68.09%±1.33%。从正交分析的结果来看,反应温度对超氧阴离子自由基、DPPH自由基的清除率的影响大于时间及pH的影响,这表明反应温度对美拉德反应产物抗氧化性影响较大,控制好美拉德反应的加热温度非常重要。在pH7、80 ℃下反应45 min的产物对羟基自由基的清除率效果最佳,为58.86%;在pH6、100 ℃下反应45 min的产物对超氧阴离子自由基的清除率最佳,为70.63%;在pH8,温度90 ℃下反应60 min的产物对DPPH自由基的清除率最佳,为85.40%,结果表明美拉德反应条件的优化对泥鳅蛋白酶解产物抗氧化性能提升效果明显。
[1]蓝嘉,朱瑜,覃栋明,等.金泥鳅含肉率及肌肉营养成分分析[J]. 科学养鱼,2016(5):76-78.
[2]钦传光,韩定献,董先智,等.泥鳅及其提取物中营养成分的研究[J]. 食品科学,2002,23(2):123-126.
[3]吴炎,时月,凌去非,等.苏州地区泥鳅与大鳍副泥鳅肌肉微量元素含量比较[J]. 水产养殖,2011,23(10):41-43.
[4]柴琪琪,李志涛,次少涛,等.泥鳅体表粘液中IgM的分离纯化与抑菌活性研究[J]. 现代农村科技,2016(10):49.
[5]吴穹,许晓曦.泥鳅体表粘液多糖诱导SGC-7901细胞凋亡机理研究[J]. 食品工业科技,2012(19):124-127.
[6]王祥,杜淼,宋义虎,等.泥鳅体表粘液糖蛋白的提取和吸附行为[A]. 中国化学会高分子学科委员会. 2013年全国高分子学术论文报告会论文摘要集——主题I:生物高分子与天然高分子[C]. 中国化学会高分子学科委员会:2013:1.
[7]钦传光,黄开勋,徐辉碧,等.泥鳅多糖抗炎作用的实验研究[J]. 中国药理学通报,2001(6):715-716.
[8]游丽君,赵谋明,Joe R,等.加工和贮藏条件对泥鳅多肽抗氧化活性的影响[J]. 江苏大学学报:自然科学版,2009(6):549-553.
[9]游丽君. 泥鳅蛋白抗氧化肽的分离纯化及抗疲劳、抗癌功效研究[D]. 广州:华南理工大学,2010.
[10]Nicoli M C,Anese M,Manzocco L,et al. Antioxidant properties of coffee brews in relation to be roasting degree[J]. LWT-Food Science and Technology,1997,30(3):292-297.
[11]Chang H L,Chen Y C,Tan F J. Antioxidative properties of a chitosan-glucose Maillard reaction product and its effect on pork qualities during refrigerated storage[J]. Food Chemistry,2011,124(2):589-595.
[12]王晓芸.β-CD及其衍生物与天然抗氧化剂杨梅素的包合作用研究[D]. 天津:天津商业大学,2008.
[13]Yang S Y,Lee S,Min C P,et al.Improved physicochemical properties and hepatic protection of Maillard reaction products derived from fish protein hydrolysates and ribose[J]. Food Chemistry,2017,221(4):1979-1988.
[14]Chen H,Ji A G,QIU S,et al. Covalent conjugation of bovine serum album and sugar beet pectin through Maillard reaction/
laccase catalysis to improve the emulsifying properties[J]. Food Hydrocolloids,2016.
[15]Feng J,Wu S S,Wang H,et al. Improved bioavailability of curcumin in ovalbumin-dextran nanogels prepared by Maillard reaction[J]. Journal of Functional Foods,2016,27(12):55-68.
[16]秦晓辉.美拉德反应制备珠肨抗氧化肽及其性质研究[D]. 南昌:南昌大学,2014.
[17]陈贵堂,周琼飞,朱艳丽,等. 用美拉德反应提高灰树花多肽的抗氧化活性[J]. 食品科学,2013,14:26-29.
[18]李婷,江晓婉,叶青,等. 采用美拉德反应提高黄鲫蛋白抗菌肽的抑菌活性[J]. 肉类研究,2012(1):14-17.
[19]乔路,周大勇,李秀玲,等.美拉德反应制备鲍鱼脏器肽呈味基料及其抗氧化活性研究[J]. 大连工业大学学报,2011(6):407-411.
[20]陈飞东,邹礼根,刘军波,等. 水产品真空冷冻干燥技术研究进展[J]. 杭州农业与科技,2014(6):26-28.
[21]段振华. 水产品干燥技术研究[J]. 食品研究与开发,2012(5):213-216.
[22]Li Y H,Jiang B,Zhang T,et al. Antioxidant and free radical-scavenging activities of chickpea protein hydrolysate(CPH)[J].Food Chem,2008,106:444-450.
[23]金鸣,蔡亚欣,李金荣. 邻二氮菲—Fe2+氧化法检测产生的羟自由基[J]. 生物化学与生物物理进展,1996,23(6):553-555.
[24]De AJ,Magalhags M M M,Silva A,et al.Reevaluating the role of 1,10-phenanthroline in oxidative reactions involving ferrous ions and DNA damage[J]. Biochimica et Biophysica Acta,2004,1675(1/3):46-53.
[25]Wang L L,Xiong Y L. Inhibition of lipid oxidation in cooked beef patties by hydrolyzed potato protein is related to its reducing and radical scavenging ability[J]. J Agric Food Chem,2005,53:9186-9192.
[26]Almjano P,Delgado M E,Gordon M H. Changes in the antioxidant properties of protein solutions in the presence of epigallocatechin gallate[J]. Food Chem,2007,105:126-130.
[27]Wu H C,Chen H M,Shiau C Y. Free amino acids and peptides as related to ntioxidant properties in protein hydrolysates of ackerel(Scomber austriasicus)[J]. Food Res Int,2003,36:949-957.
[28]朱敏.抗氧化作用的精氨酸-木糖美拉德反应产物的制备条件[J]. 食品加工,2002,23(5):88-89.
[29]赵晶,马丹雅,张筠,等.酪蛋白与还原糖美拉德反应产物抗氧化性的研究[J]. 食品工业科技,2012(12):187-189.
[30]Benjaklu S,Lertittkul W,Bauer F. Antioxidant activity of Maillard reaction products from a porcine plasma protein-sugar model system[J]. Food Chemistry,2005,93(2):189-196.
[31]马志玲,王延平.模式美拉德反应产物抗氧化性能的研究[J]. 中国油脂,2002,27(4):68-71.

