特发性肺纤维化患者血清TGF—β、IFN—γ水平变化的意义
张晓玲

【摘要】 目的:研究特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)患者血清中转化生长因子-β(transforming growth factor-β,TGF-β)与干扰素-γ(interferon-γ,IFN-γ)水平的变化,探讨这两种细胞因子在IPF发病机制中的作用及临床意义。方法:选取2014年3月-2016年9月本院住院治疗的IPF患者28例为IPF组;另选取同期本院健康体检者30例为正常对照组。采用酶联免疫吸附法测定研究对象血清中TGF-β、IFN-γ水平,并进行分析。结果:IPF组患者血清中TGF-β水平为(716.94±96.67)pg/mL,高于正常对照组的(279.24±45.14)pg/mL,IPF组患者血清IFN-γ水平为(1 210.33±365.47)pg/mL,低于正常对照组的(1 573.00±196.87)pg/mL,比较差异均有统计学意义(P<0.01)。血清中TGF-β与IFN-γ水平呈显著负相关(r=-0.823,P=0.008)。结论:TGF-β、IFN-γ均参与了IPF的发病机制,两者水平的变化对IPF的病情发展有一定影响,其中TGF-β促进纤维化的形成,而IFN-γ为抑制纤维化的细胞因子。
【关键词】 特发性肺纤维化; 转化生长因子-β; 干扰素-γ; 发病机制
Significance of Changes in Serum Levels of TGF-β and IFN-γ in Patients with Idiopathic Pulmonary Fibrosis/ZHANG Xiaoling.//Medical Innovation of China,2018,15(06):137-140
【Abstract】 Objective:To study the changes in serum levels of transforming growth factor-β(TGF-β) and interferon-γ(IFN-γ) in patients with idiopathic pulmonary fibrosis(IPF),and to explore the role and clinical significance of these two cytokines in the pathogenesis of IPF.Method:A total of 28 patients with IPF in our hospital from March 2014 to September 2016 were selected as the IPF group,in addition,30 healthy persons in the same period were selected as the normal control group.The serum levels of TGF-βand IFN-γ were measured by enzyme-linked immunosorbent assay and analyzed.Result:The serum level of TGF-βin IPF group was (716.94±96.67)pg/mL,which was higher than(279.24±45.14)pg/mL in normal control group,the serum level of IFN-γ in IPF group was(1 210.33±365.47)pg/mL,which was lower than(1 573.00±196.87)pg/mL
in normal control group,the differences were statistically significant(P<0.01).The TGF-β was negatively correlated to the IFN-γ(r=-0.823,P=0.008).Conclusion:TGF-β and IFN-γ are all involved in the pathogenesis of IPF,the levels change has a certain effect on the development of IPF,in which TGF-β promotes the formation of fibrosis,and IFN-γ is a cytokine that inhibits fibrosis.
【Key words】 Idiopathic pulmonary fibrosis; Transforming growth factor-β; Interferon-γ; Pathogenesis
First-authors address:Affiliated Hospital of Chifeng University,Chifeng 024005,China
doi:10.3969/j.issn.1674-4985.2018.06.039
特發性肺纤维化(idiopathic pulmonary fibrosis,IPF)是复杂的致病因素激发的多种细胞因子和炎症介质参与的慢性炎症性疾病。目前IFP发病率呈现逐年增高的趋势,但是由于该类疾病病因繁多,尽管存在急性期,但常常隐匿起病,慢性病程,早期不易被发现,绝大多数病例确诊已属于晚期纤维化形成,对肺功能的破坏已是不可逆,所以一直以来该类疾病是呼吸系统疾病的诊疗难点。由于目前肺间质纤维化的发病机制尚未明确,目前没有特异性的治疗药物及方法,所采用的均是非特异性的对症、“量体裁衣”式治疗。所以探索发病的分子机制及新的干预靶点,对于延缓或阻止肺纤维化的发生发展有重要意义。多种致炎性细胞因子及化学趋化因子在IPF发生发展中起重要作用。有研究认为血清转化生长因子-β(transforming growth factor-β,TGF-β)与干扰素-γ(interferon-γ,IFN-γ)在IPF的发病机制中有一定的联系。本研究通过观察IPF患者血清TGF-β、IFN-γ水平,探求两者在IPF疾病进展中的作用及意义,通过对其发病机制的研究,为治疗提供新的靶物,提高临床对IPF的诊治水平,力求缓解纤维化进展,以帮助提高患者生存质量和生存期。现报道如下。
1 资料与方法
1.1 一般资料 选取2014年3月-2016年9月本院住院治疗的IPF患者28例为IPF组;另选取同期本院健康体检者30例为正常对照组,排除各种心肺疾病、肿瘤、感染等,胸片及肺功能检查未见明显异常。纳入标准:根据症状、体征、肺功能检查、血气分析、胸部CT检查均属于IPF,符合中华医学会呼吸病学分会、美国胸科学会和欧洲呼吸学会有关IPF共识制定中的特发性肺(间质)纤维化诊断和治疗(草案)诊断标准[1-2];患者检查前均未经糖皮质激素及其他免疫抑制剂治疗。排除标准:已明确病因的间质性肺疾病,如肺水肿、感染、吸入性、结缔组织病,药物相关等;严重肝肾功能不全患者;妊娠期及哺乳期妇女。研究对象均对本研究知情并签署知情同意书,且本研究已经院伦理委员会审核批准。
1.2 方法 所有研究对象清晨空腹采静脉血5 mL,静置30 min后,经离心(3 000 r/min)15 min后,收集上清液,置-80 ℃冰箱保存,采用酶联免疫吸附法检测两组血清中TGF-β、IFN-γ水平。
1.3 统计学处理 使用SPSS 19.0软件对所得数据进行统计分析,计量资料用(x±s)表示,组间比较采用t检验;计数资料以率(%)表示,比较采用 字2检验;两变量间关系采用Pearson相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 两组基线资料比较 IPF组男18例,女10例;平均年龄(67.96±10.82)岁;吸烟者13例。正常对照组男19例,女11例,平均年龄(67.40±9.07)岁,吸烟者13例。两组患者一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
2.2 两组血清TGF-β、IFN-γ水平比较 IPF组患者血清TGF-β水平高于正常对照组,血清IFN-γ水平低于正常对照组,比较差异均有统计学意义(P<0.01),见表1。
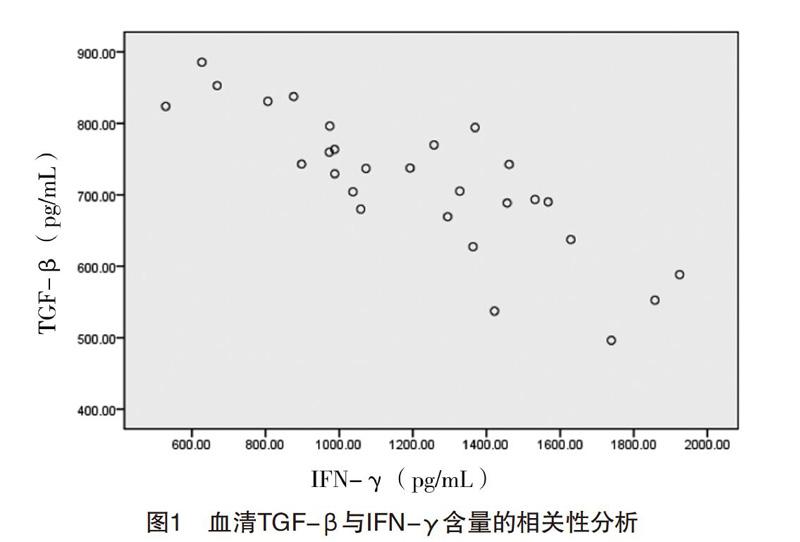
2.3 血清TGF-β、IFN-γ含量的相关性分析 血清中TGF-与IFN-γ水平呈显著负相关(r=-0.823,P=0.008),见图1。
3 讨论
肺纤维化是由多种原因、多个环节参与的最终引起肺组织结构重塑,不可逆性肺损伤的一类疾病,其病变范围主要发生在肺间质部分,也可累及肺泡上皮细胞及肺血管,病理学改变特点为普通型间质性肺炎(usual interstitial pneumonia,UIP)。由于目前的诊断及治疗存在局限性,并不能改变其不良的预后,很大一部分病例确诊时已趋于晚期,治疗意义并不大。肺组织慢性炎症损伤导致组织结构破坏,结缔组织增生,沉积的细胞外基质(extracellular matrix,ECM)增加,特别是胶原蛋白含量增高,最终导致ECM数量、组成及分布发生变化。此过程为多种细胞因子参与肺泡的炎症反应,这些细胞因子表达的含量,种类以及相互之间的平衡,对肺泡早期的炎症反应、上皮的修复以及纤维化的形成有重要意义。通过研究一些细胞因子的水平与肺纤维化形成、发展的关系,从而可以达到评估IFP病情的目的。
TGF-β是成纤维细胞的趋化因子,能够招募周围组织中的成纤维细胞向损伤部分聚集,能够促进成纤维细胞产生、分裂、增殖,刺激其合成和大量分泌胶原,促进肺纤维化形成;能够刺激多种细胞因子的合成、分泌,增加ECM合成,促进聚集,抑制降解[3]。TGF-β通过诱导蛋白酶抑制剂金属蛋白酶组织抑制剂(tissue inhubitor of metalloproteinase,TIMP)的表达增加,引起蛋白水解酶的活性降低,其降解ECM的生物学活性减低,通过减少胶原酶合成,促使胶原蛋白在肺内的含量增加[4]。研究发现,TGF-β可以通过促进血小板释放血小板源性生长因子(platelet-derived growth factor,PDGF)趋化炎症细胞,促使炎症的发展,促进肺成纤维细胞的增殖与纤维增生[5]。研究发现,肺纤维化患者肺组织、支气管肺泡灌洗液以及血清中TGF-β含量均明显增高[6-7]。同时文献[8]报道,IFP患者血清中TGF-β水平很可能提示患者肺功能的受损程度,可以反映纤维化的严重程度了解及疾病的进展情况。本研究结果显示,IFP组患者血清中TGF-β水平高于正常对照组(P<0.01),与上述报道一致,进一步说明TGF-β参与肺纤维化的发病机制,并对其发生发展有重要意义。研究发现,通过抑制TGF-β本身或其信号传导通路中的细胞因子,可以缓解或减慢肺纤维化的形成[9]。Lee等[10]认为对IFP患者使用TGF-β拮抗剂不仅可以抑制肺纤维化的进展,同时还能提高疾病预后。在以后的治疗过程中,可以考虑通过抑制TGF-β的产生和表达,减少其含量,从而达到减轻和改善纤维化的治疗目的。
目前国内外多个研究结果证实,在肺纤维化形成中,Ⅱ型细胞因子(T helper type 2,Th2)含量过多,而Ⅰ型细胞因子(T helper type 1,Th1)反应不足。IFN-γ是一种重要的Th1,其主要作用是免疫调节、广谱抗病毒、抑制细胞增殖、诱导细胞凋亡、抗纤维化。IFN-γ对Th2具有抗增殖效果,对Th1无影响,使免疫应答向Th1免疫应答的方向进行。有研究显示,IPF患者肺组织及血清中Th1型细胞因子绝对或相当匮乏,Th1型细胞因子IFN-γ水平与肺结节病等纤维化相对较轻的疾病比较,相对减少[11]。Majumdar等[12]研究中实验组为隐源性致纤维化性肺泡炎患者的开胸肺活检标本,对照组为吸烟者因肺癌肺切除的正常肺组织,使用原位杂交技术通过放射性硫标记的反义核酸探针检测IFN-γ的mRNA,结果显示,两组细胞因子组成相似,但实验组Th1型细胞因子IFN-γ的比例显著降低。本研究结果显示,IPF组患者血清IFN-γ水平低于正常对照组(P<0.01),与文獻[13-15]研究相符,同样证实了IFN-γ是一种抑制纤维化因子。因而临床治疗中可以考虑通过给予外源性的IFN-γ或给予促进IFN-γ表达的细胞因子,来调节IFP患者体内TH失衡,从而达到治疗肺纤维化的目的。Ziesche等[16]对IFN-γ治疗IPF患者和18例长期激素治疗1年后病情无明显改善的IPF患者进行相关研究,结果显示应用了IFN-γ1b治疗组患者肺功能指标肺总量(total lung capacity,TL)、用力肺活量(forced vital capacity,FVC)和动脉血氧(partial pressure of oxygen in arterial blood,PaO2)均有显著改善,单独强的松治疗组相应指标仍持续恶化,前者临床症状的改善同时伴有TGF-β、mRNA水平减低。
综合以上结果考虑,既然TGF-β是促纤维化因子,而IFN-γ为抑纤维化因子,两者有一定的联系和相关性,研究显示,IFN-γ具有抑制致纤维化因子TGF-β的产生与活化的作用[17-18]。TGF-β的信息传递途径的活化因子为Smad3、Smad4,抑制因子为Smad7,Jaffe等[19]认为IFN-γ可以通过诱导并激活Smad7,抑制Smad3、Smad4的磷酸化及结合,使TGF-β信号传导通路受到抑制而阻断合成胶原蛋白的信号。研究发现,IFN-γ与受体结合后,信号传入细胞内,也激活细胞核中转运蛋白-1,能够竞争性抑制TGF-β信号传导,从而使TGF-β的功能大大减少,起到了抑制纤维化形成的作用,所以被认为是纤维化抑制因子[20]。本研究结果显示,血清中TGF-β与IFN-γ水平呈显著负相关(P<0.05),与以上研究结论一致。
综上所述,TGF-β、IFN-γ两种细胞因子均参与了IPF的发病机制,两者水平的变化对IPF的病情发展有一定影响,其中TGF-β促进纤维化的形成,而IFN-γ为纤维化的抑制细胞因子。
参考文献
[1]中华医学会呼吸病学分会.特发性肺(间质)纤维化诊断和治疗指南(草案)[J].中华结核和呼吸杂志,2002,25(7):129-131.
[2] Travis W D,Jr T E K,Bateman E D,et al.This Joint Statement of the American Thoracic Society (ATS),and the European Respiratory Society(ERS) was adopted by the ATS Board of Directors,June 2001 and by The ERS Executive Committee,June 2001[J].American Journal of Respiratory & Critical Care Medicine,2002,165(2):277-304.
[3] Proell V,Carmona-Cuenca Z,Murillo M M,et al.TGF-beta dependent regulation of oxygen radicals during transdiffentiation of activated hepatic stellate cell to myofibrblastoid cells[J].Comp Hepatol,2007,6(1):1-10.
[4] Hoyt D G,Lazo J S.Alterations in pulmonary mRNA encoding procollagens, fibronectin and transforming growth factor-beta precede bleomycin-induced pulmonary fibrosis in mice[J].
J Pharmacol Exp Ther,1988,246(2):765-771.
[5] Ludwicka A,Ohba T,Trojanowska M,et al.Elevated levels of platelet derived growth factor and transforming growth factor-beta 1 in bronchoalveolar lavage fluid from patients with scleroderma[J].J Rheumatol,1995,22(10):1876-1883.
[6]王欣燕,吳晓梅,陈克辉.特发性肺纤维化患者支气管肺泡灌洗液中细胞因子研究[J].哈尔滨医科大学学报,2003,37(6):491-493.
[7] Yong S J,Adlakha A,Limper A H.Circulating transforming growth factor-β1:a potential marker of disease activity during idiopathic pulmonary fibrsis[J].Chest,2001,120(S1):68S-70S.
[8] Xiao L,Li Z H,Hou X M,et al.Evaluation of interleukin-13 in the serumand bronchoalveolar lavage fluid of patients with idiopathic pulmonary fibrosis[J].Zhong Hua Jie He He Hu Xi Za Zhi,2003,26(11):686-688.
[9] Du W,Wong F S,Li M O,et al.TGF-beta signaling is reguired for the function of insulin-reactive T regulatory cells[J].J Clin Invest,2006,116(5):1360-1370.
[10] Lee C G,Homer R J,Zhu Z,et al.Interleukin-13 induces tissue fibrosis by selectively stimulating and activating transforming growth facter beta(1)[J].J Exp Med,2001,194(6):809-821.
[11] Wallace W A,Ramage E A,Lamb D,et al.A type-2(TH2-like) patternimmune response predominates in the pulmonary interstitium of patients with cryptogenic fibrosing alveolitic(CFA)[J].Clin Exp Immunol,1995,101(3):436-441.
[12] Majumdar S,Li D,Ansari J,et al.Different cytokine profiles in cryptogenic fibrosing alveolitis and fibrosing alveolitis associated with systenic sclerosis:a quantitafive study of open lung biopsies[J].Eur Respir J,1999,14(2):251-257.
[13] Chen E S,Greenlee B M,Wills-Karp M,et al.Affenuation of lung inflammation and fibrosis in interferon-gamma-deticient mice after intratracheal bleomycin[J].Am J Respir Cell Mol Biol,2001,24(5):545-555.
[14] Tsoutsou P G,Gourgoulianis K I,Petinaki E,et al.Cytokine levels in the sera of patients with idiopathic pulmonary fibrosis[J].Res Med,2006,100(5):938-945.
[15] Segel M J,Izbicki G,Cohen P Y,et al.Role of interferon gamma in the evolution of murinr bleomycine lung fibrosis[J].Am J Physiol Lung Cell Mol Physiol,2003,285(6):1255-1262.
[16] Ziesche R,Hofbauer E,Wittmann K,et al.A preliminary study of long-term treatment with interferon gamma-1b and low-dose prednisolone in patients with idiopathic pulmonary fibrosis[J].
N Engl J Med,1999,341(17):1264-1269.
[17]于麗萍,李时悦,林心情,等.肿瘤标志物与特发性肺纤维化严重程度的相关性分析[J].实用医学杂志,2013,29(20):3333-3335.
[18] Bonella F,Wessendorf T E,Costabel U.Clinical experience with pirfenidone for the treatment of idiopathic pulmonary fibrosis[J].Deutsche Medizinische Wochenschrift,2013,138(11):518-523.
[19] Jaffe H A,Gao Z C,Mori Y,et al.Selective inhibition of collagen gene expression in fibroblasts by an interferon-tranans gene[J].Exp Lung Res,1999,25(3):199-215.
[20] Maeyama T,Kuwano K,Kawasaki M,et al.Attenuation of bleomycin-induced pneumopathy in mice by monoclonal antibody to interleukin-12[J].Am J Physiol Lung Cell Mol Physiol,2001,280(6):1128-1137.
(收稿日期:2017-10-16) (本文编辑:董悦)

