蔗糖硬脂酸酯组成与功能特性的关系及其酶催化合成
马亚茹,蓝平,汪勇,晏日安
(暨南大学,食品科学与工程系,广东高校油脂生物炼制工程技术研究中心,广东 广州,510000)
蔗糖硬脂酸酯是由蔗糖与硬脂酸或硬脂酸酯通过酯化或酯交换反应生成的非离子型表面活性剂[1],无毒无味且易被生物降解,具有良好的乳化性、分散性、抗菌性等特点[2-4],可作为乳化剂、杀菌剂[5]等被广泛应用于食品、药品中[6]。目前,市场上使用较为广泛的蔗糖酯为日本三菱化学株式会社研发的L、P、S系列产品。不同型号的蔗糖酯由不同组分含量的蔗糖脂肪酸单、双、多酯组成,其中S系列蔗糖硬脂酸酯因其较宽的HLB值及其特有的物化性能被大量应用于人造奶油、糖果、饮料等生产中[7]。作为一种O/W型表面活性剂,蔗糖硬脂酸酯的HLB值、起泡性能和乳化性能与其单、双、多酯的组分含量密切相关[8],因此研究其各组分含量、HLB值与其功能特性的关系对于蔗糖硬脂酸酯的合成方向以及深入拓展蔗糖硬脂酸酯在生产实践中的应用具有重要意义。
蔗糖硬脂酸酯一般通过化学法和酶催化合成[9],依据日本部分公开的专利,S系列蔗糖酯是通过化学法合成,产物一般由单、双、多酯组成,特异选择性地取代羟基较为困难,而单酯含量对于蔗糖硬脂酸酯的HLB值、起泡性能及乳化性能起到重要作用。酶催化合成较化学合成反应条件温和、特异选择性强且绿色安全[10-11]。目前在酶法合成中采用的底物一般为葡萄糖、果糖或乳果糖和中、低碳链长度的酸(如醋酸、己酸、辛酸、月桂酸)及其酯类[12-14],以蔗糖和长链脂肪酸为底物的合成方法较为少见。而目前应用脂肪酶催化合成蔗糖硬脂酸酯的困难在于蔗糖亲水性强,酰基供体如长链脂肪酸属于疏水性物质[15],单一溶剂通常不能使二者混溶;在酶催化合成中,脂肪酶在极性较大或含水量较高的情况下会出现部分甚至完全失活的现象[16-18]。因此,如何利用绿色高效的脂肪酶以及合适的反应体系催化蔗糖与硬脂酸或硬脂酸酯合成蔗糖硬脂酸酯,对于我国优质乳化剂研发及打破国外技术垄断具有重要意义。
本课题以日本三菱化学株式会社S系列5种不同型号的商品蔗糖硬脂酸酯为研究对象,探究其单、双、多酯含量与HLB值之间的变化规律,及其起泡性能和乳化性能与HLB值、组分含量之间的关系;在此基础之上,以蔗糖和硬脂酸乙酯为底物,在叔戊醇∶丙酮∶DMSO混合体系中,克服反应底物在单一体系中溶解度较低及因极性而引起脂肪酶失活的缺点,采用TLIM固定化脂肪酶,催化合成蔗糖硬脂酸单酯,同时测定其HLB值、物化性能,对于拓展蔗糖硬脂酸酯的应用及其合成具有重要意义。
1 材料与方法
1.1 材料与试剂
S系列蔗糖硬脂酸酯,日本三菱化学株式会社;TLIM脂肪酶(250 IUN/g),诺维信生物技术有限公司;蔗糖、硬脂酸乙酯、叔戊醇、二甲基亚砜,阿拉丁试剂有限公司;氘代-甲醇,Cambridge Isotope Laboratories;其他试剂均为分析纯。
1.2 仪器与设备
LC-20 A高效液相色谱仪,日本岛津公司;EQUINOX-55型红外光谱仪,布鲁克光谱仪器公司;4 000 Q Trap质谱仪,AB SCIEX公司;AVANCEIII型核磁共振波谱仪,500 MHz,瑞士布鲁克公司;N-1300型旋转蒸发器,东京理化器械株式会社。
1.3 方法
1.3.1S系列蔗糖硬脂酸单、双、多酯含量的测定
采用高效液相色谱法测定。配制1.00 g/L的系列蔗糖硬脂酸酯S-570, S-770, S-970, S-1 170, S-1 570甲醇溶液,0.45 μm滤膜过滤,进样,根据出峰时间进行组分定性,采用面积归一法进行定量[19]。
色谱条件:根据RITTHITHAM[8]、WANG[19]的方法略有改动。色谱柱为ECOSIL-C18(5 μm, 4.6 mm×250 mm),进样量20 μL,流速为1 mL/min,柱温为40 ℃;载气流速 2.4 L/min,压力5.0 kPa,空气温度85 ℃,甲醇和水梯度洗脱(见表1)。

表1 流动相洗脱梯度Table 1 Elution gradient of mobile phase
1.3.2水数法测定HLB值
水数法是测定HLB值常用的一种方法,水数是使一定质量分数的表面活性剂的有机溶液呈现浑浊状态所需蒸馏水的体积。采用水数法根据Span 85, Span 60, Span 40, Span 20, Tween 80的HLB值及其所用蒸馏水体积(mL)绘制HLB值与水数的关系图。测定方法根据文献修改如下[20-21]:
25 ℃条件下取1.00 g系列蔗糖硬脂酸酯溶于25 mLN,N-二甲基甲酰胺和苯(体积比100∶5)的混合液中,磁力搅拌下缓慢滴加蒸馏水,直至溶液由无色透明变为不退的模糊白色半透明状态,记录蒸馏水体积(mL)。根据HLB值与水数(mL)关系图,得出参考方程,计算系列蔗糖硬脂酸酯的HLB值。
1.3.3起泡性能的测定
25 ℃下分别配置质量浓度1.00 g/L的系列蔗糖硬脂酸酯-水溶液于刻度试管中,记录溶液起始高度。转速n=3500,分散均质2 min,记录试管中泡沫和液体总高度;静置10 min后记录泡沫和液体总高度[22-23]。起泡能力和泡沫稳定性计算:

(1)

(2)
1.3.4乳化性能的测定
25 ℃下分别配置质量浓度为2.50 g/L的系列蔗糖硬脂酸酯-水溶液,调节pH至7,与5 mL的花生油在23 500 r/min下均质1 min, 然后在3 630 r/min下离心25 min。记录试管中乳化层的高度和乳化液总高度。将乳化液于80 ℃水浴30 min,冷却至室温后于3 630 r/min下离心25 min,记录乳化层的高度[24]。乳化能力和乳化稳定性计算公式如下:

(3)

(4)
1.3.5蔗糖硬脂酸酯的合成
有机溶剂用4 Å分子筛除水72 h。10.00 mL[V(叔戊醇)∶V(丙酮)=7∶3]体系中加入0.30 mL DMSO,0.03 g十四烷基三甲基溴化铵[25],45 ℃条件下将蔗糖(1.00 mmol)与硬脂酸乙酯(6.00 mmol)加入50.00 mL具塞锥形瓶中,溶解均匀,加入0.20 g Novozymes TLIM脂肪酶,球形冷凝管置锥形瓶上端,于恒温振荡式摇床中反应。反应过程通过薄层色谱法监测。反应结束,减压蒸馏除去溶剂,柱层析纯化,旋蒸洗脱液并真空干燥得白色固体。
1.3.6产物结构鉴定
1H-NMR、13C-NMR:氘代甲醇为溶剂,四甲基硅为内标,25 ℃下分别采用500 MHz和150 MHz进行数据收集。
质谱测定条件:ESI离子源;电子能量70 eV;传输线温度275 ℃;离子源温度200 ℃;采用负离子模式;母粒子m/z330;激活电压1.5 V;质量扫描范围0~1 000m/z。
1.3.7产物HLB值、起泡性能和乳化性能的测定
根据HLB值与水数关系图得出的参考方程计算产物的HLB值;配置一系列不同质量分数的产物-水溶液,分别测定起泡能力、泡沫稳定性[22-23],乳化能力、乳化稳定性[24],并与S系列蔗糖硬脂酸酯进行对比分析。
1.4 数据分析处理
实验3次平行,数据采用SPSS软件进行计算、相关性分析,数据计算部分以“平均值±标准差”表示。
2 结果与分析
2.1 HLB值与水数(mL)关系
HLB值是衡量表面活性剂的亲水亲油能力强弱的主要指标,也可作为选择表面活性剂的重要依据[26]。根据所选择的Span 85, Span 60, Span 40, Span 20, Tween 80标准品的HLB值以及用水数法测得的蒸馏水体积(mL),得到标准品与水数的关系图如图1所示,模拟参考方程为y=0.41e0.1674x,为测得S系列蔗糖硬脂酸酯的HLB值提供依据。

图1 HLB值与水体积关系Fig.1 The relationship between HLB value andvolume of water
2.2 S系列单、双、多酯含量与HLB值的关系
蔗糖分子结构中存在8个自由羟基,其中位于6,6’,1’位上的3个一级羟基反应活性最高,易被酯化,而其余的5个二级羟基较难参与酯化反应[14]。此外,随蔗糖中羟基被取代的位点、数量的变化,其单、双、多酯的比例随之改变并最终导致HLB值的差异[27]。蔗糖硬脂酸单、双、多酯酯化度不同,极性也会不同,在HPLC条件下各成分组峰的保留时间随流动相极性变化而变化,因此可对各组分含量用面积归一法进行定量。如表2所示,单酯含量升高,HLB值随之升高,其亲水性增大。当HLB值由14.73降至8.83时,其单酯含量下降约21.61%,二酯含量上升约53.11%;在HLB值由8.83降低至5.47时,其单酯含量下降约53.66%,二酯含量下降约1.86%,多酯由7.66%急剧增加至37.36%,此区间是由二酯和多酯的协同作用而导致不同的HLB值。二酯和多酯含量的增加是由于随着反应时间及反应条件的变化,取代6—OH的蔗糖酯会被继续取代6’—OH和1’—OH以及其他号位的羟基继续生成二酯或者多酯,从而引起其亲水亲油平衡能力的变化。

表2 单、双、多酯含量与HLB值的关系Table 2 The relationship between content of Mono-,Di-,Poly-ester and HLB value
由表3可知,HLB值与单酯含量呈正向相关,相关系数为0.944,在0.05水平上为显著相关,与二酯和多酯含量呈反向相关,相关系数分别为-0.657和-0.810。由此可知单酯含量的变化是决定HLB值的关键因素,同时,单酯与二酯、多酯含量的协同作用引起HLB值的变化。

表3 HLB值与单、双、多酯含量的相关性分析Table 3 Correlation analyses between HLB value andcontent of Mono-, Di-, Poly-ester
*在0.05水平上双侧显著相关。
2.3 起泡性能与HLB值的关系
如图2所示,本研究所采用的S系列蔗糖硬脂酸酯作为表面活性剂起泡能力最高约为21%,与文献[28]显示的蔗糖硬脂酸酯起泡力小的研究基本一致,其泡沫稳定性最高约为80%。
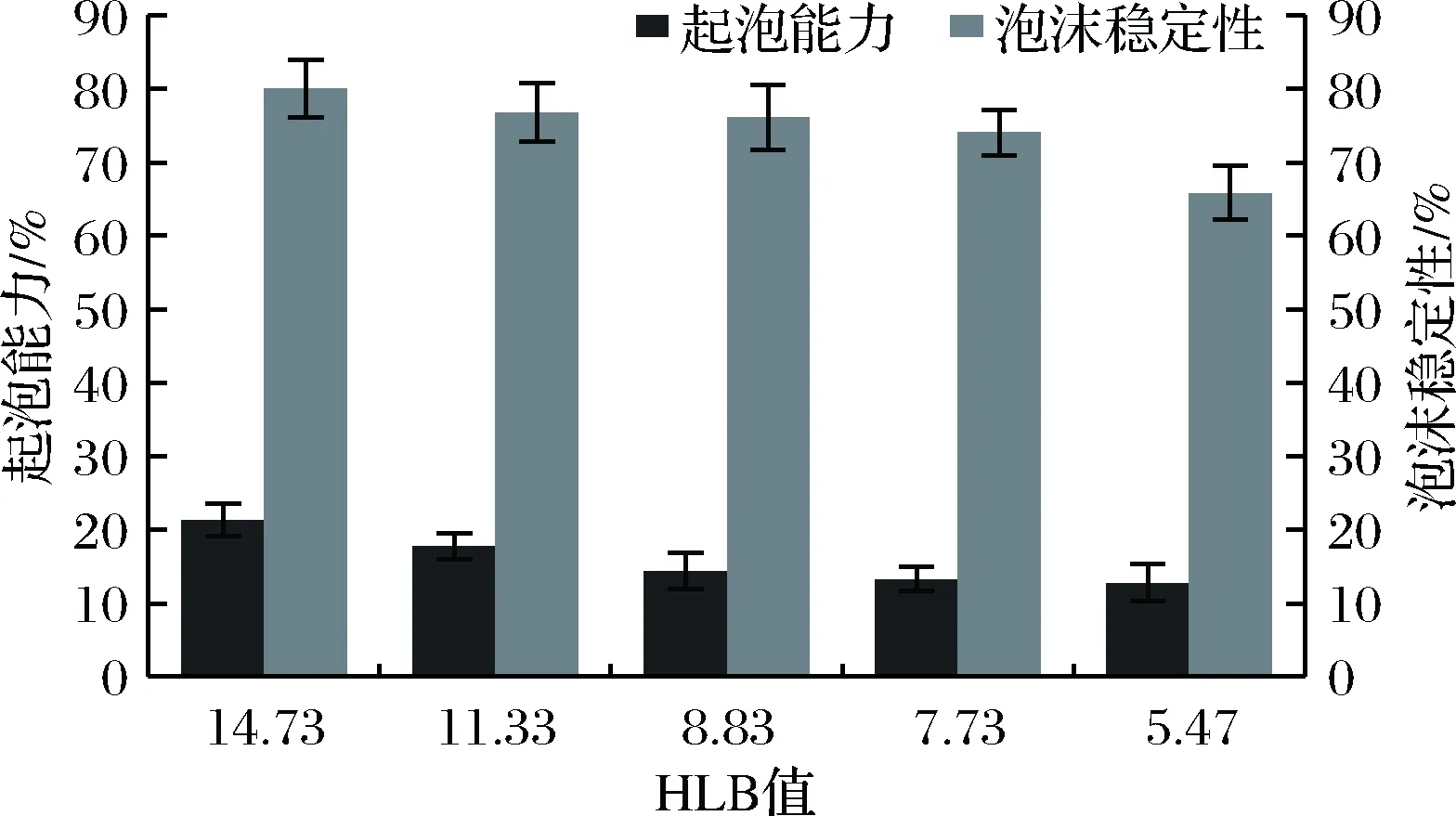
图2 起泡能力和起泡稳定性与HLB值的关系Fig.2 The relationship between foamability,foaming stability and HLB value
随着HLB值减小,其起泡力和泡沫稳定性随之下降。其中泡沫稳定性在HLB值由7.73降低至5.47时下降程度较大,原因在于除单酯和二酯及多酯在界面相互作用,降低了排液速度之外,还由于更多的多酯加入表面,使表面乳化层起泡排列不够紧密,膜强度相应变小,缩短了泡沫液膜破裂的时间,降低了泡沫的稳定性。
2.4 乳化性能与HLB值的关系
如图3所示,蔗糖硬脂酸酯随HLB值减小,其乳化能力呈现先上升后下降的趋势,在HLB为8.83时达到最大值,乳化稳定性随单酯含量降低而降低。乳化剂的乳化能力根据其减少油水界面张力和扩散到新生成的界面能力的不同而不同[20],油水界面张力与扩散到新生成界面的能力与蔗糖酯中单、双、多酯的比例存在显著关系。实验结果表明在HLB为8.83时所对应的单、双、多酯的比例为使此蔗糖硬脂酸酯产品显现出较高的乳化能力。

图3 乳化能力和乳化稳定性与HLB值的关系Fig.3 The relationship between emulsibility,emulsibility stability and HLB value
2.5 HLB值与起泡性能、乳化性能的相关性分析
HLB值与起泡性能、乳化性能的相关系数如表4所示,HLB值与起泡能力在0.01水平上双侧显著相关,与泡沫稳定性、乳化稳定性在0.05水平上双侧显著相关,与乳化能力呈正向相关,相关系数为0.864。HLB值变化是由单酯、二酯、多酯含量协同作用产生的结果,由表4中相关系数可知,蔗糖硬脂酸酯组分含量与起泡能力关系更为密切,是决定起泡能力的重要因素,与泡沫稳定性、乳化稳定性也呈显著相关。

表4 HLB值与起泡性能、乳化性能的相关性分析Table 4 Correlation analyses between HLB value andfoaming, emulsifying properties
注:**在0.01水平上双侧显著相关;*在0.05水平上双侧显著相关
2.6 蔗糖硬脂酸酯的酶促合成
2.6.1产物结构鉴定
硅胶柱层析纯化反应产物,经1H-NMR,13C-NMR,ESI-MS鉴定,结果如下:
1H-NMR (500 MHz, CD3OD) 5.29 (dd,J=8.0 Hz, 1H), 4.29 (m, 1H), 4.07 (dd,J=12.0, 5.4 Hz, 1H), 3.99 (m, 1H), 3.92 (ddd,J=10.1, 5.4, 2.0 Hz, 1H), 3.88 (t,J=7.9 Hz, 1H), 3.67 (m, 4H), 3.51 (q,J=12.3 Hz, 2H), 3.32 (dd,J=9.7, 3.8 Hz, 1H), 3.18 (t,J=3.7 Hz, 1H), 2.26 (m, 2H), 1.51 (d,J=6.9 Hz, 2H), 1.19 (s, 32H), 0.81 (d,J=6.7 Hz, 3H)

ESI-MS (m/z) 643.8 [ M+Cl ]-, 631.7 [ M+Na ]+
经鉴定产物为蔗糖硬脂酸单酯。在此酶催化条件下,催化合成蔗糖硬脂酸单酯。
2.6.2酶促合成的蔗糖硬脂酸酯的HLB值测定
根据HLB值与水数的模拟参考方程,测定产物HLB值约为14.90,室温条件下具有良好的水溶性,证明产物含有较多未被酯化的羟基,符合蔗糖硬脂酸单酯含有较多的亲水性羟基的特点。
2.6.3蔗糖硬脂酸酯的起泡性能的测定
合成的蔗糖硬脂酸单酯在不同质量浓度的起泡能力如图4所示,合成的蔗糖硬脂酸酯起泡能力随质量浓度上升而呈上升趋势,在1.00 g/L质量浓度之后起泡能力基本不变,原因在于溶液达到临界胶束浓度后,随着部分泡沫破裂,起泡能力不再增加。泡沫稳定性在质量浓度为0.50 g/L之后出现下降趋势,原因在于随着质量浓度的增加,气液表面膜强度减小,泡沫容易破裂。

图4 蔗糖硬脂酸酯的起泡能力及泡沫稳定性与质量浓度的关系Fig.4 The relationship between foamability, foamingstability and concentration of sucrose stearate
2.6.4蔗糖硬脂酸酯乳化性能的测定
合成的蔗糖硬脂酸酯属于O/W型乳化剂,可以将不溶或溶解性较差的物质分散于水相。不同质量浓度的蔗糖硬脂酸酯的乳化能力和乳化稳定性如图5所示,合成的蔗糖硬脂酸酯的乳化能力随着质量浓度增加而增加,最高乳化能力达到72.32%,能够降低油水界面的张力而形成均一体系,具有较好的分散能力;其乳化稳定性最高为64.45%,可以使新形成的界面迅速被其单分子层所覆盖,界面保持稳定,形成均一、稳定的乳化体系。

图5 蔗糖硬脂酸酯的乳化能力及乳化稳定性与质量浓度的关系Fig.5 The relationship between emulsibility, emulsibilitystability and concentration of sucrose stearate
2.6.5商品化、酶促合成的蔗糖硬脂酸酯起泡性能、乳化性能的比较
如图6所示,商品化和酶促合成的蔗糖硬脂酸酯的起泡能力无明显差别,说明蔗糖硬脂酸酯起泡能力较低,可作为低泡乳化剂使用;而合成的蔗糖硬脂酸酯的泡沫稳定性明显低于商品化的蔗糖酯,可能由于前者组分单一,没有二酯、多酯的协同作用,泡沫排列不够紧密,排液速度增加,导致泡沫稳定性下降;合成的蔗糖硬脂酸酯的乳化能力和乳化稳定性略低于商品化蔗糖酯,但无明显差别,说明二酯、多酯对于蔗糖硬脂酸酯的乳化性能存在协同作用,略优于蔗糖硬脂酸单酯,但酶法合成蔗糖硬脂酸酯条件温和,更为绿色安全,可以作为替代其化学法合成的途径。

图6 商品化、酶促合成的蔗糖硬脂酸酯起泡性能、乳化性能的比较Fig.6 The comparison of foaming and emulsifying propertiesbetween commercialization and synthesized by enzymatic
3 结论
本研究结果表明,蔗糖硬脂酸酯的HLB值随单、二、多酯含量变化而变化,其中单酯含量与HLB值呈显著相关,HLB值与起泡能力、泡沫稳定性、乳化稳定性存在显著相关关系,乳化能力随HLB值减小呈先上升后下降的趋势;本研究探索了在有机相混合体系中,加入相转移催化剂十四烷基三甲基溴化铵,应用Novozymes TLIM固定化脂肪酶催化合成蔗糖硬脂酸单酯。此反应条件下合成的蔗糖硬脂酸单酯具有良好的水溶性,其HLB值为14.90,分别在1.00 g/L和2.00 g/L质量浓度时具有较好的起泡能力和乳化作用。本文为蔗糖硬脂酸酯的实际应用提供理论性指导以及对其酶法合成进行了新的探索,具有重要的实践应用价值。
[1]FERRER M,CRUCES M A,PLOU F J,et al.Chemical versus enzymatic catalysis for the regioselective synthesis of sucrose esters of fatty acids[J].Studies in Surface Science and Catalysis,2000,130:509-514.
[2]LU Yu-yun,YAN Ri-an,Ma Xiang,et al. Enzymatic hydrolysis preparation of mono-O-lauroyl sucrose via a mono-O-lauroylraffinose intermediate[J].Journal of Agricultural and Food Chemistry,2013,61(39):9 412-9 420.
[3]刘道林,赵谋明,赵强忠.蔗糖酯对酪蛋白乳浊液稳定性的影响[J].食品与发酵工业,2012,38 (5):73-76.
[4]REN K Z,LAMSAL B P.Synthesis of some glucose-fatty acid esters by lipase fromCandidaantarcticaand their emulsion functions[J].Food Chemistry,2017,214:556-563.
[6]王凤,陈诚,杨紫璇,等.不同乳化剂在中日两国面粉重油蛋糕面糊体系中的比较研究[J].食品与机械,2017,33(1):1-6.
[7]KLANG V,MATSKO N,ZIMMERMANN A M,et al.Enhancement of stability and skin permeation by sucrose stearate and cyclodextrins in progesterone nanoemulsions[J].International Journal of Pharmaceutics,2010,393(1-2):152-160.
[8]RITTHITHAM S,WIMMER R,STENSBALLE A, et al.Analysis and purification ofO-decanoyl sucrose regio-isomers by reversed phase high pressure liquid chromatography with evaporative light scattering detection[J].Journal of Chromatography A,2009,1216(25): 4 963-4 967.
[9]NETA N AS, dosSantos J C S, de Oliveira Sancho S,et al.Enzymatic synthesis of sugar esters and their potential as surface-active stabilizers of coconut milk emulsions [J].Food Hydrocoll,2012,27(2):324-331.
[10]GUO Dong-heng,JIN Zi,XU Yan-shan,et al.Scaling-up the synthesis of myristate glucose ester catalyzed by a calb-displaying pichia pastoris whole-cell biocatalyst[J].Enzyme and Microbial Technology,2015,75-76C:30-36.
[11]BERNAL C,ILLANCE A,WILSON L.Improvement of efficiency in the enzymatic synthesis of lactulose palmitate[J].Journal of Agricultural and Food Chemistry,2015,63(14):3 716-3 724.
[12]BERNAL C,ILLANES A,WILSON L.Heterofunctional hydrophilic hydrophobic porous silica as support for multipoint covalent immobilization of lipases: application to lactulose palmitate synthesis[J].Langmuir the Acs Journal of Surfaces & Colloids Langmuir,2014,30(12):3 557-3 566.
[13]WANG Xin-ran,MIAO Shi-da,WANG Ping,et al.Highly efficient synthesis of sucrose monolaurate by alkaline protease protex 6L[J].Bioresource Technology,2012,109(4):7-12.
[14]NETA N S,PERES A M,TEIXEIRA J A,et al.Maximization of fructose esters synthesis by response surface methodology[J]. New Biotechnol,2011,28(4): 349-355.
[15]JIA Cheng-sheng,ZHAO Jia,FENG Biao,et al.A simple approach for the selective enzymatic synthesis of dilauroyl maltose in organic media [J].Journal of Molecular Catalysis B:Enzymatic,2010,62(3):265-269.
[16]RITTHITHAM S,WIMMER R,PEDERSEN L H.Polar co-solvents in tertiary alcohols effect initial reaction rates and regioisomeric ratio ranging from 1.2 to 2.2 in a lipase catalysed synthesis of 6-o-and 60-o-stearoyl sucrose [J].Process Biochem,2011,46(4):931-935.
[17]LELTGEB M,KNEZ Z.The influence of water on the synthesis of n-Butyl oleate by immobilized mucor mlehel lipase[J].Journal of the American Oil Chemists' Society,1990,67(11):775-778.
[18]CAO Lin-qiu,BORNSCHEUER U T,SCHMID R D.Lipase-catalyzed solid-phase synthesis of sugar esters. Influence of immobilization on productivity and stability of the enzyme [J].Journal of Molecular Catalysis B: Enzymatic,1999,6(3):279-285.
[19]WANG Qing-hui,ZHANG Shu-fen,ZHANG Pei,et al.Separation and quantitation of sucrose esters using HPLC with evaporative light scattering detection[J].Journal of Liquid Chromatograpgy and Related Technologies,2006,29(16):2 399-2 412.
[20]GUPTA R K,JAMES K,SMITH, F J.Sucrose esters and sucrose ester/glyceride blends as emulsifiers[J].Journal of the American Oil Chemists’ Society,1983,60(4):862-869.
[21]GREENWALD H L,BROWN G L,FINEMAN M N.Determination of the hydrophile-lipophile character of surface active agents and oils by a water titration[J].Analytical Chemistry,1956, 28(11):1 693-1 697.
[22]王萍,杜理华,何秀娟,等.蔗糖棕榈酸单酯的选择性酶促合成及其性能研究[J].浙江工业大学学报,2012,40(5):488-492.
[23]王振虎,张灏,彭冬梅,等.淀粉糖油酸酯的酶法合成及其表面性质的研究[D].南京: 南京财经大学,2012:31-35.
[24]BILGI B,CELIK S.Solubility and emulsifying properties of barley protein concentrate[J].European Food Research and Technology,2004,218(5):437-441.
[25]PRASAD G S,WANG M L,RAJU C N,et al.Recent developments on phase-transfer catalytic reactions under ultrasound irradiation[J].Journal of the Taiwan Institute of Chemical Engineers,2017,70:56-73.
[26]于凤波,牟青春,赵婉馨.新型表面活性剂的设计与合成[J].中国医药导报,2014,11(31):82-86.
[27]LU Yu-yun,YAN Ri-an,MA Xiang,et al.Synthesis and characterization of raffinose fatty acid monoesters under-ultrasonic irradiation[J].European Food Research and Technology,2013,237:237-244.
[28]王一尘.蔗糖酯的合成与应用[M].北京,轻工业出版社,1998:10-12;125-151.

