夏南牛与13个黄牛群体mtDNA及微卫星DNA遗传多样性比较研究
王彦环,吴 慧,房兴堂,陈 宏,张春雷
(江苏师范大学 细胞与分子生物学研究所 生命科学学院,江苏 徐州 221116)
夏南牛是中国第一个肉牛新品种,以法国夏洛来牛作为父本和本地南阳牛作为母本杂交培育而成。与中国地方黄牛相比,其具有产肉率高及肉质好等特点,适合作为肉牛品种进行推广。当前,对夏南牛的研究主要集中在培育技术、牛肉品质和肉用性能等方面,但关于其品种资源现状缺乏系统了解。
微卫星DNA标记(Microsatellite DNA Marker)是一种新型的分子标记,也是当前研究遗传多样性最有效的分子手段之一,广泛应用于动植物起源进化、亲缘关系分析和遗传资源现状评估[1]。线粒体DNA( Mitochondrial DNA,mtDNA)也被认为是研究遗传多样性和亲缘关系很好的工具[2]。研究表明[3-4],在野马、野牦牛[5]、猪[6]、山羊等[7]多种动物中具有丰富的mtDNA遗传多样性。迄今为止,mtDNA分子结构中的D-loop区被证明是特别有用的遗传标记[8],因为它的进化速度比线粒体DNA的编码区快5~10倍[9]。本试验以夏南牛作为主要研究对象,通过微卫星DNA和mtDNA两种遗传标记方法,从分子水平上对夏南牛群体的遗传多样性进行探讨,并对夏南牛群体与其它地方黄牛品种和部分引进品种的亲缘关系进行比较分析,旨在为夏南牛遗传资源的保护、利用和今后的推广工作奠定分子遗传学基础。
1 材料与方法
1.1 样品采集
本研究采集12个黄牛群体的159不同个体的血样,以及夏洛来牛和西门塔尔牛冷冻精液样品各10份。14个黄牛群体分别是6个中国地方黄牛品种(秦川牛、南阳牛、郏县红牛、恩施牛、旱胜牛和蒙古牛)、4个培育品种(夏南牛、中国荷斯坦牛、草原红牛和德南牛)和4个外来牛种(安格斯牛、日本和牛、夏洛来牛和西门塔尔牛)。经颈静脉采血10 mL/只,置于-20 ℃保存备用。14个黄牛群体样本数等信息见表1。
1.2 基因组DNA的提取及检测
采用酚-氯仿法提取牛血样基因组DNA和冷冻精液DNA,结合1.5%琼脂糖凝胶电泳和紫外分光光度计进行DNA质量检测,产物置于-20 ℃冰箱保存备用。
1.3 mtDNA D-loop区和微卫星DNA座位扩增
本研究使用的黄牛mtDNA D-loop区扩增引物序列为[10]F:5'-CTGCAGTCTCACCATCAACC-3'; R:5'-GGGGTGTAGATGCTTGC- 3'。PCR反应体系为30 μL:2×Reaction Mix 15 μL, 上下游引物各1.5 μL(10 pmol/μL),基因组DNA模板1.5 μL(50 ng/μL),ddH2O 10.5 μL。扩增程序为:95 ℃预变性5 min;95 ℃变性30 s,64 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min;4 ℃保存。PCR产物以1.5% 的琼脂糖凝胶电泳检测合格后送至上海生工生物工程公司进行测序。
根据Sharma等[11]的研究筛选出14个微卫星位点(ETH10,ETH225,MM8,ILSTS06,ILSTS11,NRA63,CSSM08,BM1824,CSSM66,MM12,HEL1,CSRM60,INRA005和ILSTS34)。PCR反应体系为10 μL:2×Reaction Mix 5 μL, 上下游引物各为0.5 μL(10 pmol/μL),基因组DNA模板0.5 μL(50 ng/μL),ddH2O 3.5 μL。PCR扩增程序同上,产物用10%的聚丙烯凝胶电泳检测。
1.4 数据统计分析
根据测序峰图用DNAStar软件和Clustal X软件进行序列比对,使用MEGA 5.0分析mtDNA D-loop区序列的碱基组成。然后使用DnaSP 5.10软件计算序列的多态位点、单倍型多样度、核苷酸差异及Tajima's中性显著性检验。最后使用MEGA5.0软件基于Kimura 双参模计算遗传距离,并构建NJ系统发育树。微卫星数据通过Popgen32软件来分析等位基因数、有效等位基因数、杂合度、遗传距离等遗传多样性参数;Cervus3.0软件计算多态信息含量;及MEGA5.0软件中的邻接法构建基于遗传距离的系统发生树。
2 结果与分析
2.1 mtDNA D-loop区序列遗传多样性分析
以Genbank上普通牛和瘤牛(AY526085和AF492350)的D-loop区序列为标准,对序列进行整理,得到14个黄牛群体的mtDNA D-loop全序列,长度为910 bp,胸腺嘧啶(T)、胞嘧啶(C)、腺嘌呤(A)、鸟嘌呤(G)四种核苷酸的比例分别是29.0%(28.1%~29.5%)、24.4%(23.9%~25.2%)、32.9%(32.2%~33.4%)、13.7%(13.0%~14.0%),A+T的含量61.9%(61.2%~62.9%)显著高于G+C的含量38.1%(36.9%~39.2%)。夏南牛D-loop区全序列碱基T、C、A、G、含量分别为28.9%、24.7%、32.8%和13.6%,A+T的含量为61.7%,明显高于G+C的含量38.3%。夏南牛和其他13个黄牛群体D-loop区序列同样富含碱基A和T,表现出一定的碱基偏倚性,核苷酸组成上没有明显差异。
14个黄牛群体mtDNA D-loop全序列共检测出124个变异位点,60个(48.55%)变异位点集中在200~400 bp之间,说明该区域为mtDNA D-loop区的高变区。夏南牛mtDNA D-loop全序列共检测出49个变异位点,在200~400 bp之间的变异位点数占到44.89%,低于均值48.55%,其他群体较夏南牛多态性更为丰富。
14个黄牛群体mtDNA D-loop全序列变异中转换、颠换、 插入、缺失四种变异类型均存在,包括转换102次(82.26%)、颠换13次(10.48%)、转换与颠换共存5次(4.03%)、插入与缺失共4次(3.23%)。夏南牛D-loop区变异类型中转换有40次,颠换6次,转换/颠换共存1次,插入与缺失共2次,分别占总变异位点数(49)的81.63%、12.24%、2.04%和4.08%。夏南牛和其他13个黄牛群体的核苷酸突变位点的变异类型都以转换为主。
14个黄牛群体mtDNA D-loop区的单倍型多样度(Hd)、核苷酸多样度(Pi)和Tajima's D中性检验结果见表1。由表可知 ,Hd介于0.649~1.000之间,Pi介于0.005~0.028之间,各群体具有丰富的单倍型类型,秦川牛核苷酸多样度和单倍型多样度均最高,夏南牛核苷酸多样度和单倍型多样度较低,说明其品种遗传一致性较高。
对14个黄牛群体进Tajima's D中性检验,差异有统计学意义,秦川牛和蒙古牛的P值为0.05~0.10,其余黄牛群体的P值均大于0.10,说明14个黄牛群体均符合中性进化。
2.2 微卫星DNA遗传多样性分析
将微卫星PCR产物进行聚丙烯凝胶电泳发现14个微卫星位点有5个位点(HEL1、CSSM66、ETH10、ILSTS06和MM8)不具有多态性,其他9个位点高度多态。14个黄牛群体的PIC和H分别为0.608 ~0.798和0.695 ~0.837,夏南牛的PIC和H分别为0.692和0.715(表2),说明夏南牛的遗传多样性较中国黄牛低。9个微卫星位点在60个夏南牛个体中共发现47个等位基因,平均每个位点的等位基因数为5.22,有效等位基因数与等位基因数相差较小,说明等位基因在群体中的分布较均匀(表3)。以上结果与 mtDNA D-loop序列遗传多样性分析结果一致。

表1 14个黄牛群体mtDNA D-loop区序列单倍型、核苷酸多样度及Tajima's D中性检验Table 1 mtDNA D-loop haplotype diversity,nucleotide diversity and Tajima's D neutrality test in 14 yellow cattle populations
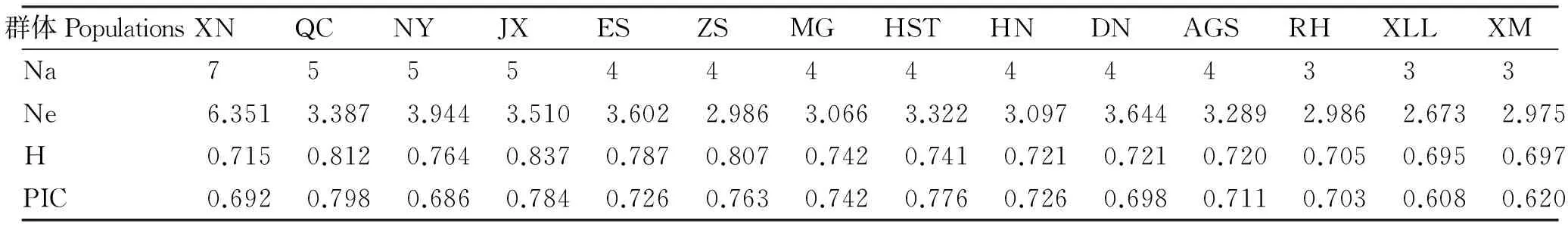
表2 14个黄牛群体的等位基因数、有效等位基因数、平均杂合度及多态信息含量Table 2 Numbers of alleles and effective alleles, average heterozygosity and polymorphism informationcontent in fourteen yellow cattle populations

表3 60个夏南牛个体在9个微卫星座位的遗传信息Table 3 The genetic information of sixty Xia'nan cattle of nine microsatellite locus
2.3 mtDNA D-loop区序列的遗传距离与系统进化分析
14个黄牛群体的遗传距离变化范围是0.001~0.048之间(表4),夏南牛与南阳牛的遗传距离最小,其次是夏洛来牛,这说明夏南牛与南阳牛的亲缘关系最近,而与其它中国地方黄牛群体亲缘关系较远,符合其遗传背景[12]。
从179条mtDNA D-loop全序列中统计出60种单倍型,根据Kimura 双参数模型和NJ法构建60种单倍型(Hap_1~ Hap_60)聚类图(图1)。由图1可知,60种单倍型被明显地分为两大分支,即普通牛和瘤牛。其中瘤牛单倍型6种,普通牛单倍型54种。瘤牛涉及的主要牛种有夏南牛、南阳牛、恩施牛和德南牛。其中,夏南牛在瘤牛单倍型中出现35次,占夏南牛总个体数的58.3%;在普通牛中出现25次,占夏南牛总个体数的41.7%;这说明夏南牛受瘤牛的影响更大,这跟其母本是南阳牛有关。
由图2A可知14个黄牛群体被分为四大类:草原红牛先与蒙古牛聚为一类,然后与早胜牛聚为一类,接着与日本和牛、荷斯坦牛聚在一起,再与安格斯牛聚在一起,然后与秦川牛、郏县红牛聚为一大类;夏洛来牛和西门塔尔牛聚为一类;南阳牛与夏南牛、德南牛和恩施牛聚为一大类。
2.4 微卫星DNA 的遗传距离与系统进化分析
14个黄牛群体的遗传距离取值范围为0.001~0.053(表5),夏南牛与南阳牛的遗传距离最小,仅为0.001。在图2B中,14个黄牛群体被分为三支,即蒙古牛、草原红牛、早胜牛、安格斯牛和日本和牛聚为一支;荷斯坦牛、秦川牛和郏县红牛聚为一支;南阳牛、夏南牛、夏洛来牛、西门塔尔牛、德南牛和恩施牛聚为一类。以上分析结果与mtDNA D-loop区序列分析结果基本一致。

图1 14个黄牛群体60种单倍型的聚类图indicus代表瘤牛,taurus代表普通牛Fig.1 Cluster of sixty haplotype in fourteen yellow cattle populationsThe indicus represents zebu and taurus represents Bos Taurus

群体PopulationsXNQCNYJXESZSMGHSTHNDNAGSRHXLLXNQC0.027NY0.0190.024JX0.0250.0280.013ES0.0320.0290.0390.039ZS0.0220.0260.0070.0150.042MG0.0260.0290.0110.0180.0450.012HST0.0230.0270.0080.0150.0420.0090.013HN0.0210.0250.0060.0130.0390.0050.0040.008DN0.0340.0310.0440.0430.0190.0470.0480.0460.044AGS0.0240.0270.0090.0160.0420.0100.0140.0040.0090.046RH0.0210.0250.0050.0140.0410.0070.0110.0040.0060.0480.009XLL0.0210.0240.0050.0120.0400.0060.0090.0080.0070.0440.0080.004XM0.0190.0230.0040.0120.0390.0050.0080.0060.0110.0430.0070.0040.001
3 讨 论
3.1 遗传多样性分析
14个黄牛群体的mtDNA D-loop区全序列 A+T平均含量(61.5%)明显高于G+C含量(38.5%),夏南牛mtDNA D-loop区全序列A+T平均含量为61.7%显著高于G+C含量38.3%,核苷酸的组成表现出碱基偏好性。张桂香等[13]表明黄牛D-loop区序列中,A+T平均含量为61.7%;雷初朝等[14]发现在中国8个黄牛品种D-loop区序列中,A+T平均含量为61.65%。表明夏南牛与其他13个黄牛群体都具有较高的A、T碱基偏好性。宋乔乔等[15]认为线粒体基因密码子偏好性与线粒体序列一样,均可用于物种亲缘关系的研究。本研究夏南牛mtDNA D-loop全序列共检测出49个变异位点,其中22个(44.89%)变异位点集中在200~400 bp之间,证实了黄牛D-loop区序列主要的高变区位于241~610 bp[16]。

表5 基于微卫星位点的14个黄牛群体间的遗传距离Table 5 Genetic distance based on microsatellite loci in fourteen yellow cattle populations

图2 A. 基于mtDNA D-loop区序列的14个黄牛群体的NJ聚类树;B. 基于微卫星位点的14个黄牛群体的NJ聚类树Fig.2 A. Based on mtDNA D-loop sequence of NJ clustering figure in fourteen yellow cattle populations;B. Based on microsatellite loci of NJ clustering figure in fourteen yellow cattle populations
评估mtDNA遗传多样性最主要的两个指标是单倍型多样度(Hd)和核苷酸多样度(Pi),其数值与遗传多样性呈正相关。蔡欣等[17]测的中国17个黄牛品种D-loop区序列,Hd值为0.919±0.027,Pi值为0.02678±0.00050。本研究中14个黄牛群体平均Hd和Pi值分别为0.649~1.000和0.005~0.028,研究结果与蔡欣基本一致,表明14个黄牛群体都具有丰富的遗传多样性。夏南牛Hd和Pi值为0.732±0.017和0.007,表明夏南牛D-loop区序列进化稳定,同时也具有较高的遗传多样性。
本研究所选取的14个微卫星位点[11]在11个印度牛群中均具有多态性,而本试验发现中国和欧洲黄牛群体中仅有9个微卫星位点具有多态性,表明印度牛的遗传多样性较这些牛丰富。位点多态信息含量(PIC)是等位基因频率和数量变化的参数,可描述群体变异的程度。汪聪勇[18]等选用8个微卫星DNA标记研究40头夏南牛的遗传多样性,平均PIC在0.570~0.786,微卫星位点ETH225和BM1824的PIC分别为0.786和0.775,这与本研究结果一致。本研究中9个微卫星位点均为高度多态,其中,秦川牛的PIC(0.798)最高,夏南牛的PIC较低,为0.692。
杂合度(H)是衡量群体遗传性的最适参数,用来反映种群纯合度的大小。王斌等[19]利用12个微卫星位点分析秦巴山区4个黄牛群体的平均杂合度为0.6672~0.7241。本研究中14个黄牛群体的平均H在0.695~0.837,表明14个黄牛群体具有丰富的遗传变异和较高的遗传多样性,杂合度最高的是郏县红牛0.837,夏南牛的H较低,为0.715,夏洛来牛的H最低为0.695,进一步证实了中国黄牛的遗传多样性较外来牛种更丰富,这与mtDNA分子标记得出的结果一致。
3.2 遗传距离与系统进化分析
mtDNA D-loop序列遵循母系遗传,属于细胞质遗传[20],微卫星DNA属于细胞核遗传,遵循孟德尔遗传定律[21]。利用mtDNA D-loop和微卫星DNA两种标记的目的是验证细胞核和细胞质遗传下黄牛群体的亲缘关系。遗传距离是衡量群体间亲缘关系的重要指标,遗传距离越小,说明亲缘关系越近,反之则越远。14个黄牛群体两两之间的遗传距离表明,夏南牛和南阳牛遗传距离最近,其次是夏洛来牛。此外,草原红牛与蒙古牛的遗传距离也较小,说明它们的亲缘关系很近,这主要因为草原红牛是由蒙古牛与短角牛进行杂交而成。
陈幼春等[22]和陈宏等[23]曾分别利用蛋白质多态和染色体带型分析研究中国黄牛之间的相互关系及起源进化,他们均认为我国黄牛为普通牛和瘤牛的混合起源。北方牛(草原红牛、蒙古牛等)受普通牛的影响较大,南方牛(恩施牛、德南牛等)受瘤牛的影响较大,中原牛(秦川牛、南阳牛、郏县红牛等)同时受两种牛的影响。本研究分析了14个黄牛群体的单倍型分布和聚类(图1),夏南牛在6种瘤牛单倍型中出现35次,占夏南牛总个体数的58.3%,说明夏南牛受瘤牛的影响更大,可能因为其母本是南阳牛。根据mtDNA D-loop区序列构建的 NJ进化树(图2A)表明,14个黄牛群体被分为两大分支四大类:草原红牛、蒙古牛、早胜牛、日本和牛、荷斯坦牛和安格斯牛聚为一类,这可能因为它们起源于普通牛[24];秦川牛、郏县红牛聚为一类,这可能因为它们起源于中原黄牛;而南阳牛、夏南牛、德南牛和恩施牛聚为一大类,恩施牛和德南牛主要起源于瘤牛[25],原因是其分布于长江以南地区,地理位置较为接近,遗传距离较近,瘤牛的特征非常明显,属于南方牛种。南阳牛、夏南牛和德南牛聚为一类,因为夏南牛和德南牛均是以南阳牛作为母本培育而成。采用mtDNA和微卫星两种方法,基于Kimura双参数模型对14个黄牛群体构建的系统发育树聚类结果基本一致,均显示出2个聚类簇。在微卫星DNA的系统进化树中,夏南牛、南阳牛与夏洛来牛聚为一类,说明三者间的亲缘关系很近,这符合夏南牛是由夏洛来牛为父本、南阳牛为母本杂交而成的遗传背景[12]。然而在mtDNA的系统进化树中,夏南牛仅与南阳牛聚为一类,这是因为mtDNA D-loop序列属于母系遗传。
3.3 夏南牛遗传资源的保护和利用
夏南牛因具有产肉率高、适合生产等特点,其牛肉已销往世界。然而,作为我国第一个肉用牛种,夏南牛在遗传多样性的研究和育种方面还有大量的工作要做。本试验采用微卫星DNA和mtDNA D-loop序列两种分子遗传标记方法,从分子水平上分析了夏南牛群体的遗传多样性及与其他黄牛的亲缘关系,为夏南牛遗传资源的保护、合理利用和选育改良提供参考资料,并为夏南牛今后的推广工作奠定了分子遗传学基础。
4 结 论
本试验微卫星DNA与mtDNA D-loop分子标记的研究结果基本一致,即14个黄牛群体具有较高的遗传变异和丰富的遗传多样性,但夏南牛群体的遗传多样性较中国地方黄牛低。夏南牛和南阳牛遗传距离最小,两者亲缘关系最近,符合其遗传背景,夏南牛受瘤牛的影响更大。
参考文献:
[1]PUTMAN A I,CARBONE I.Challenges in analysis and interpretation of microsatellite data for population genetic studies[J].Ecology & Evolution,2014, 4(22):4 399.
[2]LOFTIS D G,ECHELLE A A,KOIKE H,et al.Genetic structure of wild populations of the endangered Desert Pupfish complex (Cyprinodontidae: Cyprinodon).[J].Conservation Genetics, 2009, 10(2):453-463.
[3]ACHILLI A,OLIVIERI A,SOARES P,et al.Mitochondrial genomes from modern horses reveal the major haplogroups that underwent domestication[J]. P Natl Acad Sci USA,2012, 109(7):2 449-2 454.
[4]LIPPOLD S,MATZKE N J,REISSMANN M,et al.Whole mitochondrial genome sequencing of domestic horses reveals incorporation of extensive wild horse diversity during domestication[J].BMC Evolutionary Biology, 2011, 11(1):328.
[5]马志杰,钟金城,韩建林,等.野牦牛(Bosgrunniensmutus) mtDNA D-Loop区的遗传多样性[J].生态学报,2009,29(9): 4 799-4 803.
[6]孙俊丽,张冰,马青艳,等.陆川猪mtDNA D-loop序列遗传多样性分析[J].中国畜牧兽医,2010,37(6):122-124.
[7]FAN H,ZHAO F,ZHU C,et al.Complete mitochondrial genome sequences of Chinese indigenous sheep with different tail types and an analysis of phylogenetic evolution in domestic sheep[J].Asian-Australas J Anim Sci, 2016, 29(5):631-639.
[8]HOOD G R,FORBES AA,POWELL T H,et al.Sequential divergence and the multiplicative origin of community diversity[J].Proceedings of the National Academy of Sciences, 2015, 112(44): E5 980-E5 989.
[9]GALTIER N, NABHOLZ B,GL?MIN S,et al.Mitochondrial DNA as a marker of molecular diversity: a reappraisal.[J]. Molecular Ecology, 2009, 18(22):4 541-4 550.
[10]SAMBROOK J, RUSSELL D W. Molicular Cloning[M].New York: Cold Spring Harbor Laboratory Press, 2001.
[11]SHARMA R,KISHORE A,MUKESH M,et al.Genetic diversity and relationship of Indian cattle inferred from microsatellite and mitochondrial DNA markers[J].BMC Genetics, 2015, 16(1):73.
[12]姚恒林,祁光磊,王之保,等.河南省泌阳县“南阳牛导入夏洛来杂交育种”工作进展[J].黄牛杂志,2001,27(6): 52-54.
[13]张桂香,郑友民,王志刚,等.我国部分黄牛品种线粒体区D-loop区遗传多样性与起源分化[J].遗传学报,2009,31(2): 160-168.
[14]雷初朝,陈宏,杨公社,等.中国部分黄牛品种mtDNA遗传多态性研究[J].Journal of Genetics & genomics, 2004, 31(1): 57-62.
[15]宋乔乔,钟金城.牛亚科动物线粒体基因密码子偏好性及聚类分析[J].西北农业学报,2013,22(10): 1-8.
[16]HUTCHISON C A 3RD, NEWBOLD J E, POTTER S S, et al. Maternal inheritance of mammalian mitochondrial DNA[J]. Nature, 1974, 251(5475):536-538.
[17]蔡欣,陈宏,雷初朝,等.中国17个黄牛品种mtDNA变异特征与多态性分析[J].中国生物化学与分子生物学报,2007,23(8): 666-674.
[18]汪聪勇,高腾云,祁兴磊,等.夏南牛体尺性状与微卫星DNA的相关分析[J].西南大学学报,2010,32(2): 45-51.
[19]王斌,昝林森,余横伟,等.秦巴山区黄牛群体的微卫星DNA遗传多样性[J].农业生物技术学报,2016,24(2): 233-244.
[20]曹红鹤.肉牛主要生产性状的生化和分子遗传标记研究[D].北京:中国农业大学,2000.
[21]NEI M,ROYCHOUDHURY A K.Sampling variances of heterozygosity and genetic distance[J].Genetics,1974, 76(2): 379-390.
[22]陈幼春,曹红鹤.中国黄牛品种多样性及其保护[J].生物多样性,2001,9(3): 275-283.
[23]陈宏,邱怀,詹铁生,等.中国四种黄牛性染色体多态性的研究[J].遗传,1993,15(4)14-17.
[24]王飞.北方地区地方品种牛线粒体DNA多态性和亲缘关系研究[D].长春:吉林大学,2007.
[25]辛亚平.中国部分黄牛群体Y染色体微卫星多态性与分子进化及生产性能关系初步研究[D].陕西杨凌:西北农林科技大学,2007.

