黄蜀葵提取物灌胃对脑缺血再灌注损伤小鼠神经损伤的防治作用及其机制探讨
曹建文,颜丙春
(1扬州大学医学院,江苏扬州 225000;2江苏省中西医结合老年病防治重点实验室)
脑缺血再灌注损伤是指脑缺血恢复血液供应后,过量的自由基攻击对部分重新获得血供的组织细胞造成的损伤[1]。脑缺血再灌注损伤的机制是一个多因素参与的复杂级联反应,如氧自由基、炎症因子产生增多、细胞内钙超载、兴奋性氨基酸受体过度激活产生神经兴奋性毒性和细胞凋亡等[2,3]。由于脑缺血再灌注损伤机制比较复杂,现阶段药物治疗此病未能取得令人满意的效果。因此,进一步研究缺血再灌注损伤的发病机制,并在此基础上寻找有效的防治药物具有重要的意义。黄蜀葵为锦葵科秋葵属植物,主要含黄酮类、有机酸类、甾类及挥发性成分,具有消炎止痛、抗氧化等药理活性[4]。有研究[5]表明,黄蜀葵提取物对心脑血管具有一定的保护作用。本研究观察了黄蜀葵提取物对脑缺血再灌注损伤小鼠神经损伤的防治作用,并探讨其可能机制。
1 材料与方法
1.1主要药物与试剂黄蜀葵提取物由扬州大学医学院药学系提供;2,3,5-氯化三苯基四氮唑(TTC,Sigma公司),神经元核抗原抗体(兔抗NeuN,Cell Signaling Technology公司),总蛋白提取试剂盒(KeyGEN公司),BCA法蛋白浓度测定试剂盒(Thermo Scientific公司),超氧化物歧化酶1(兔抗SOD-1)、兔抗SOD-2(Arigo公司),内参抗体(直标β-actin,联科生物技术有限公司),羊抗兔IgG或兔抗羊IgG(Santa Cruz公司)。
1.2实验动物ICR小鼠48只,雄性,出生后7~8周,体质量30 g,均购买于扬州大学比较医学中心[SCCXK(苏)2012-0004],实验动物被饲养在常规的实验动物室,温度23 ℃,湿度60%,12 h光照/12 h黑暗,自由饮食。实验中所有涉及动物实验的条件均符合扬州大学动物伦理委员会要求。
1.3实验分组、黄蜀葵提取物应用及脑缺血再灌注损伤模型制备48只小鼠随机分为A、B、C、D组各12只。A、B组小鼠制备模型前7天灌胃30、10 mg/kg黄蜀葵提取物(用0.9%生理盐水稀释配置),1次/d,每次0.2 mL;C、D组制模前给予等量生理盐水。末次给药30 min后,A、B、C组依据大脑中动脉堵塞法制备脑缺血再灌注损伤模型,即小鼠用异氟烷气体麻醉,颈部正中切口,分离左侧颈总、颈内及颈外动脉,依次结扎相关血管后,以动脉瘤夹夹住颈内动脉,其后在颈总动正中、距离颈部内外动脉分叉部4 mm处剪一小口,将栓线(1622-A4型)从切口插入,后解除颈内动脉夹闭,将栓线缓慢并轻巧地插入颈内动脉(约10 mm),用细线在颈内动脉处系牢栓线。1 h后拔出栓线,血管充盈并有搏动示意成功再灌注;D组只分离颈部两侧肌肉、血管。术中监测各组小鼠肛温,使体温始终保持在(37±0.5)℃。所有小鼠均在脑缺血1 h、再灌注24 h后处死。
1.4小鼠神经功能缺损程度评分各组小鼠制模24 h后行神经功能缺损程度评分,具体参考Longa神经评分法。0分:正常,无神经功能缺损;1分:左侧前爪不能完全伸展,轻度神经功能缺损;2分:行走时,小鼠向左侧(瘫痪侧)转圈,中度神经功能缺损;3分:行走时,小鼠身体向左侧(瘫痪侧)倾倒,重度神经功能缺损;4分:不能自发行走,有意识丧失。分值越高说明小鼠神经行为障碍越严重。
1.5小鼠脑梗死体积测定制模24 h后随机取各组小鼠6只腹腔注射10%水合氯醛(0.2 mL),麻醉后取脑备用,脑组织于-20 ℃冷冻约10 min后置于脑模具中,冠状位切片,连续取4片脑组织,用新鲜配制的2%TTC溶液避光染色,为使染色更均匀,期间翻动切片2次,最后用4%多聚甲醛固定24 h,拍照,图像同时输入电脑,用Image-pro plus6.0图像分析软件测量脑梗死体积,具体方法为先计算每片脑梗死区域的面积然后乘以2 mm,最后每片梗死体积相加即为脑梗死体积。将测完的脑组织放入30%的蔗糖溶液中约24 h,利用冷冻切片机将组织切为30 μm的组织切片以供免疫组化染色使用。
1.6海马CA1区NeuN阳性细胞数计数采用ABC-DAB免疫组化法染色。每一张脑组织切片依次在用PBS稀释的0.3%过氧化氢中20 min和5%BSA中30 min,然后用稀释的兔抗NeuN(1∶1 000)孵育,4 ℃过夜。此后,经二抗(1∶250)处理,通过二氨基联苯胺进行显色。将组织贴片,脱水,用加拿大香脂胶盖片。为了确认染色的特异性,对照染色用免疫血清来代替一抗,其他步骤一致。待玻片完全干燥后,在显微镜下观察染色结果,并取小鼠海马CA1区照相,计数NeuN阳性细胞数,以此评定神经元损伤情况。
1.7海马梗死区SOD1、SOD2蛋白相对表达量测算制模24 h取各组剩余的6只小鼠,麻醉取脑,将缺血侧海马区分离出来。分离出来的脑组织在总蛋白提取试剂盒进行预处理。匀浆,提取蛋白,再离心。BCA法蛋白浓度测定试剂盒测定蛋白浓度。SDS-PAGE电泳,将蛋白条带转移至PVDF膜,含5%脱脂奶粉的封闭液封闭1 h,分别加入兔抗SOD-1、兔抗SOD-2,4 ℃过夜,加入二抗,37 ℃孵育1 h,加入显影液显色,在Bio-Rad自动凝胶成像系统中拍照,以β-actin为内参。以目标蛋白SOD1、SOD2的灰度值与β-actin灰度值的比值评定SOD蛋白相对表达量变化情况。
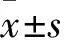
2 结果
2.1各组神经功能缺损程度评分、脑梗死体积、NeuN阳性细胞数比较神经功能缺损程度评分、脑梗死体积、NeuN阳性细胞数比较见表1。
2.2各组SOD1、SOD2蛋白相对表达量比较SOD1、SOD2蛋白相对表达量比较见表2。
3 讨论
脑缺血再灌注损伤是一个复杂的过程,这其中既包括缺血期的原发性损伤也有再灌注期的继发性损伤。缺血性脑卒中病理机制复杂,氧化应激在脑缺血再灌注导致的神经损伤中扮演重要的作用[6,7],脑缺血再灌注后细胞产生和清除氧自由基的平衡遭到破坏,致使组织被大量活性氧损伤而导致严重的氧化应激反应,最终导致神经损伤[8]。所以,如何有效减轻缺血性脑卒中后氧化应激反应、清除自由基、减少脑组织神经元坏死和凋亡至关重要。SOD是机体内重要的一种抗氧化酶,是清除自由基的首要物质。通过SOD发挥作用的内源性抗氧化防御机制,在减少和清除自由基的过程中发挥着重要作用[9]。

表1 各组神经功能缺损程度评分、脑梗死体积、NeuN阳性细胞数比较
注:与D组比较,*P<0.05;与C组比较,△P<0.05;与B组比较,#P<0.05。

表2 各组SOD1、SOD2蛋白相对表达量比较
注:与D组比较,*P<0.05;与C组比较,△P<0.05;与B组比较,#P<0.05。
黄蜀葵作为一种中国传统中药材,具有活血止血、消肿解毒的功效。众多研究[10,11]表明,黄蜀葵提取物具有抗氧化、抗血栓形成、抗炎、清除自由基等作用。高杉等[12]发现,50、100 mg/kg黄蜀葵可明显抑制脑水肿发生,并且明显改善脑组织的病理学改变。文继月等[13]观察了黄蜀葵预处理对小鼠脑缺血再灌注损伤的保护作用,结果表明黄蜀葵预处理的实验动物脑梗死面积明显减少,血清乳酸脱氢酶、丙二醛和前列腺素水平降低,血清一氧化氮合成酶活性和一氧化氮水平升高。这表明黄蜀葵具有保护脑缺血损伤的作用,推测可能与促进NO合成及抑制前列腺素产生有关。本研究显示,与D组比较,A、B、C组的神经功能缺损程度评分、脑梗死体积增加,NeuN阳性细胞数减少;与C组比较,A、B组的神经功能缺损程度评分、脑梗死体积减少,NeuN阳性细胞数增加;与B组比较,A组的神经功能缺损程度评分、脑梗死体积减少,NeuN阳性细胞数增加。表明黄蜀葵提取物明显抑制了缺血损伤后所致神经损伤。本研究还显示,与D组比较, SOD1、SOD2蛋白相对表达量降低;与C组比较,A、B组的SOD1、SOD2蛋白相对表达量升高;与B组比较,A组的SOD1、SOD2蛋白相对表达量升高。提示黄蜀葵提取物对神经损伤的保护作用与其明显提高机体抗氧化酶的水平密切相关。
总之,黄蜀葵提取物对脑缺血再灌注损伤小鼠神经损伤有防治作用,机制可能与其提高SOD1、SOD2蛋白水平有关。
参考文献:
[1] 陈玉敏,陈涛平,冯浩楼.脑缺血再灌注损伤机制与治疗现状[J].医学研究与教育,2012,29(6):47-54.
[2] 刘俊伟,任冶龙,刘旭玲,等.人参皂苷Rb1对大鼠局灶性脑缺血再灌注损伤后脑梗死体积及脑组织和血清IL-1β的影响[J].中国中西医结合杂志,2013,33(12):1696-1700.
[3] Liu X, Zhang X, Zhang J, et al. Diosmin protects against cerebral ischemia/reperfusion injury through activating JAK2/STAT3 signal pathway in mice[J]. Neuroscience, 2014,268:318-327.
[4] 温锐,谢国勇,李旭森,等.黄蜀葵化学成分与药理活性研究进展[J].中国野生植物资源,2015,34(2):37-44.
[5] 周兰兰,岑德意,陈志武,等.黄蜀葵总黄酮对心脑缺氧损伤的保护作用[J].中国中医基础医学杂志,2000,6(7):22-24.
[6] Sharma T, Airao V, Panara N, et al. Solasodine protects rat brain against ischemia/reperfusion injury through its antioxidant activity[J]. Eur J Pharmacol, 2014,725:40-46.
[7] Liu Y, Zhang L, Liang J. Activation of the Nrf2 defense pathway contributes to neuroprotective effects of phloretin on oxidative stress injury after cerebral ischemia/reperfusion in rats[J]. J Neurol Sci, 2015,351(1-2):88-92.
[8] Radak D, Resanovic I, Isenovic ER. Link between oxidative stress and acute brain ischemia[J]. Angiology, 2014,65(8):667-676.
[9] Wu CX, Liu R, Gao M, et al. Pinocembrin protects brain against ischemia/reperfusion injury by attenuating endoplasmic reticulum stress induced apoptosis[J]. Neurosci Lett, 2013,546:57-62.
[10] 梁文波,覃柳燕,严方明.中药材黄蜀葵的研究现状及存在问题[J].农业研究与应用,2012(5):48-52.
[11] 谭业华,陈珍,顾种宜.中草药黄蜀葵的研究现状与展望[J].海南师范学院学报(自然科学版),2006,19(2):163-167.
[12] 高杉,范丽,董六一,等.黄蜀葵总黄酮对大鼠急性不完全脑缺血损伤的保护作用[J].中国临床药理学与治疗学,2003,8(2):167-169.
[13] 文继月,陈志武.黄蜀葵花总黄酮预处理对大鼠脑缺血再灌注性损伤的保护作用[J].安徽医科大学学报,2006,41(6):667-669.

