KU55933对化疗后胶质母细胞瘤细胞株U87增殖、凋亡的影响及其机制探讨
王倩,蔡炜嵩
(中国医科大学附属盛京医院,沈阳 110000)
脑胶质瘤是颅内常见的原发性肿瘤,约占颅内肿瘤的30%;其中WHO Ⅳ级的恶性胶质母细胞瘤(GBM)约占胶质瘤的50%,且恶性程度高,预后差,中位复发期为7个月,中位生存时间12~14个月。NCCN指南推荐行最大范围手术切除,术后行病灶区放疗同步及辅助替莫唑胺(TMZ)化疗。TMZ为DNA烷化剂,是针对GBM的一线化疗药物,可以通过血脑屏障。然而,GMB容易对放化疗耐受,即使大剂量放化疗同样易于复发[1]。研究[2,3]显示,肿瘤对治疗抵抗多与细胞周期时相、细胞周期检查点及DNA损伤修复相关。共济失调毛细血管扩张突变基因(ATM)功能缺陷可导致共济失调毛细血管扩张症,其可表现出对放疗敏感性增加[4]。ATM/ATR基因在促进肿瘤细胞耐细胞毒性治疗方案中起核心作用,其可引起细胞周期阻滞,促进DNA修复,维持基因组稳定性。ATM/ATR阻滞剂可提高GBM细胞放疗敏感性[5]。KU55933为经典的ATM阻滞剂,KU55933联合放疗可使放疗引起的细胞周期阻滞消失[6,7]。本研究观察了KU55933对化疗后U87细胞增殖、凋亡的影响,并探讨其机制。
1 材料与方法
1.1ATM/ATR阻滞剂、药物、细胞及试剂KU55933购于美国Selleck公司;TMZ购于默沙东制药公司;U87细胞为本实验室保存;DMEM培养基购于Hyclone公司,标准胎牛血清购于天晴灏洋生物制品科技有限公司,DMSO购于美国Sigma公司,细胞周期检测点激酶1(Chk1)、细胞周期检测点激酶2(Chk2)、磷酸化Chk1(pChk1)、磷酸化Chk2(pChk2)、细胞周期蛋白B(Cyclin B)、细胞周期蛋白D1(Cyclin D1)多克隆抗体购自博士得公司。
1.2 U87细胞培养 细胞用高糖DMEM培养基(含 10%胎牛血清)培养基培养,37 ℃恒温培养箱内生长。当细胞长满培养瓶底85%或接近汇合成片时开始传代,每隔2~3天换液1次,至对数生长期再传代。
1.3 KU55933对U87细胞增殖能力影响观察 采用CCK-8法。取传3代对数生长期U87细胞,0.25%胰酶消化,加入含10%FBS的DMEM培养液稀释,制备成单细胞悬液,接种于96孔板中,接种密度为3×104/mL。后随机分为KU55933组、替莫唑胺组、空白组,每组设3个复孔。置于37 ℃、5%CO2细胞培养箱中常规培养。KU55933组细胞隔夜后加入10 μmol/L的KU55933,1 h后加入50 mg/mL的替莫唑胺(TMZ);替莫唑胺组细胞隔夜后加入50 mg/mL的TMZ;空白组不特殊处理。3组分别于24、48、72 h后更换培养基100 μL/孔,每孔加CCK-8溶液10 μL孵育2 h终止培养,在酶标仪上测定460 nm波长处各孔OD值,以此表示U87细胞的增殖情况。实验重复3次,取平均值。
1.4 KU55933对U87细胞凋亡能力影响观察 采用流式细胞术。实验分组及处理方法同1.3,培养后取传3代对数生长期U87细胞,用不含EDTA的胰酶消化收集。PBS洗涤细胞2次(800 r/min离心5 min)收集1×105~5×105细胞;加入500 μL的Binding Buffer悬浮细胞;加入5 μL Annexin V-FITC混匀后,加入5 μL Propidium Iodide,混匀;室温、避光、反应5~15 min;用流失细胞仪和Flowjo软件测算各组培养48 h后的细胞凋亡率。实验重复3次,取平均值。
1.5 KU55933对U87细胞ATM/ATR下游通路蛋白表达影响观察 采用Western blotting法。实验分组及处理方法同“1.3”。各实验组处理48 h后,加入0.25%胰酶消化收集各组U87细胞,PBS洗涤2次后离心。加入已经添加蛋白酶阻滞剂的RIPA细胞裂解液,收集上清并检测蛋白浓度。BCA法蛋白定量合格后,移至EP管中,加入等量上样缓冲液,100 ℃水浴5 min,行SDS-PAGE,并转印至PVDF膜上,5%脱脂牛奶封闭2 h,分别加入Chk1、pChk1、Chk2、pChk2、Cyclin B、Cyclin D1、Caspase抗体,4 ℃孵育过夜;PBS冲洗3次,加入辣根过氧化物酶标记的二抗,室温振荡孵育2 h;PBS冲洗3次,ECL显色,凝胶成像分析系统采集图像。以GAPDH为内参,以目的蛋白电泳条带灰度值与GAPDH蛋白电泳条带灰度值的比值作为目的蛋白的相对表达量。实验重复3次,取平均值。
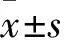
2 结果
2.1各组细胞OD值比较 细胞OD值比较见表1。

表1 培养不同时点各组细胞OD值比较
注:与空白组比较,#P<0.05;与替莫唑胺组比较,*P<0.05。
2.2各组细胞凋亡率比较 KU55933组、替莫唑胺组、空白组细胞凋亡率分别为23.36%±0.56%、12.76%±0.25%、5.58%±0.36%,KU55933组、替莫唑胺组与空白组比较,KU55933组与替莫唑胺组比较,P均<0.05。
2.3各组细胞ATM/ATR下游通路蛋白相对表达量比较 细胞ATM/ATR下游通路蛋白相对表达量比较见表2。

表2 各组细胞ATM/ATR下游通路蛋白相对表达量比较
注:与空白组比较,#P<0.05;与替莫唑胺组比较,*P<0.05。
3 讨论
GMB在脑瘤中很常见,术后复发率高,其对于辐射或化疗药物抗拒导致治疗失败是个世界性难题。TMZ为一线治疗药物,通常应用于同步及辅助化疗。研究[8]认为,细胞凋亡是TMZ导致细胞毒性的主要机制。TMZ可导致细胞双链DNA断裂,诱导细胞周期G2/M期阻滞,从而导致其发生凋亡[9]。化疗耐药是造成GMB治疗失败的主要原因。关于化疗耐药机制的研究主要集中在多个方面,如MSH6错配修复基因、低氧诱导对细胞毒性药物的抵抗、细胞骨架重排、肿瘤干细胞学说等多个方面[10~13]。由于细胞周期阻滞与DNA的修复与细胞辐射敏感性的密切关系,ATM/ATR通路逆转细胞周期阻滞,促进DNA的修复使细胞避免凋亡,导致TMZ化疗耐药,故该通路可能成为化疗敏感性研究的一个切入点。本研究显示,KU55933组、替莫唑胺组24、48、72 h的OD值较空白组减,KU55933组24、48、72 h的OD值较替莫唑胺组减少;KU55933组、替莫唑胺组细胞凋亡率较空白组增加,KU55933组细胞凋亡率较替莫唑胺组增加。提示KU55933可抑制化疗后U87细胞的增殖,促进其凋亡。
ATM/ATR基因属于DNA修复基因,在细胞周期调控、DNA损伤识别和修复中处于关键位置。而Chk1和Chk2是细胞周期检测中最为关键的效应酶。DNA损伤后,ATM/ATR立即被激活,作用于下游底物引起细胞周期阻滞并激活DNA修复系统,与细胞周期检测点相互协调以维持基因组稳定性,使细胞能够正常增殖分化,避免凋亡,以应对离子辐射以及一些免疫抑制药物造成的DNA损伤[14]。以上极有可能为癌细胞抗拒放化疗的通路之一。Crescenzi等[15]指出,ATM为固定早衰表型所必需基因,从而使癌细胞即使暴露于细胞毒性药物中仍可存活,导致耐药。因此,若我们人为的抑制ATM/ATR蛋白,阻断Chk1、Chk2磷酸化,从而阻断上述通路,可能逆转抗药。文献[16]报道,KU55933可提高肿瘤对放化疗的敏感性。DNA损伤修复的信号传导过程中的一个重要过程即为细胞周期阻滞,Chk1和Chk2在细胞周期检测中发挥极其重要的作用,主要调节S期和(或)G2/M期检测点,抑制Chk1和Chk2激活或蛋白表达,可有效消除肿瘤细胞在放射线或化疗药物作用后的细胞周期阻滞,增加放化疗的敏感性[17]。文献[18]报道,恶性黑素细胞肿瘤在接受一定剂量的射线照射后发生G2/M期阻滞,细胞Cyclin B1表达减少。而Cyclin D是细胞周期运行的起始因子,其在G1早期表达增加,与细胞中的CDK4和CDK6结合,通过Cyclin D-CDK4/CKD6通路调控细胞越过G1期细胞检测点[19]。综上,我们选取检测Chk、pChk蛋白变化明确ATM/ATR抑制后其下游因子的变化,尤其pChk蛋白的减少提示细胞损伤修复的减少,而Cyclin B及Cyclin D作为细胞周期蛋白,可调控细胞周期阻滞,其表达升高可导致细胞阻滞于G2/M、S期,利于DNA损伤修复;而其表达降低可解除细胞阻滞于G2/M、S期,促进细胞凋亡。Caspase-3作为凋亡蛋白,其水平变化可反映细胞凋亡情况。本研究显示,KU55933组和替莫唑胺组pChk1、pChk2、Cleave-Caspase-3相对表达量较空白组升高,Cyclin B、Cyclin D1相对表达量较空白组降低;KU55933组pChk1、pChk2、Cyclin B、Cyclin D1相对表达量较替莫唑胺组降低,Cleave-Caspase-3相对表达量较替莫唑胺组升高。提示KU55933可解除化疗损伤带来的细胞周期阻滞,使细胞损伤修复减少,进而细胞凋亡增多,提高了化疗敏感性。
总之,ATM/ATR阻滞剂可通过下调磷酸化Chk,进一步下调Cyclin B及Cyclin D1表达,从而逆转细胞周期阻滞,阻止DNA通过该通路进行损伤修复,促进细胞凋亡,从而提高GMB细胞对化疗的敏感性。
参考文献:
[1] Carruthers R, Ahmed SU, Strathdee K, et al. Abrogation of radioresistance in glioblastoma stem-like cells by inhibition of ATM kinase[J]. Mol Oncol, 2015(9):192-203.
[2] Li LJ, Zhong LF, Jiang LP, et al. beta-Elemene radiosensitizes lung cancer A549 cells by enhancing DNA damage and inhibiting DNA repair[J]. Phytother Res, 2011,25(7):1095-1097.
[3] Masuda Y, Kamiya K. Molecular nature of radiation injury and DNA repair disorders associated with radiosensitivity[J]. Int J Hematol, 2012,95(3):239-245.
[4] Taylor AM, Harnden DG, Arlett CF, et al. Ataxia telangiectasia: a human mutation with abnormal radiation sensitivity[J]. Nature, 1975,258(5534):427-429.
[5] Shiloh Y, Ziv Y. The ATM protein kinase: regulating the cellular response to genotoxic stress, and more[J]. Nat Rev Mol Cell Biol, 2013,14(4):197-210.
[6] Hickson I, Zhao Y, Richardson CJ, et al. Identification and characterization of a novel and specific inhibitor of the ataxia-telangiectasia mutated kinase ATM[J]. Cancer Res, 2004,64(24):9152-9159.
[7] Alao JP, Sunnerhagen P. The ATM and ATR inhibitors CGK733 and caffeine suppress cyclin D1 levels and inhibit cell proliferation[J]. Radiat Oncol, 2009(4):51.
[8] Gratas CS, Sery Q, Rabe M, et al. Bak and Mcl-1 are essential for temozolomide induced cell death in human glioma[J]. Oncotarget, 2014,5(9):2428-2435.
[9] Jallepalli PV, Lengauer C, Vogelstein B, et al. The Chk2 tumor suppressor is not required for p53 responses in human cancer cells[J]. J Biol Chem, 2003,278(23):20475-20479.
[10] Hsieh CH, Lin YJ, Wu CP, et al. Livin contributes to tumor hypoxia-induced resistance to cytotoxic therapies in glioblastoma multiforme[J]. Clin Cancer Res, 2015,21(2):460-470.
[11] Munoz JL, Rodriguez CV, Ramkissoon SH, et al. Temozolomide resistance in glioblastoma occurs by miRNA-9-targeted PTCH1, Independent of sonic hedgehog level[J]. Oncotarget, 2015,6(2):1190-11201.
[12] Garros-Regulez L, Aldaz LP, Arrizabalaga O, et al. mTOR inhibition decreases SOX2- SOX9 mediated glioma stem cell activity and temozolomide resistance[J]. Expert Opin Ther Targets, 2016,20(4):393-405.
[13] 谢思迪,陈子阳,王海,等.siRNA干扰微管微丝交连因子1表达增强替莫唑胺诱导的胶质瘤细胞[J].南方医科大学学报,2017,37(9):1183-1189.
[14] Shibata A, Barton O, NoonA T, et al. Role of ATM and the damage response mediator proteins 53BP1 and MDC1 in the maintenance of G2/M checkpoint arrest[J]. Mol Cell Biol, 2010,30(13):3371-3383.
[15] Crescenzi E, Palumbo G, de Boer J, et al. Ataxia telangiectasia mutated and p21CIP1 modulate cell survival of drug-induced senescent tumor cells: implications for chemotherapy[J]. Clin Cancer Res, 2008,14(6):1877-1887.
[16] Cowell IG, Durkacz BW, Tilby MJ. Sensitization of breast carcinoma cells to ionizing radiation by small molecule inhibitors of DNA-dependent protein kinase and ataxia telangiectsia mutated[J]. Biochem Pharmacol, 2005,71(1-2):13-20.
[17] Stracker TH, Usui T, Petrini JHJ. Taking the time to make important decisions: the checkpoint effector kinases Chk1 and Chk2 and the DNA damage response[J]. DNA Repair(Amst), 2009(8):1047-1054.
[18] Polyak K, Xia Y, Zweier JL, et al. A model for p53-induced apoptosis[J]. Nature, 1997,389(6648):300-305.
[19] Takuwa N, Takuwa Y. Regulation of cell cycle molecules by the ras effector system[J]. Mol Cell Endocrinol, 2001,177(1-2):25-33.

