沉默ADAM17基因对人甲状腺乳头状癌细胞增殖、迁移及侵袭的影响
葛志鹏,张博,王晓涛,黄志强,张琪,田炜,张国志
(1华北理工大学附属医院,河北唐山063000;2华北理工大学医学实验中心)
甲状腺癌最常见的病理类型是乳头状癌。目前乳头状癌的治疗以手术切除为主,但基因靶向治疗也逐渐显露出其优势性和必要性。解聚素-金属蛋白酶17(ADAM17)具有促进细胞膜释放肿瘤坏死因子α的作用[1,2]。研究发现,ADAM17高表达与胰腺癌、乳腺癌、肝癌、宫颈癌等密切相关,能够促进癌细胞增殖、迁移、侵袭等生物学行为[3~7]。因此,ADAM17可能是甲状腺乳头状癌基因靶向治疗的新位点,靶向沉默ADAM17基因可能抑制肿瘤细胞的增殖、迁移及侵袭。李晨浩等[8]发现,在甲状腺乳头状癌中ADAM17 mRNA及蛋白均呈高表达,但ADAM17基因与K1细胞增殖、迁移及侵袭的关系尚不明确。2016年11月~2017年9月,我们通过靶向抑制甲状腺乳头状癌细胞ADAM17的表达,观察细胞增殖、迁移和侵袭能力的改变,旨在为以ADAM17为靶点的乳头状癌基因治疗提供实验支持。
1 材料与方法
1.1 材料
人甲状腺乳头状癌K1细胞(华北理工大学医学中心实验室)。携带红色荧光蛋白表达框架的ADAM17-shRNA、无意义序列-shRNA慢病毒(苏州吉玛基因公司),RPMI-1640培养基、胎牛血清(Gibco公司),逆转录试剂盒、聚合酶链反应试剂盒、ADAM17引物(上海Invitrogen公司),兔抗人ADAM17抗体(Abcam公司),BCA蛋白浓度检测试剂盒(Sigma-Aldrich公司),DAB显影液(君瑞生物技术公司),MTT细胞增殖试剂盒(上海艾睿生物科技有限公司),12孔Transwell小室(美国Corning公司),Matrigel基质胶(BD公司)。倒置荧光显微镜(Olympus公司),Rotor-Gene 3000荧光定量PCR仪器(Gene Company Iimited公司),微孔板检测器、湿转系统(上海BIO-RAD公司)。
1.2 细胞培养、分组和转染
向K1细胞中加入含10%胎牛血清、1%青链霉素的RPMI-1640完全培养基,置于5% CO2、37 ℃恒温箱中培养。将生长状态良好且融合度达60%的K1细胞重悬,接种到6孔板中,随机分为空白对照组、无意义序列组、转染组,各组设6个复孔。待细胞贴壁后,转染组、无意义序列组分别用整合有ADAM17-shRNA、无意义序列-shRNA的慢病毒转染细胞,空白对照组加入等量PBS液。培养48 h后更换培养基,72 h后在荧光显微镜(400倍镜)下计算慢病毒携带的红色荧光蛋白框架的表达率。当MOI值取80时,红色荧光蛋白表达率达到80%,说明慢病毒成功侵入K1细胞,并获得稳定表达。
1.3 细胞中ADAM17 mRNA检测
采用RT-PCR方法。细胞转染72 h后,采用TRIpure法提取各组细胞总RNA,测定纯度及浓度后,置于-80 ℃保存。按照逆转录盒步骤合成cDNA,进行PCR扩增(内参为β-actin)。引物序列:ADAM17上游5′-ATCAAACCCTTTCCTGCG-3′,下游5′-CAAACCCATCCTCGTCCA-3′;β-actin上游5′-CTGGAACGGTGAAGGTGACA-3′,下游5′-AAGGGACTTCCTGTAACAATGCA-3′。反应条件:95 ℃预变性2 min;95 ℃ 8 s,58 ℃ 35 s,72 ℃ 40 s,40个循环。应用2-ΔΔCT法计算各组ADAM17 mRNA的相对表达量。实验重复3次,取平均值。
1.4 细胞中ADAM17蛋白检测
采用Western blotting法。细胞转染72 h后,提取细胞总蛋白,BCA定量法检测总蛋白浓度。加入等量2×蛋白上样缓冲液后煮沸变性5 min,配制10%分离胶,蛋白上样量为40 μg。随后电泳(110 V、100 min)、转膜(80 V、50 min),10%脱脂奶粉封闭1 h。加ADAM17、β-actin一抗(稀释浓度均为1∶1 000),置于摇床上,4 ℃孵育过夜;洗膜后滴加二抗(1∶1 000),37 ℃孵育30 min,洗膜后用ECL法显色。应用Image J软件分析条带,计算ADAM17蛋白相对表达量。实验重复3次,取平均值。
1.5 细胞增殖能力观察
采用MTT法。细胞转染72 h后,用完全培养基重悬各组细胞,制成密度为30个/μL的单细胞悬液。取100 μL,将细胞接种于3个(标记为A、B、C)96孔板中,各组设8个复孔。A孔板中的细胞培养24 h后,每孔滴加10 μL MTT溶液(浓度为5 mg/mL),细胞继续培养4 h;弃除培养基,每孔滴加100 μL二甲基亚砜,37 ℃静置15 min后,用酶标仪(570 nm波长)测定各孔OD值。B孔板细胞培养48 h、C孔板中细胞培养72 h后重复上述步骤。重复实验3次。
1.6 细胞周期分布观察
采用流式细胞仪。细胞转染72 h后,用PBS缓冲液重悬细胞,置于预冷的70%乙醇中固定24 h,用含RNA酶的碘化丙啶(PI)染色,37 ℃避光孵育30 min,上流式细胞仪测定各组细胞的周期时相百分比。
1.7 细胞迁移能力观察
采用Transwell迁移实验。转染72 h后,用胰酶将细胞消化,加入无FBS的培养基重悬,制成细胞密度为3×103/μL的细胞悬液。取100 μL接种于Transwell上层小室,下层小室滴加700 μL含20% FBS的培养基,继续于细胞恒温箱中培养24 h。弃除小室内培养基,小心擦去聚碳酸酯膜正面的K1细胞,PBS冲洗2次。4%多聚甲醛溶液固定1 h后,进行HE染色。各组聚碳酸酯膜于倒置显微镜(×100)下随机取8个视野拍照,得各组穿膜细胞的平均数。实验重复3次,取平均值。
1.8 细胞侵袭能力观察
采用Transwell侵袭实验。Matrigel基质胶用4 ℃预冷的无血清培养基稀释10倍,取10 μL滴加在Transwell上层小室,37 ℃水平静置30 min后, Matrigel基质胶即可凝固,重复1.7步骤。
1.9 统计学方法
2 结果
2.1 三组ADAM17 mRNA和蛋白表达水平比较
转染组ADAM17 mRNA和蛋白表达水平较空白对照组和无意义序列组降低(P均<0.01),空白对照组和无意义序列组ADAM17 mRNA和蛋白表达水平比较差异均无统计学意义(P均>0.05)。见表1。

表1 三组ADAM17 mRNA及蛋白表达水平比较
注:与转染组比较,*P<0.01。
2.2 三组细胞增殖能力比较
转染组各时间点OD值均较空白对照组和无意义序列组降低(P均<0.05),空白对照组与无意义序列组比较差异无统计学意义(P>0.05)。见表2。

表2 三组细胞不同时间点的OD值比较
注:与转染组比较,*P<0.01。
2.3 三组细胞周期分布比较
转染组处于G0/G1期的细胞百分比高于空白对照组和无意义序列组(P均<0.01),出现明显的G0/G1期阻滞;转染组进入S期和G2/M期的细胞百分比均低于空白对照组和无意义序列组(P均<0.01);空白对照组与无意义序列组各细胞周期百分比比较无统计学差异(P均>0.05)。见表3。
2.4 三组细胞迁移能力比较
转染72 h后,空白对照组、无意义序列组、转染组穿膜细胞数分别为(422.8±24.1)、(432.6±25.5)、(149.2±20.7)个/HP。转染组穿膜细胞数少于空白对照组和无意义序列组(P均<0.01),空白对照组和无意义序列组比较差异无统计学意义(P>0.05)。
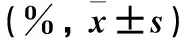
表3 三组细胞周期分布百分比比较
注:与转染组比较,*P<0.01。
2.5 三组细胞侵袭能力比较
转染72 h后,空白对照组、无意义序列组、转染组穿膜细胞数分别为(216.4±13.0)、(211.8±18.3)、(83.8±11.9)个/HP。转染组穿膜细胞数少于空白对照组和无意义序列组(P均<0.01),空白对照组和无意义序列组比较差异无统计学意义(P>0.05)。
3 讨论
ADAM家族自1990年发现至今已有20余个成员,它们与许多细胞的生物学功能密切相关,并具有细胞外功能区剪切酶的作用[4]。ADAM17是ADAM家族成员之一,其主要作用是促进细胞膜释放肿瘤坏死因子α,从而参与癌症的发生、发展。研究表明,ADAM17的高表达与甲状腺乳头状癌、胰腺癌、乳腺癌、肝癌、宫颈癌等的发生及进展密切相关。
RNA干扰(RNAi)是利用小干扰RNA(siRNA)激活,具有对靶基因产生特异性抑制作用的一种实验技术[9],siRNA以“短发夹”(shRNA)形式整合到慢病毒载体中,利用病毒的感染特性将shRNA整合到细胞染色体中,从而发挥对目的基因的沉默作用。本实验用整合有ADAM17-shRNA的慢病毒载体转染K1细胞,依据观察到细胞内红色荧光蛋白的表达率达80%,再测得转染组ADAM17 mRNA及蛋白的相对表达量均明显降低,证实ADAM17-shRNA成功导入K1细胞,并对ADAM17基因产生了靶向沉默作用。
无限增殖是癌细胞的一个重要生物学行为。有学者[10]认为,肿瘤是一种细胞周期性疾病,不受调控的细胞周期与无限的恶性增殖密切相关。孟祥潮等[11]发现,沉默乳腺癌MCF-7细胞中的ADAM17基因后,MCF-7细胞增殖能力显著下降。路延芹等[12]发现,沉默乳腺癌MCF-7细胞中的ADAM17基因后,MCF-7细胞周期进展被明显抑制。林锋等[13]通过靶向抑制前列腺癌PC-3细胞的ADAM17基因表达,发现细胞中cyclin D1表达下降、p21表达增强,认为抑制ADAM17基因表达能够阻滞细胞周期,降低PC-3细胞的增殖能力。本研究结果显示,转染组培养24、48、72 h时的OD值均较空白对照组和无意义序列组降低,细胞周期中转染组出现了明显的G0/G1期阻滞,处于S期、G2/M期的细胞减少。说明靶向沉默ADAM17基因能够阻滞K1细胞进入S期和G2/M期,降低K1细胞的增殖能力,而且细胞周期阻滞现象与增殖能力的下降有关。李舜等[14]报道,沉默人胶质瘤细胞中的ADAM17基因后,细胞的增殖能力降低。本研究结果与文献报道相符。
迁移和侵袭也是癌细胞重要的生物学行为。吴衡等[6]证实,沉默ADAM17基因能够降低胰腺癌PANC1细胞的迁移能力。李舜等[14]通过siRNA靶向抑制ADAM17的表达及ADAM17激活剂使ADAM17过表达,双向证明了ADAM17可通过PI3K/AKT途径促进人胶质瘤U87MG细胞的侵袭。本研究结果显示,转染组Transwell迁移、侵袭实验中的穿膜细胞数均少于空白对照组和无意义序列组,说明诱导表达ADAM17-shRNA可抑制K1细胞的迁移和侵袭能力。与杨雯靖等[15]在乳腺癌、Zheng等[16]在人胶质瘤中的研究结果相似。
综上所述,利用整合有ADAM17-shRNA的慢病毒转染K1细胞后,可成功沉默ADAM17基因,从而显著抑制K1细胞的增殖、迁移、侵袭。本研究为以ADAM17为靶点的基因靶向治疗提供了基础实验支持,进而可能为临床中甲状腺乳头状癌不能完全切除或术后复发不宜再次手术的患者,提供新的靶向治疗药物。
参考文献:
[1] Rose-John S. ADAM17, shedding, TACE as therapeutic targets[J]. Pharmacol Res, 2013,71:19-22.
[2] Zhang P, Shen M, Fernandez-Patron C, et al. ADAMs family and relatives in cardiovascular physiology and pathology[J]. J Mol Cell Cardiol, 2016,93(4):186-199.
[3] 丁翔,杨连粤,黄耿文,等.ADAM17 mRNA在孤立性大肝癌中的表达及其意义[J].中华肝胆外科杂志,2005,11(8):46-48.
[4] 刘爽,马荣.ADAM17在恶性肿瘤中的研究及其进展[J].现代生物医学进展,2013,13(17):3386-3389.
[5] 韩旭,杨星飞,张雪鹏,等.ADAM17在乳腺癌组织中的表达及意义[J].现代中西医结合杂志,2010,19(20):2486-2488.
[6] 吴衡.ADAM17在胰腺癌细胞中的表达及其对细胞增殖迁移的影响[J].江苏大学学报(医学版),2015,25(4):299-303.
[7] 刘爽,马荣,贺云龙,等.宫颈鳞状细胞癌中ADAM17的表达及其临床意义[J].现代生物医学进展,2016,16(15):2868-2871.
[8] 李晨浩,魏艳杰,田炜,等.ADAM17在甲状腺乳头状癌中表达及意义[J].基础医学与临床,2016,36(3):393-395.
[9] 孙平,赵微,赵毅玲.RNA干扰技术的原理与应用[J].医学综述,2011,17(2):164-167.
[10] Kwegyir-Afful AK, Murigi FN, Purushottamachar P, et al. Galeterone and its analogs inhibit Mnk-eIF4E axis, synergize with gemcitabine, impede pancreatic cancer cell migration, invasion and proliferation and inhibit tumor growth in mice[J]. Oncotarget, 2017,8(32):52381-52402.
[11] 孟祥潮,蔡准,陈国福,等.ADAM17-shRNA对人乳腺癌MCF-7细胞增殖的影响及机制[J].山东医药,2017,57(4):21-24.
[12] 路延芹,赵光明,张雪鹏.ADAM17-siRNA对MCF-7人乳腺癌细胞增殖的影响[J].现代中西医结合杂志,2011,20(24):3003-3005.
[13] 林锋,林平,刘鑫,等.靶向ADAM17基因siRNA对前列腺癌PC-3细胞增殖能力的影响[J].中华男科学杂志,2012,18(8):687-691.
[14] 李舜,唐晓平,冯凌,等.ADAM17对U87MG胶质瘤细胞增殖与侵袭的影响及作用机制[J].实用癌症杂志,2017,32(6):883-887.
[15] 杨雯靖,张雪鹏,焦桂梅,等.ADAM17-siRNA抑制人MCF-7乳腺癌细胞体外侵袭能力的研究[J].天津医药,2011,39(11):1045-1047.
[16] Zheng X, Jiang F, Katakowski M, et al. ADAM17 promotes glioma cell malignant phenotype[J]. Mol Carcinog, 2012,51(2):150-164.

