液晶传感竞争免疫法检测天蚕素B
苏秀霞, 张 姣, 栾崇林, 霍文静,徐 佳
(1.陕西科技大学 化学与化工学院 教育部轻化工助剂化学与技术重点实验室, 陕西 西安 710021; 2.深圳职业技术学院 应用化学与生物技术学院, 广东 深圳 518088)
0 引言
液晶(LCs)兼具液体的流动性和固体的光学各向异性[1],表面微小的地貌和化学结构变化即会引起处于向列相的液晶分子的取向变化[2],进而引起液晶膜颜色和亮度的变化.1998年,Abbot小组[3]首次以液晶作为“敏感元件”,基于构建金膜法将基底表面发生的蛋白质结合事件转换为光学图像信号检测抗生物素蛋白(Av),这种液晶生物传感技术具有低耗、快速、无需标记,所呈现的光学信号肉眼可观等优点,在非标记生物传感检测方面具有潜在应用价值,已经实现了对酪氨酸[4]、胆固醇[5]、多肽[6]、蛋白质[7]、核酸[8]、Hg2+[9]等的检测.
天蚕素B(CB)是人类1980年从惜古比天蚕体内发现的第一个抗菌肽[10],对革兰氏阳性菌[11]、革兰氏阴性菌[12]、真菌[13]、癌细胞[14]、病毒[15]均有抑杀作用,其在动植物抗病基因工程[16,17]、植物育种[18]、生物饲料添加剂[19]等领域有着巨大的潜在应用价值.现有多肽的检测方法主要有液相色谱-质谱法[20]、毛细管电泳法[21]和免疫分析法[22]等.然而,以上方法样品预处理繁琐,有的还需要衍生化,对抗原抗体进行标记,耗时长、成本高,且对操作人员要求高,应用受限,因此,高灵敏性、特异性、非标记、低成本的多肽检测方法的研究迫在眉睫.
本文结合液晶生物传感器无需标记等优点,利用竞争免疫法,通过在玻璃基底表面修饰自组装膜诱导液晶分子垂直均一取向,观察天蚕素B抗体(anti-CB)与天蚕素B结合前后液晶膜颜色和亮度的变化,并通过计算偏光显微镜成像灰度强度定量化分析天蚕素B浓度,构建了一种非标记、高灵敏、特异性的天蚕素B液晶生物传感器.
1 实验部分
1.1 试剂与仪器
(1)主要试剂:二甲基十八烷基[3-(三甲氧基硅基)丙基]氯化铵(DMOAP)、3-氨丙基三乙氧基硅烷(APTES)、天蚕素B均购自美国Sigma-Aldrich公司;天蚕素B抗体购自英国Abcam公司;4-氰基-4-戊基联苯(5CB)购自美国Instec公司;戊二醛(GA)购自国药集团化学试剂有限公司;其余试剂均为分析纯.
(2)主要仪器:XPL3230型透反两用数码偏光显微镜(上海光学仪器一厂);SPI3800N/SPA400型原子力显微镜(日本精工有限公司);OCA20视频光学接触角(德国dataphysics公司);玻片(江苏飞舟玻塑有限公司);Mylar聚酯片(广州市斯朗特电子科技有限公司).
1.2 玻片预处理
将玻片切割成2 cm×2 cm,用热的Piranha溶液[V(H2O2)∶V(H2SO4)]=3∶7于80 ℃浸泡1 h,依次用超纯水和乙醇清洗干净,经N2吹干,于110 ℃干燥3 h,防尘备用.
1.3 上下玻片的自组装
上玻片的DMOAP自组装:将清洗干净的玻片浸入0.2%(v/v)的DMOAP水溶液中,常温下静置半小时,超纯水冲洗干净,N2吹干,于110 ℃干燥1 h,防尘备用.
下玻片的APTES/DMOAP混合自组装:将清洗干净的玻片浸入3%(v/v)APTES和1%(v/v)DMOAP的10 mmol/L的醋酸-醋酸钠溶液中(pH=5),于80 ℃恒温2 h,超纯水冲洗干净,N2吹干,于110 ℃干燥1 h,然后浸入1%(v/v)的GA溶液中37 ℃反应1 h,取出后用大量超纯水冲洗,N2吹干,防尘备用.
1.4 天蚕素B的固定
将天蚕素B溶解于0.01 mol/L的PBS缓冲液中(pH=7.4),配置成不同浓度的天蚕素B溶液.取适量的天蚕素B溶液滴加至下玻片表面,于37 ℃反应2 h,取出后分别用0.01 mol/L的PBS缓冲液(pH=7.4)和超纯水冲洗,除去未固定的天蚕素B分子,N2吹干,置于-20 ℃下冷冻保存.
1.5 液晶池的制作
将处理后的上下玻片面对面组装,玻片之间用Mylar聚酯片(中间开凸型空腔)隔开,除开孔方向外,其他三边用小夹子固定.将液晶5CB于40 ℃恒温箱中加热约10 min,使其从浑浊液晶态变为澄清透亮的液态,取少许液晶从开孔处利用毛细管作用力注入液晶池内,待液晶布满整个空腔,停止加热,使液晶池缓慢冷却至室温(25 ℃)后利用偏光显微镜观察.
1.6 检测方法
根据竞争免疫法,将一定浓度的天蚕素B抗体溶液与不同浓度的待测天蚕素B抗原溶液于37 ℃恒温混匀10 min,取适量混合后溶液依次滴加至固定有天蚕素B抗原的玻片上,37 ℃反应1 h,抗原抗体即可实现竞争免疫反应,分别用0.01 mol/L的PBS缓冲液(pH=7.4)和超纯水冲洗,除去非特异性吸附物质,N2吹干.按照1.5节方法制备成液晶池,使用偏光显微镜观察液晶膜颜色和亮度变化并采集图像分析,通过Adobe Photoshop CS5 软件计算偏光显微镜成像灰度强度.
2 结果与讨论
2.1 液晶生物传感器的检测原理
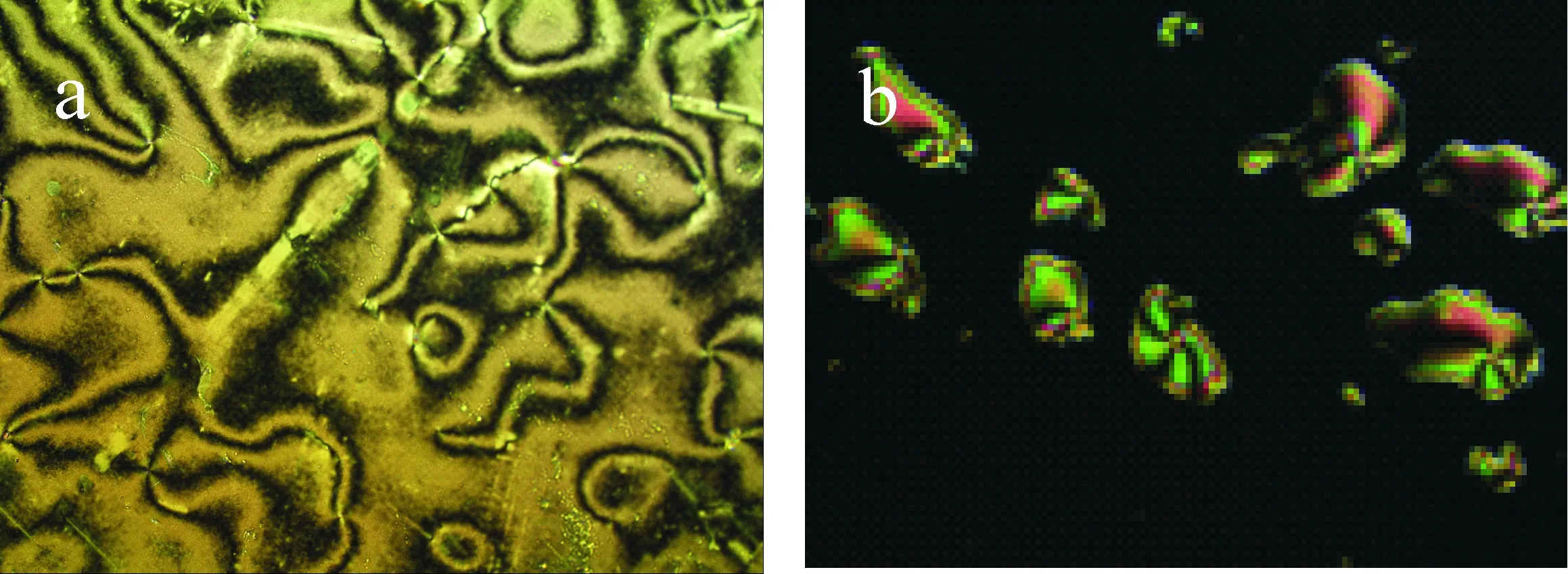
本文的检测原理如图1所示,在下玻片表面修饰APTES/DMOAP混合自组装膜(如图1(b)所示),DMOAP用于诱导液晶分子垂直均一取向,APTES中的氨基与GA中的一个醛基反应后作为功能分子固定天蚕素B(如图1(c)所示).当依次滴加一定浓度的天蚕素B抗体溶液与不同浓度的待测天蚕素B抗原溶液后,此时玻片上已固定的天蚕素B与待测天蚕素B竞争结合抗体上有限的反应位点(如图1(d)所示),基底固定的天蚕素B与天蚕素B抗体特异性结合后,由于抗体分子具有一定的空间立体结构以及分子尺寸效应,能够扰乱液晶5CB分子的取向,使其呈倾斜或近平行排列,随着样品中待测天蚕素B浓度的变化,结合到基底的天蚕素B抗体量也随之变化,进而使液晶膜的颜色和亮度发生变化(如图1(e)所示)实现对天蚕素B的特异性检测.当不含天蚕素B抗体时,由于液晶5CB分子呈垂直均一的取向因而不具有双折射,不能使偏振光透过,光学成像为均一黑色图案(如图1(f)所示).
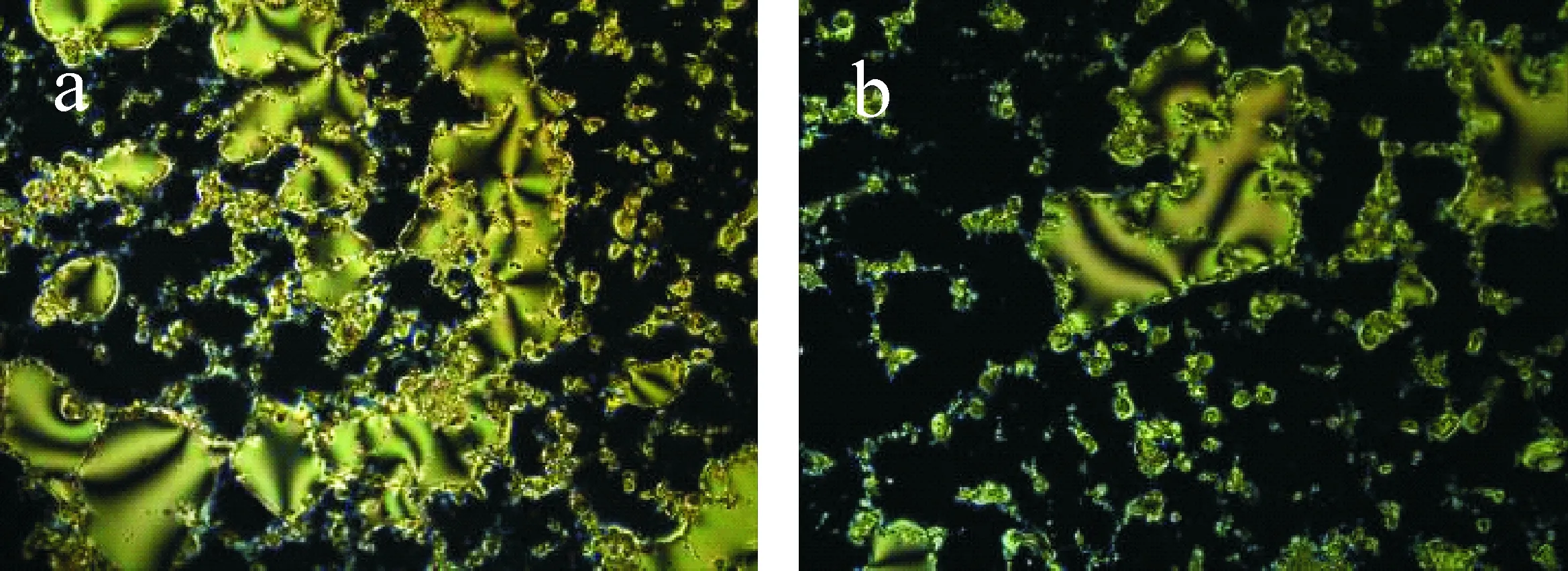
2.2基底表面APTES/DMOAP/GA自组装膜比例优化
已有研究表明,基底自组装膜的化学结构与液晶膜的有效双折射(Δneff)直接相关,进而影响其光学成像[23],因此液晶生物传感器的基底修饰对生物分子的检测至关重要.本文采取APTES与DMOAP混合自组装法构建基底敏感膜,DMOAP中的长链烷基链能够诱导液晶分子沿长链方向取向,呈垂直排列,此时偏振光不能透过液晶池,光学图像为均一的黑色图案.APTES中的氨基与GA中的一个醛基反应后作为功能分子固定生物分子,由于APTES为短链烷基,不能有效的诱导液晶分子垂直排列,偏光显微镜成像会产生背景干扰,因此,需要探究APTES与DMOAP比例对液晶取向的影响,确定最优比例,在此基础上,进一步确定GA最优含量.
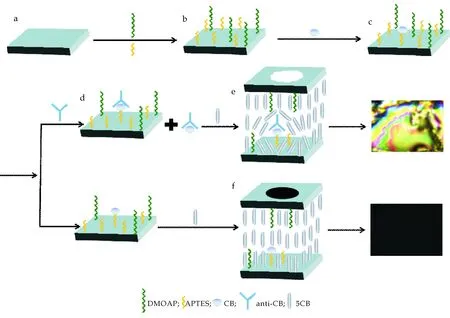
(a)裸玻片 (b)DMOAP/APTES/GA基底自组装膜 (c)天蚕素B的固定 (d)天蚕素B抗体与天蚕素B特异性结合 (e)天蚕素B抗体与天蚕素B特异性结合后液晶5CB分子为倾斜排列 (f)未加入天蚕素B抗体时液晶5CB分子为垂直排列图1 液晶生物传感器检测天蚕素B示意图及液晶池的组装过程
从图2可以看出,当APTES与DMOAP比例较高时(25∶1,如图2(a)所示),由于DMOAP含量较少,不能有效诱导液晶分子垂直排列,光学成像中亮斑大且多,随着APTES与DMOAP比例减小,光学成像中亮斑逐渐减少,当两者比例为5∶1和3∶1时,光学成像均为均一黑色图案,不会干扰生物分子的检测,因此,选取APTES与DMOAP比例为5∶1和3∶1,进一步探讨GA含量对液晶取向的影响.
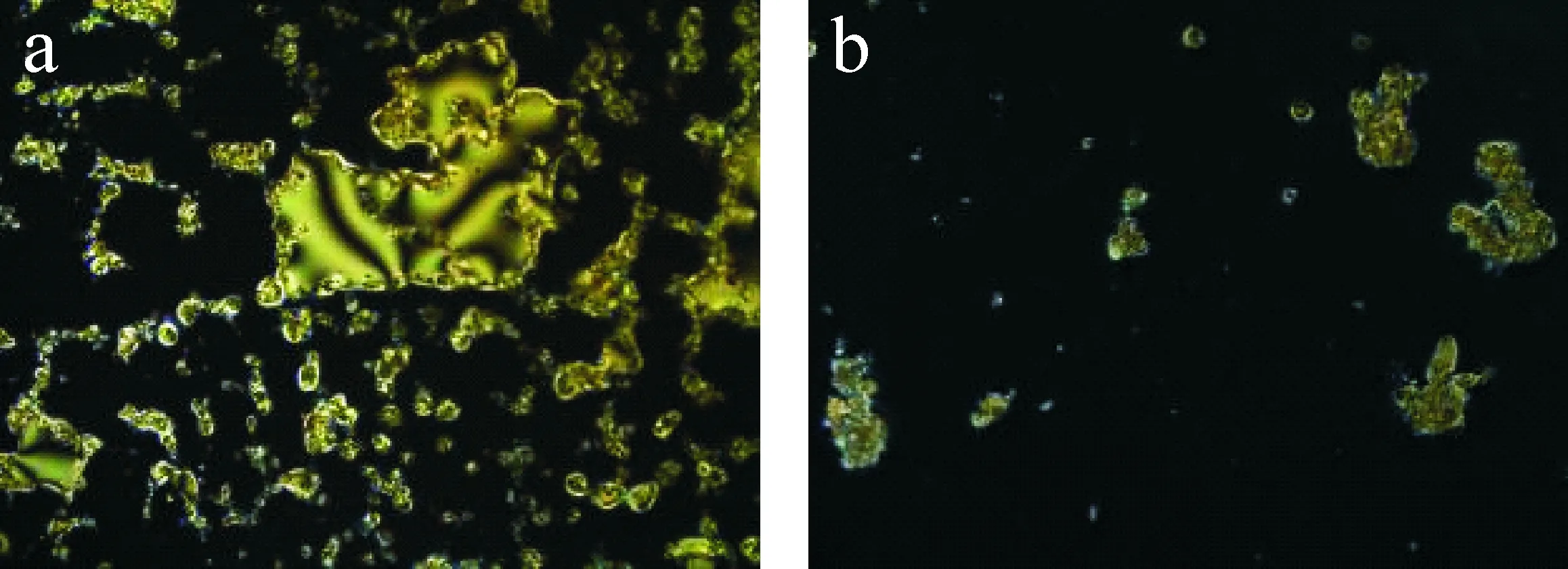
(a)25∶1 (b)10∶1

(c)5∶1 (d)3∶1图2 不同体积比的APTES/DMOAP基底自组装膜制备的液晶池光学成像
GA含量决定基底表面醛基密度,当GA含量为2.5%(v/v)时,APTES与DMOAP比例为5∶1(如图3(a)所示)和3∶1(如图3(b)所示)光学成像中出现均匀分布的较大彩色亮斑.当GA含量减少到1%(v/v)时,图像中亮斑减少,APTES与DMOAP为5∶1时(如图3(c)所示),亮斑呈星点分布,而当两者比例为3∶1时(如图3(d)所示),图案呈现全黑背景,不干扰生物分子检测,因此实验最佳比例为APTES与DMOAP体积比为3∶1,GA含量为1%(v/v).
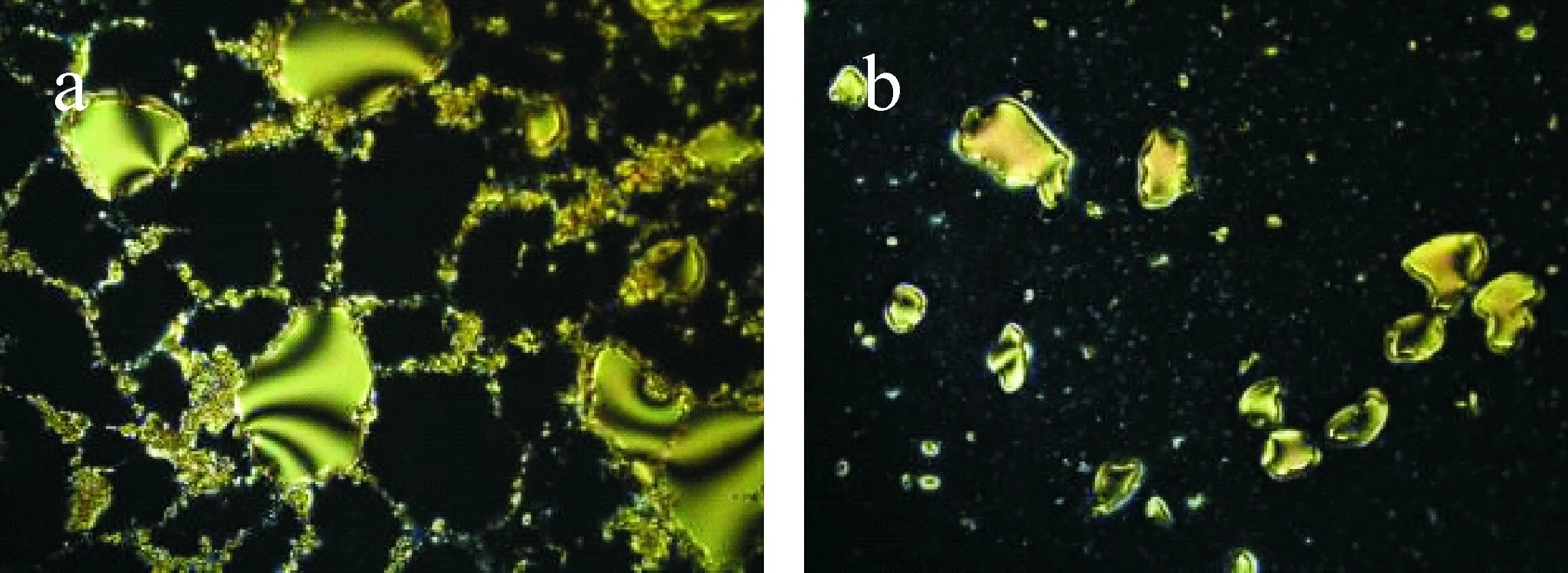

(a)APTES/DMOAP为5∶1,GA含量为2.5%(v/v) (b)APTES/DMOAP为3∶1,GA含量为2.5%(v/v) (c)APTES/DMOAP为5∶1,GA含量为1%(v/v) (d)APTES/DMOAP为3∶1,GA含量为1%(v/v)图3 GA含量对液晶池光学成像的影响
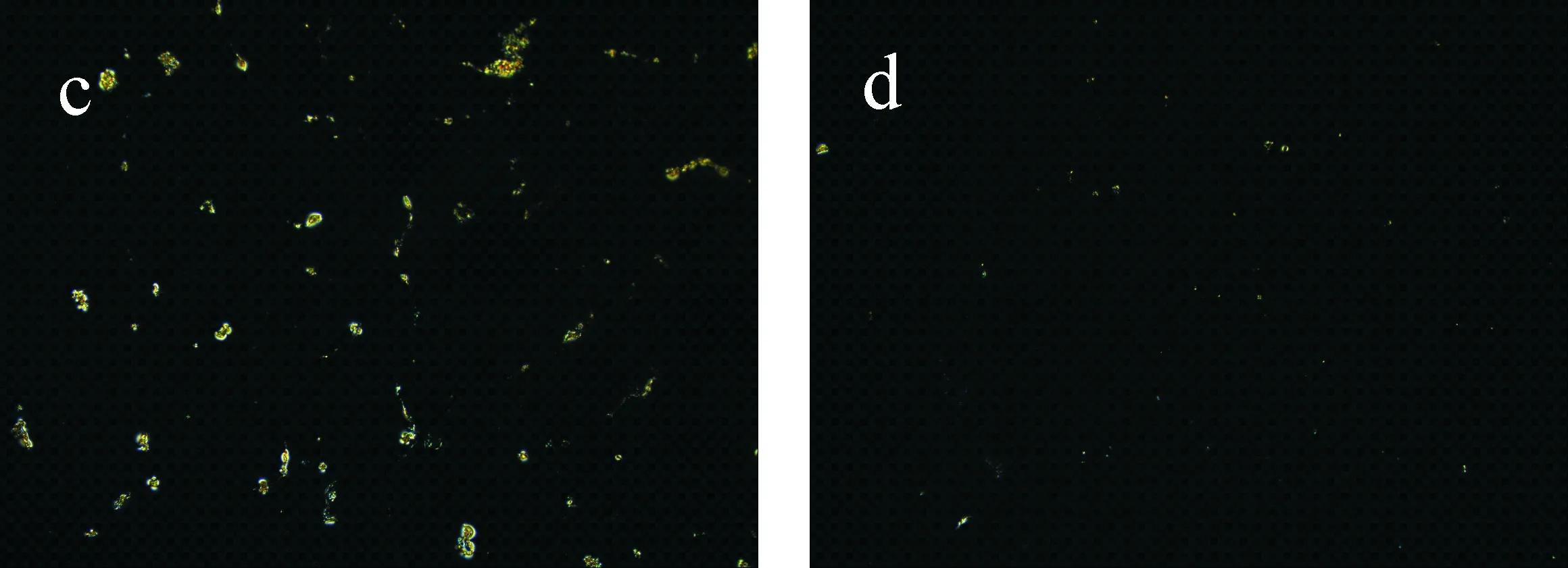
2.3 固定化天蚕素B抗原浓度的优化
液晶分子的取向对基底表面地貌变化非常敏感,天蚕素B与GA交联固定到基底表面后,会在一定程度上改变表面地貌结构从而影响液晶分子的取向,因此需要考察固定化天蚕素B浓度对液晶池光学成像的影响.结果如图4所示,当天蚕素B浓度较高时(500 ng/mL),对液晶分子取向扰乱程度较大,光学成像中有较大的彩色亮斑出现(如图4(a)所示),背景值较高,干扰后续检测.随着固定化天蚕素B抗原浓度的减小,对液晶分子取向扰乱减小,液晶池光学成像逐渐变暗,当固定化抗原浓度为150 ng/mL、100 ng/mL、80 ng/mL时,光学成像中只有少数星点亮斑,趋近于全黑背景(如图4(d)、(e)、(f)所示),由于需要足够的抗原与抗体反应,因此选择能够使光学成像背景保持黑暗的最高固定化天蚕素B浓度150 ng/mL固定于基底表面.
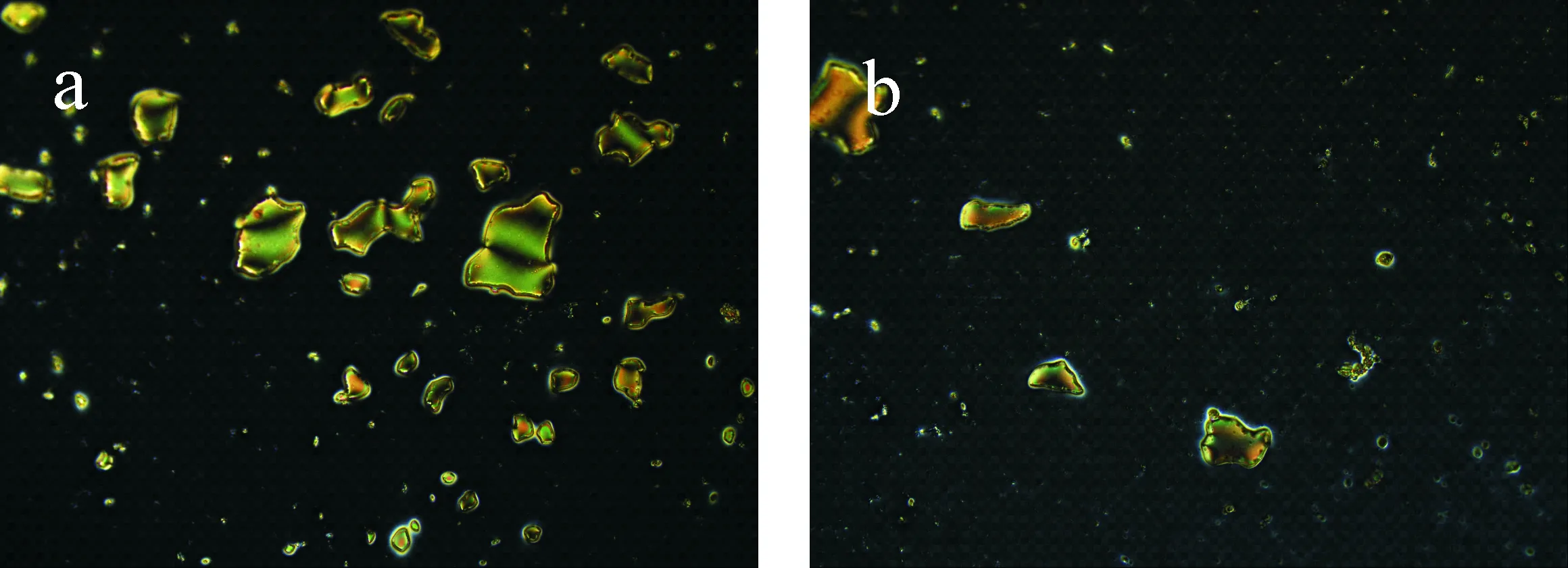
(a)500 ng/mL (b)250 ng/mL
(c)200 ng/mL (d)150 ng/mL

(e)100 ng/mL (f)80 ng/mL图4 不同浓度的固定化天蚕素B制备的液晶池光学成像
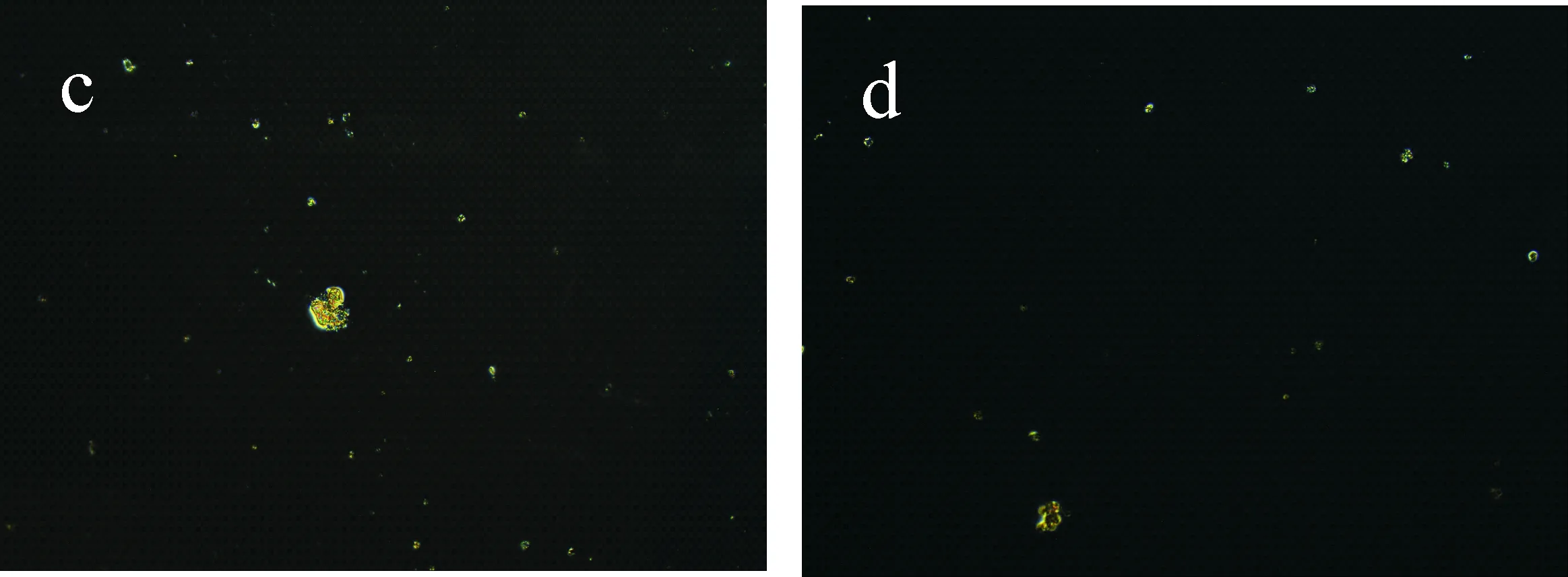
2.4 天蚕素B抗体浓度的优化
进一步考察天蚕素B抗体浓度对液晶池光学成像的影响.如图5所示,在样品中不含待测天蚕素B抗原的条件下,天蚕素B抗体浓度为1 000、500 ng/mL时(如图5(a)、(b)所示),偏光显微镜成像中有彩色亮斑出现,当天蚕素B抗体浓度为300、150、75 ng/mL时,偏光显微镜成像只有少数亮点趋近于全黑背景(如图5(c)、(d)、(e)所示).在后续检测中,基底已固定天蚕素B会与待测天蚕素B竞争结合天蚕素B抗体上有限的反应位点,当待测天蚕素B浓度趋于0时(检测限无限低),天蚕素B抗体最大限度地与基底已固定天蚕素B结合扰乱液晶分子取向,使液晶池光学成像产生亮斑.随着待测天蚕素B浓度的增加,与基底已固定天蚕素B结合的天蚕素B抗体随之减小,光学成像由亮变暗,从而实现对天蚕素B的检测.由于样品中待测天蚕素B含量较低,基于竞争免疫反应产生的信号变化非常小,较大浓度的天蚕素B抗体会影响检测限,因此选择能够使光学成像出现亮斑的最低天蚕素B抗体浓度500 ng/mL进行后续检测.
(a)1 000 ng/mL (b)500 ng/mL
(c)300 ng/mL (d)150 ng/mL

(e)75 ng/mL图5 不同浓度的天蚕素B抗体制备的液晶池光学成像
2.5 天蚕素B的检测
基于竞争免疫原理,在一定浓度范围内,待测天蚕素B的浓度越低,结合到基底玻片表面的天蚕素B抗体分子越多,图像越亮;反之,待测天蚕素B浓度越高,结合到基底玻片表面的天蚕素B抗体分子越少,图像趋于全黑.如图6所示,当待测天蚕素B含量超过0.1 ng/mL时,光学信号出现明显变化.
(a)0 ng/mL (b)0.01 ng/mL

(c)0.1 ng/mL (d)1 ng/mL
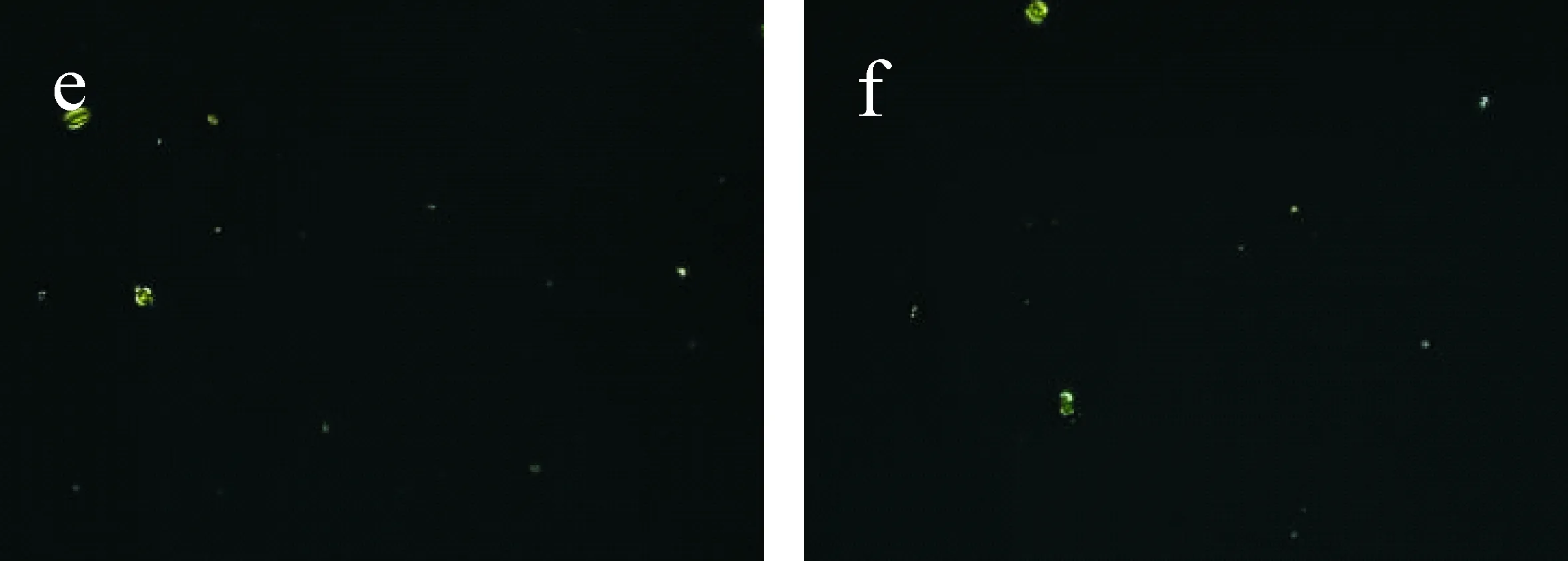
(e)10 ng/mL (f)100 ng/mL图6 不同浓度的待测天蚕素B制备的液晶池光学成像
2.6 天蚕素B浓度定量分析
以上方法能够实现对天蚕素B的定性检测.为了进一步定量化检测天蚕素B浓度,探究了图6中偏光显微镜成像灰度强度值与天蚕素浓度之间的相关性.如图7所示,随着天蚕素B浓度的增加,偏光显微镜成像灰度值逐渐减小,当天蚕素B浓度大于10 ng/mL时,灰度强度值趋于0.天蚕素B浓度在0.01~0.1 ng/mL范围内时,偏光显微镜成像灰度强度值与天蚕素B浓度之间具有线性关系,相关系数为0.985 2.液晶生物传感器传感器能够使天蚕素B的检测限低至0.01 ng/mL.
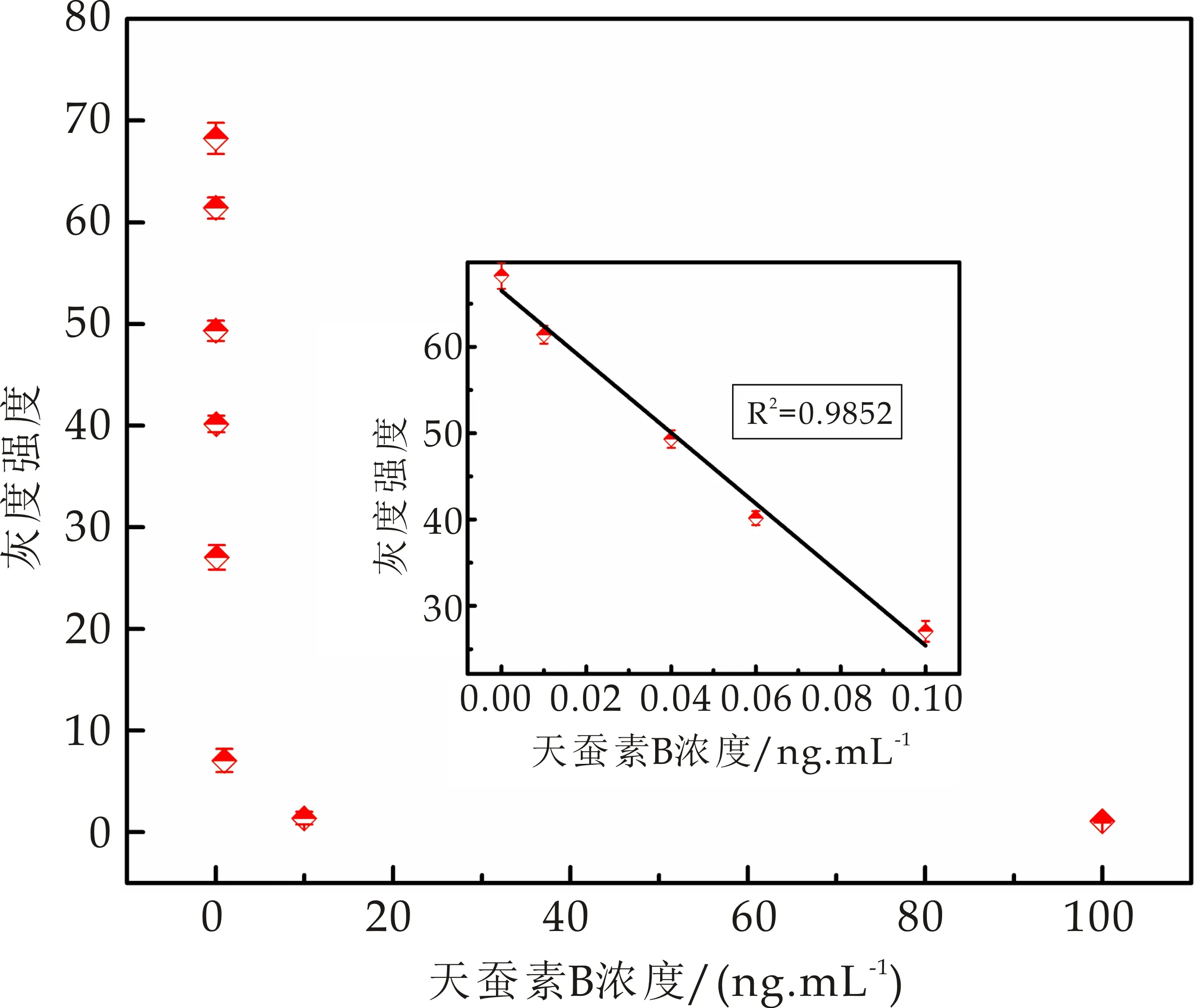
图7 偏光显微镜成像灰度强度与天蚕素B浓度关系(插图:天蚕素B浓度在0.01~0.1 ng/mL范围内与偏光显微镜灰度强度之间为线性关系.误差线为每个浓度进行四次测量后的标准偏差.)
3 结论
(1) 硅烷化试剂自组装膜法构建的基底敏感膜能够很好的诱导液晶分子垂直取向,偏光显微镜观测结果表明:APTES与DMOAP体积比为3∶1,GA含量为1%时(v/v),光学成像为均一黑色图案,不干扰后续检测.
(2) 基于竞争免疫原理,固定化天蚕素B浓度为150 ng/mL时光学成像为黑色图案,天蚕素B抗体浓度为500 ng/mL时,光学成像中有彩色亮斑出现,以此为基础进一步检测待测天蚕素B.
(3) 液晶生物传感器可在0.01~0.1 ng/mL线性范围内实现对天蚕素B的非标记、高灵敏性、特异性检测,检测低至0.01 ng/mL.
[1] Hussain Z,Qazi F,Ahmed M I,et al.Liquid crystals based sensing platform-technological aspects[J].Biosensors & Bioelectronics,2016,85:110-127.
[2] Price A D,Schwartz D K.DNA hybridization-induced reorientation of liquid crystal anchoring at the nematic liquid crystal/aqueous interface[J].Journal of the American Chemical Society,2008,130(26):8 188-8 194.
[3] Gupta V K,Skaife J J,Dubrovsky T B,et al.Optical amplification of ligand-receptor binding using liquid crystals[J].Science,1998,279(5 359):2 077-2 080.
[4] 李广,陈龙聪,陈萌梦,等.基于金纳米颗粒生长的液晶生物传器检测酪氨酸[J].高等学校化学学报,2013,34(11):2 493-2 498.
[5] Munir S,Khan M,Park S Y.Bienzyme liquid-crystal-based cholesterol biosensor[J].Sensors & Actuators B Chemical,2015,220(5):508-515.
[6] Qiongzheng Hu,Changhyun Jang.Using liquid crystals to report molecular interactions between cationic antimicrobial peptides and lipid membranes[J].Analyst,2012,137(3):567-570.
[7] Quan He,Han Lei,Suxin Luo,et al.Liquid crystal biosensor for detecting ischemia modified albumin[J].Research on Chemical Intermediates,2017,43:353-360.
[8] Hui Tan,Xia Li,Shuzhen Liao,et al.Highly-sensitive liquid crystal biosensor based on DNA dendrimers-mediated optical reorientation[J].Biosensors & Bioelectronics,2014,62(20):84-89.
[9] Shengyuan Yang,Chao Wu,Hui Tan,et al.Label-free liquid crystal biosensor based on specific oligonucleotide probes for heavy metal ions[J].Analytical Chemistry,2013,85(1):14-18.
[10] Dan H,Steiner H,Rasmuson T,et al.Insect immunity.purification and properties of three inducible bactericidal proteins from hemolymph of immunized pupae of hyalophora cecropia[J].European Journal of Biochemistry,1980,106(1):7-16.
[11] Hara S,Yamakawa M.A novel antibacterial peptide family isolated from the silkworm,bombyx mori[J].Biochemical Journal,1995,310(2):651-656.
[12] Sato H,Feix J B.Peptide-membrane interactions and mechanisms of membrane destruction by amphipathicα-helical antimicrobial peptides[J].Biochimica Et Biophysica Acta Biomembranes,2006,1 758(9):1 245-1 256.
[13] Maloy W L,Kari U P.Structure-activity studies on magainins and other host defense peptides[J].Biopolymers,1995,37(2):105-122.
[14] Suttmann H,Retz M,Paulsen F,et al.Antimicrobial peptides of the cecropin-family show potent antitumor activity against bladder cancer cells[J].Bmc Urology,2008,8(1):1-7.
[15] Tajui Chia,Yuchi Wu,Jyhyih Chen,et al.Antimicrobial peptides (AMP) with antiviral activity against fish nodavirus[J].Fish & Shellfish Immunology,2010,28(3):434-439.
[16] Ghiselli R,Giacometti A,Cirioni O,et al.Cecropin B enhances betalactams activities in experimental rat models of gram-negative septic shock[J].Annals of Surgery,2004,239(2):251-256.
[17] Peyshynan Jan,Hsuyuang Huang,Hueihmin Chen.Expression of a synthesized gene encoding cationic peptide cecropin B in transgenic tomato plants protects against bacterial diseases[J].Applied & Environmental Microbiology,2010,76(3):769-775.
[18] Yongrui He,Shanchun Chen,Aihong Peng,et al.Production and evaluation of transgenic sweet orange (Citrus sinensis,Osbeck) containing bivalent antibacterial peptide genes (Shiva,A and Cecropin,B) via a novel agrobacterium-mediated transformation of mature axillary buds[J].Scientia Horticulturae,2011,128(2):99-107.
[19] Jiazhi Yu,Chiumin Wen,Cheming J.Yang,et al.Antimicrobial peptides characteristics and their applications as feed additives in domestic animals[J].J.Chin.Soc.Anim.Sic,2013,42(1):1-13.
[20] Thomas A,Kohler M,Schanzer W,et al.Determination of synacthen in urine for sports drug testing by means of nano-ultra-performance liquid chromatography/tandem mass spectrometry[J].Rapid Communications in Mass Spectrometry:RCM,2009,23(17):2 669-2 674.
[21] Varesio E,Rudaz S,Krause K H,et al.Nanoscale liquid chromatography and capillary electrophoresis coupled to electrospray mass spectrometry for the detection of amyloid-βpeptide related to alzheimer′s disease[J].J Chromatorgr A,2002,974(1-2):135-142.
[22] Clerico A,Franzini M,Masotti S,et al.State of the art of immunoassay methods for B-type natriuretic peptides:An update[J].Critical Reviews in Clinical Laboratory Sciences,2015,52(2):56-69.
[23] Iglesias W,Abbott N L,Mann E K,et al.Improving liquid crystal-based biosensing in aqueous phases[J].Acs Applied Materials & Interfaces,2012,4(12):6 884-6 890.
——微网状透光防炫目汽车前挡风玻璃膜的设计研究

