MicroRNA-195参与切应力对血管内皮细胞炎症调控作用的研究
吴小苑,范文冬
(1.广东省职业病防治院 广东 广州 510300;2.中山大学附属第一医院心内科,广东 广州 510080)
血流切应力决定着动脉粥样硬化斑块的非随机分布,对维持血管内皮细胞(endothelial cells,ECs)结构与功能的稳定起关键作用。生理范围内的血流切应力保护ECs,阻抑动脉粥样硬化病变的分子与生物力学机制仍不十分清楚[1]。新近研究发现,生理切应力能诱导ECs的microRNAs(miRNAs)表达谱发生改变,并通过miRNAs调控ECs的功能[2-5],但目前只有miR-19a[4]、miR-23b[5]及miR-21[2]等少数几个切应力诱导miRNAs的功能得到部分阐明。
随着研究的不断深入,动脉粥样硬化被认为是一种慢性炎症反应性疾病[6]。近年来,miRNA调控动脉粥样硬化炎症反应机制的研究正逐渐成为心血管研究领域的热点。当前研究表明生理切应力诱导miR-27b[2,4-5]、miR-143/145[7]、miR-195[2,4]、miR-19a[4]、miR-23b[5]及miR-10a[8]等表达上调;诱导miR-92a[9]、miR-221[5]、miR-20a[5]及 miR-182[4]等表达下调。其中miR-27b、miR-143/145及miR-195等在ECs中的功能还不清楚,而miR-195与ECs炎症反应的关系目前国内外未见有相关报道,本研究进一步验证它们的确受到生理切应力的调控以及miR-195与ECs炎症的相关关系。
1 材料与方法
1.1 材料
人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)。MicroRNA mimics及inhibitors:miR-27b、miR-143/145、miR-195、miR-126 mimics、miR-195 inhibitors及相应对照(NC)和inhibitor-NC(INC)(广州,锐博生物)。
1.2 miRNAs的qRT-PCR
验证生理切应力调节ECs miRNAs的表达:15 dyne/cm2的生理切应力处理HUVEC,24 h后利用实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测内皮细胞miR-27b、miR-143/145及miR-195等的表达变化。①miRNAs的逆转录:使用Life Technology的TaqMan® MicroRNA Assays试剂盒,按照其说明书的介绍,用miRNAs特异性引物进行逆转录;②qRTPCR检测:置于LightCycler®480仪器中,以U6作为内参,按照说明书介绍的方法扩增45个循环,每个样品做3个重复。
1.3 切应力发生装置的构建
这个系统由切应力处理腔室(µ-Slide I 0.4 Luer,ibidi),蠕动泵,以及各种导管组成。HUVEC细胞生长在µ-Slide I 0.4 Luer中,形成单细胞层后,在超净台中将培养液输送导管与装有培养基的透气广口瓶以及蠕动泵相连。由蠕动泵驱动培养基流经生长有细胞的µ-Slide I 0.4 Luer腔室,整个系统置于二氧化碳CO2培养箱中。切应力与流速的关系可根据µ-Slide I 0.4 Luer腔室供应商ibidi所供的公式计算:
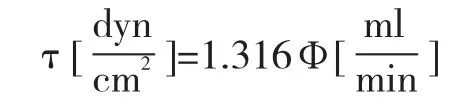
1.4 细胞转染实验
miRNAs mimics及inhibitors转染HUVEC细胞:分别用125μl的opti-MEM培养基稀释小分子RNA和Lipofectamine RNAiMAX试剂,将上述2种溶液混合并用移液器轻轻混匀,室温放置25 min。在等待的过程中给细胞更换新鲜的内皮细胞培养基(endothelial cell medium,ECM)。达到孵育时间后,将250μl opti-MEM、RNA及转染试剂的混合液,逐滴加入12孔板的相应孔中,轻轻摇动12孔板以混匀转染混合物,于培养箱中培养8 h后更换新鲜ECM完全培养基,细胞转染48~72 h后按实验需要处理细胞。
1.5 Western blot
体外转染miR-195等 mimics及inhibitors至HUVEC,通过Western blot检测ECs中p65的磷酸化(P-p65)水平及内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)、кB抑制蛋白(IкBα)等炎症相关因子的表达。Western blot方法包括:SDS PAGE电泳、转膜、封闭、孵育一抗、孵育二抗、ECL显色,结果扫描后用Quantity One(biorad)软件分析灰度值。
1.6 免疫荧光
体外转染miR-195 mimics及inhibitors至HUVEC,通过免疫荧光检测miR-195对ECs的炎症控制水平,主要检测转录因子核因子кB(NF-κB)的核转运情况。免疫荧光方法中所用抗体名称NF-κB,CST抗体编号为4764(兔抗)。一抗稀释比例,1︰50左右;二抗1︰5 000。HUVEC经过细胞固定、免疫染色后行荧光显微镜观察。
1.7 统计学方法
采用GraphPad Prism 5.0和SPSS 18.0软件进行数据分析。分子生物学实验的结果用均数±标准差(±s)表示,组间差异两组时用t检验,多组时采用单因素方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 切应力发生装置构建及生理切应力调节ECs miRNAs的表达
2.1.1切应力诱导HUVEC形态的改变 为分析切应力对ECs miRNAs表达的影响,首先建立一套体外切应力发生装置。采用15 dyne/cm2的切应力处理HUVEC,24 h后用显微镜观察细胞形态。结果表明:在生理切应力作用下,HUVEC排列成梭形并沿着切应力作用的方向排列;而未用切应力处理的HUVEC排列不规则,并且有少量死亡的细胞漂浮。上述结果证明切应力发生装置构建成功,可用于研究切应力对ECs miRNAs的表达的影响[1]。见图1。
2.1.2生理切应力诱导miR-195等表达上调 由于miR-126不受切应力的影响[7],因此以miR-126作为阴性对照,U6作为miRNAs表达的内参,运用TaqMan® MicroRNA Assays试剂盒验证生理切应力是否调控上述miRNAs的表达。结果表明:15 dyne/cm2的生理切应力处理HUVEC,24 h后miR-27b、miR-143/145及miR-195等表达上调(t=4.080、2.145、2.106、2.079,P=0.000、0.020、0.028 及 0.037),而miR-126的表达不受切应力的影响(t=1.655,P=0.103)。见图 2。

图1 切应力诱导HUVEC形态的改变
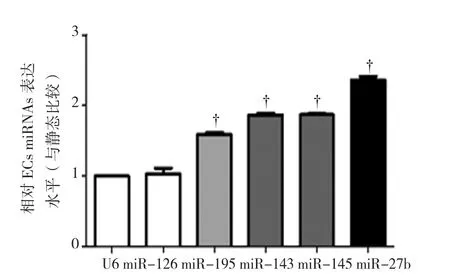
图2 生理切应力诱导ECs miRNAs的表达
2.2 miR-195可能参与切应力对ECs炎症的调控作用
2.2.1过表达miR-195抑制P-p65的表达NF-κB为1个转录因子蛋白家族,包括:Rel(cRel),p65(RelA和 NF-κB3),RelB 和 p50(NF-κB1),p52(NF-κB2)。在细胞核内,p65识别并结合特定的DNA序列,控制炎症基因的转录。p65的磷酸化(P-p65)促进NF-κB的活性,促进炎症,为探究miRNA-195介导了ECs炎症反应,本研究首先建立了一套有效的体外转染miRNAs至HUVEC的方法,通过Western blot证实了在ECs中过表达miR-195抑制了P-p65的表达(t=2.664,P=0.021)(见图3)。为了探索在内皮细胞激活的状况下miR-195发挥的功能,在转染miRNAs的同时,加入炎症刺激因子肿瘤坏死因子α(tumor necrosis factor-α,TNF-α),结果与无TNF-α共处理情况一致。
2.2.2抑制内源性的miR-195抑制IкBα的表达水平IкBα通过与NF-κB p65结合抑制NF-κB的核转运,抑制炎症。本研究发现,采用miRNA inhibitors抑制内源性的miR-195抑制了IкBα的表达水平(t=3.492,P=0.003)。见图 4。
2.2.3miR-195在ECs中的可能功能 过表达miR-195对ECs eNOS的表达没有影响,生理切应力诱导上调的miR-23b及生理切应力诱导下调的miR-92a对eNOS的表达影响差异无统计学意义(F=1.786,P=0.07)。而采用miRNA inhibitors抑制内源性的miR-195抑制了eNOS的表达水平(t=3.650,P=0.002)(见图5)。这提示着miR-195可能对于维持eNOS的稳定起关键作用,但其作用机制不明确,有待进一步的研究。
2.2.4MiR-195抑制NF-κB的核转运NF-κB的核转位在维持细胞正常生理功能方面发挥着重要作用,在促炎细胞因子刺激下,NF-κB转位到细胞核中并激活炎症基因的表达。免疫荧光结果显示(见图6):加入TNF-α促进了NF-κB的核转运。在ECs中过表达miR-195抑制了NF-κB的核转运,表现为无NF-κB核聚集或者核聚集量非常少,细胞质泛红(miR-195 VS NC)。INC与 miR-195-inhibitor比 较,可见细胞质里面也红色充满多一些(INC VS miR-195-inhibitor),而miR-195-inhibitor组细胞核内可见泛红荧光,说明抑制miR-195可能促进了NF-κB的核转运,促进炎症。

图3 过表达miR-195抑制P-p65的表达

图4 抑制内源性的miR-195抑制IкBα的表达水平
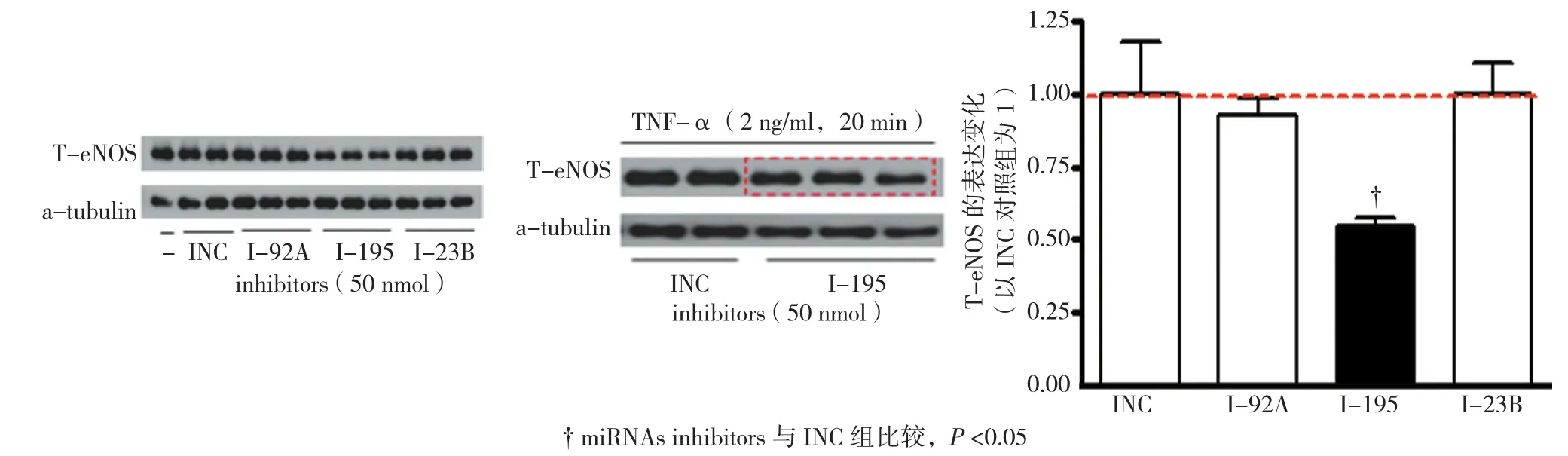
图5 miR-195的抑制剂抑制ECs eNOS的表达
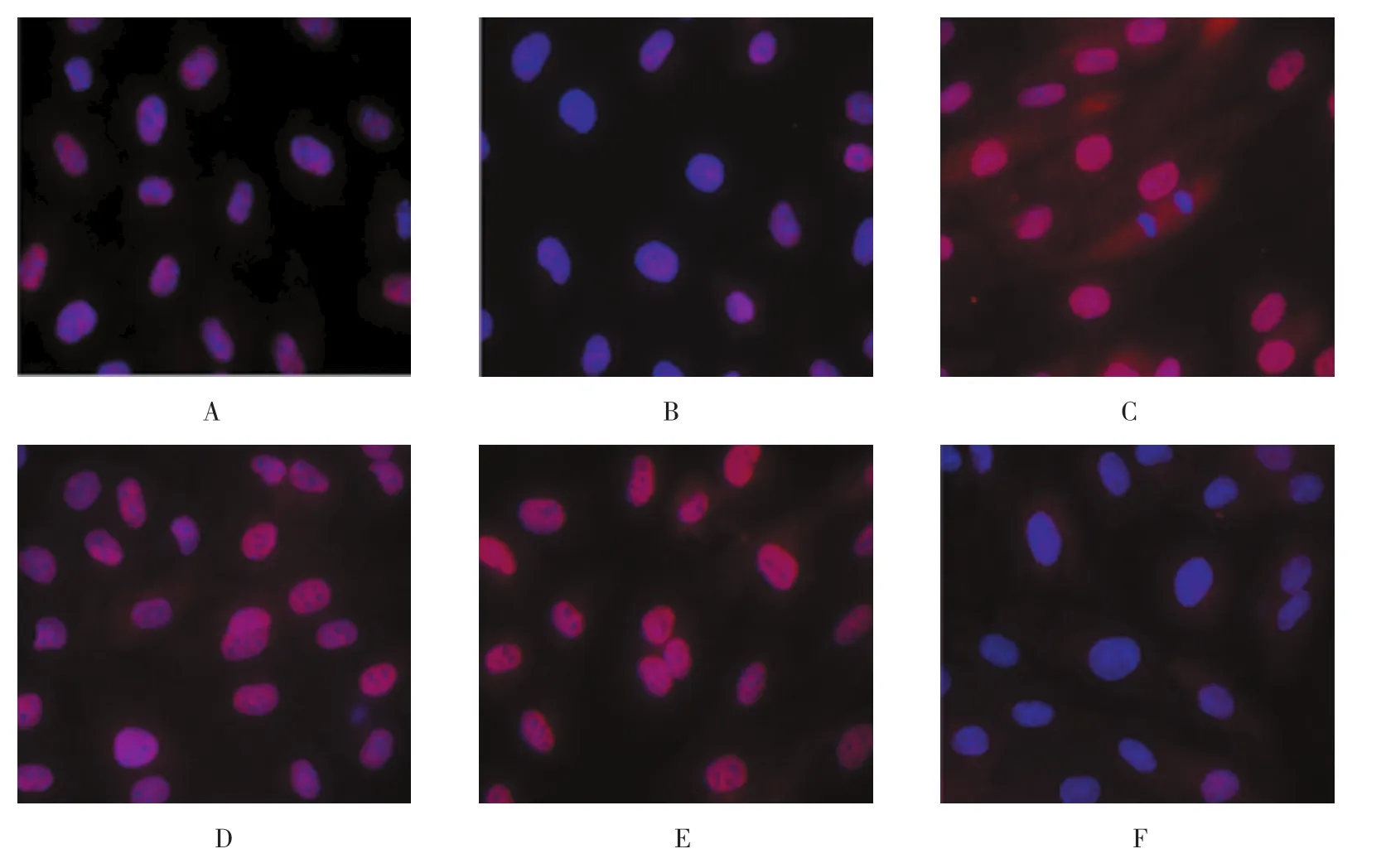
图6 miR-195抑制NF-κB的核转运
3 讨论
血流切应力是与血流方向一致的血流对ECs的摩擦力,决定着动脉粥样硬化斑块的非随机分布,对维持ECs功能的稳定起关键作用[1]。越来越多的证据表明,miRNAs参与切应力对ECs功能的调控作用,然而许多切应力诱导miRNAs在ECs中的功能还未被阐明。
动脉粥样硬化是一种炎症性疾病,炎症的其中1个关键调节器为转录因子核因子кB(NF-κB),很长一段时间以来,一直被视为促动脉粥样硬化的因素,主要因为它调控着许多涉及动脉粥样硬化的促炎基因。NF-κB作为促炎和抗炎基因的直接调节者以及在细胞存活和增殖方面的调控角色,可能在维护动脉粥样硬化过程的微妙平衡中发挥重要作用[10-11]。转录因子(NF)-κB家族成员是ECs炎症反应的重要调节因子。在细胞核内,RelA(p65)识别并结合特定的DNA序列,控制炎症基因的转录。
近年来,microRNA调控As炎症反应机制的研究逐渐成为心血管研究领域的热点。本研究首先建立了一套有效的体外转染miRNAs至HUVEC的方法,借助该套方法能够实现在ECs中过表达或是下调相关miRNAs的水平,从而分析它们在ECs中的功能。接着又成功构建了体外切应力模拟发生装置,利用该套系统成功的实现了生理切应力对ECs形态方面的调控。在证实了该套系统的可靠性后,本研究用该系统所产生的15 dyne/cm2生理切应力处理HUVEC,24 h后miR-27b、miR-143/145及miR-195等表达上调,而miR-126的表达则不受切应力的影响,这印证了相关文献的报道[7]。为探究miRNA-195介导了ECs炎症反应,本研究通过Western blot证实了在ECs中过表达miR-195抑制了P-p65的表达。在静息情况下,NF-κB二聚体与1个抑制蛋白(кB抑制剂,IкB)结合保持非活性状态。IкBα通过与NF-κB p65结合抑制NF-κB的核转运,抑制炎症。本研究发现,采用miRNA inhibitors抑制内源性的miR-195抑制了IкBα的表达水平。
eNOS在ECs、心肌细胞、血小板等多种细胞上均有表达,在一氧化氮NO的生成过程中也具有重要作用[12-13]。病理状态时,eNOS生成障碍或者表达降低,不仅会使血管内皮舒张受损,还会加重动脉粥样硬化等的血管炎症[14]。本研究采用miRNA inhibitors抑制内源性的miR-195也抑制了eNOS的表达水平。NF-κB的核转位在维持细胞正常生理机能方面发挥着重要作用。在促炎细胞因子刺激下,NF-κB转位到细胞核中并激活炎症基因的表达。免疫荧光结果显示:加入TNFα促进了NF-κB的核转运。在ECs中过表达miR-195抑制了NF-κB的核转运,而抑制miR-195可能促进了NF-κB的核转运,促进炎症。因此,生理切应力诱导的miR-195功能可以归纳为两点:①抑制Phospho-NF-κB p65亚基,Ser536位点的磷酸化,抑制NF-κB的活性,从而抑制炎症。②虽然不能够促进但却能够稳定eNOS的表达。
MiRNA通过与靶标基因mRNA的完全匹配结合,促使mRNA发生降解,或通过不完全地与靶mRNA的3’非编码区(3’UTR)互补结合抑制靶mRNA的翻译[15-16],将蛋白控制在生命活动所需的最佳水平上。根据miRNA的作用方式,通过生物信息学分析发现BTRCIRAK2MAP3K7等可能为miRNA-195的潜在靶标。因此,可推测生理切应力诱导miR-195表达上调,可能通过负调节潜在靶标的表达,抑制NF-κB通路,从而影响动脉粥样硬化炎症反应。本文较全面地探索了生理切应力诱导的miR-195的血管内皮保护功能,有助于进一步阐明动脉粥样硬化发生的分子和生物力学机制,为动脉粥样硬化相关病变的预防提供理论依据。
参 考 文 献:
[1]FAN W, FANG R, WU X, et al. Shear-sensitive microRNA-34a modulates flow-dependent regulation of endothelial in fl ammation[J]. J Cell Sci, 2015, 128(1): 70-80.
[2]WEBER M, BAKER M B, MOORE J P, et al. MiR-21 is induced in endothelial cells by shear stress and modulates apoptosis and eNOS activity[J]. Biochem Biophys Res Commun, 2010, 393(4):643-648.
[3]SEARLES C D, MOORE J, BAKER M, et al. Endothelial cell microRNA expression in response to laminar shear stress(abstract)[J]. Circulation, 2008, 118(18): S298.
[4]QIN X, WANG X, WANG Y, et al. MicroRNA-19a mediates the suppressive effect of laminar flow on cyclin D1 expression in human umbilical vein endothelial cells[J]. PNAS, 2010, 107(7):3240-3244.
[5]WANG K C, GARMIRE L X, YOUNG A, et al. Role of microRNA-23b in fl ow-regulation of Rb phosphorylation and endothelial cell growth[J]. PNAS, 2010, 107(7): 3234-3239.
[6]ROSS R. Atherosclerosis--an inflammatory disease[J]. N Engl J Med, 1999 Jan 14, 340(2): 115-126.
[7]HERGENREIDER E, HEYDT S, TREGUER K, et al.Atheroprotective communication between endothelial cells and smooth muscle cells through miRNAs[J]. Nat Cell Biol, 2012, 14:249-256.
[8]FANG Y, SHI C, MANDUCHI E, et al. MicroRNA-10a regulation of proin fl ammatory phenotype in athero-susceptible endothelium in vivo and in vitro[J]. PNAS, 2010, 107(30): 13450-13455.
[9]WU W, XIAO H, LAGUNA-FERNANDEZ A, et al. Flowdependent regulation of kruppel-like factor 2 is mediated by microRNA-92a[J]. Circulation, 2011, 124: 633-641.
[10]WU X Y, FAN W D, FANG R, et al. Regulation of microRNA-155 in endothelial in fl ammation by targeting nuclear factor (NF) -κB P65[J]. J Cell Biochem, 2014 Nov, 115(11): 1928-1936.
[11]DE WINTHER M P, KANTERS E, KRAAL G, et al. Nuclear factor kappaB signaling in atherogenesis[J]. Arterioscler Thromb Vasc Biol, 2005 May, 25(5): 904-914.
[12]ALDERTON W K, COOPER C E, KNOWLES R G. Nitric oxide synthases: structure, function and inhibition[J]. Biochem J, 2001 Aug 1, 357(3): 593-615.
[13]DUDZINSKI D M, IGARASHI J, GREIF D, et al. The regulation and pharmacology of endothelial nitric oxide synthase[J]. Annu Rev Pharmacol Toxicol, 2006, 46: 235-276.
[14]SESSA W C. eNOS at a glance[J]. J Cell Sci, 2004, 117(12):2427-2429.
[15]AMBROS V. The functions of animal microRNAs[J]. Nature,2004 (431): 350-355.
[16]BARTEL D P. MicroRNAs: target recognition and regulatory functions[J]. Cell, 2009(136): 215-233.

