外源乙烯对长春花生理水平和生物碱积累的影响
常博文 刘 杰 钟 鹏 郭晓瑞
(1.黑龙江省农业科学院农村能源研究所,哈尔滨 150040; 2.东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040)
长春花(Catharanthusroseus(L.) G.Don)是夹竹桃科(Apocynaceae)长春花属(Catharanthus)多年生草本或亚灌木花卉[1],它不仅具有观赏价值,也是具有多种功效的药用植物。长春花植株药用价值主要来自其体内含有的100多种萜类吲哚生物碱[2~3]如文多灵[4](Vindoline,VIN)、长春质碱[5](Catharanthine,CAT)、阿玛碱[6](Ajmalicine),特别是一些具有抗肿瘤功效的药用成分如长春碱[7~8](Vinblastine,VINB)。生物碱在长春花中共同前体异胡豆苷(Strictosidine,STR)是由莽草酸途径中的色胺和类萜途径的裂环马钱子苷在异胡豆苷合成酶(Strictosidine synthase,str)的催化下合成[9](图1),异胡豆苷的含量一定程度上决定了下游生物碱的含量。异胡豆苷经过多步酶促反应合成单萜生物碱文多灵和长春质碱,这两种生物碱在过氧化物酶(CrPRX)的催化下合成二萜生物碱长春碱,由于目前尚无工业化生产长春碱等化合物的技术,所以研究提高长春花中长春碱和长春新碱的处理方法是关键。

图1 长春花中长春碱合成途径Fig.1 The biosynthetic pathway of vinblastine in C.roseus
乙烯是一种气体植物激素,广泛存在于植物生长的各个时期调控植物生长发育过程和抵御外界不良条件的应答反应。乙烯应答因子(Ethylene-response factor,ERF)是植物特有的转录因子,不仅参与到植物种子萌发、生长、开花、衰老和抵御非生物胁迫的过程中[10~14],同时在植物次生代谢物合成方面也起到重要作用[15~16]。已有研究表明,外源施加乙烯能够促进长春花中生物碱的积累,并且施加乙烯浓度不同时生物碱含量也有所差异[17];另外,外施乙烯也影响植物体内生理生化过程,例如外施乙烯气体时植物光合速率下降,促进叶绿素降解[18~19]。但对于外源乙烯处理下花生生理生化水平与生物碱之间相关性的研究还未见报道。
针对以上问题,本研究使用乙烯利作为乙烯释放剂,对外源乙烯处理下长春花生长、光合作用强度、活性氧含量和长春碱等生物碱含量进行研究并进行相关性分析,研究结果为长春碱及其前体化合物生产提供依据。
1 材料与方法
1.1 试验材料及处理
试验所用长春花种子来自位于浙江富阳市的杭州海正药用植物有限公司种植基地。长春花培养和样品处理在实验室中进行,使用人工气候箱进行培养,培养条件:温度为28℃(日)/25℃(夜),光照14 h,湿度为80%。使用1/2 Hoagland营养液浇灌长春花幼苗,生长至3对真叶完全展开后开始进行乙烯利处理。
1.2 试验方法
1.2.1生长指标测定
乙烯利易溶于水,在1/2 Hoagland营养液中加入乙烯利粉末(Sigma,USA)使其最终浓度为100 μmol·L-1,长春花幼苗在含100 μmol·L-1乙烯利营养液中培养4 d,记录每天长春花生长指标,包括:株高、根长、根重、单株生物量等。
1.2.2乙烯释放量测定
方法参照文献15。对照组和处理组随机选取5株样本,长春花幼苗进行100 μmol·L-1乙烯利处理0.5、1、2、3 h,每株放入相同体积的密闭容器中,吸取20 mL密闭容器中的气体,使用气相色谱仪(Agilent Technologies,7890A GC Systems)检测乙烯释放量。
1.2.3光合作用指标测定
长春花幼苗进行100 μmol·L-1乙烯利处理4 d,测定处理前后光合参数。在晴朗的天气中使用便携式光合仪(LI-6400,LI-COR,美国)进行测量(光强为1000 μmol·m-2·s-1;CO2浓度为400 μmol·mol-1;叶温25±2℃),记录净光合速率(Pn)、胞间二氧化碳浓度(Ci)、蒸腾速率(Tr)和气孔导度(Gs)。
1.2.4生物碱含量测定
异胡豆苷、长春质碱、文多灵和长春碱含量检测方法参考文献[20]。长春花幼苗进行100 μmol·L-1乙烯利处理4 d,每天取样。称取烘干的长春花叶片粉末0.3 g,加入5 mL甲醇,超声提取20 min,离心并提取上清液,减压浓缩挥干。甲醇溶解定容至1.5 mL,使用0.45 μm微孔滤膜过滤后供高效液相色谱(HPLC)检测。
1.2.5基因表达量检测
处理和取样参考1.2.2。RNA提取:100 mg样本冻干粉加入1 mL TRIzol反应液,使用RNA提取试剂盒(QIAGEN公司)提取总RNA,NanoDrop ND-1000分光光度计(NanoDrop Technologies)测定OD260/OD280检测RNA纯度。将提取的总RNA进行反转录,方法参考TAKARA反转录试剂盒,采用20 μL体系。反转得到的cDNA稀释10倍后,以qRT-PCR设计的引物(表1)进行qRT-PCR反应和检测,选用长春花actin基因作为内参基因。
1.2.6统计分析
本研究所有试验重复3次,数据分析使用SPSS 17.0软件,并采用单因素方差分析( One-Way ANOVA)检验各处理间的差异显著性,制图使用Excel 进行。

表1 基因引物序列
2 实验结果
2.1 外源乙烯对长春花乙烯释放量和erf基因表达的影响
乙烯利被植物细胞吸收之后进行分解,释放乙烯。为了验证外源施加的乙烯利是否在植物内发挥作用,所以检测了长春花乙烯释放量和erf基因表达量(图2)。随着乙烯利处理时间的增加,长春花乙烯释放量逐渐加大,对照组(CK)植株的乙烯释放量基本为0,处理30 min后乙烯释放量急剧增长,处理3h后测定的乙烯峰面积为12.33,说明乙烯释放量随着处理时间的延长一直积累。
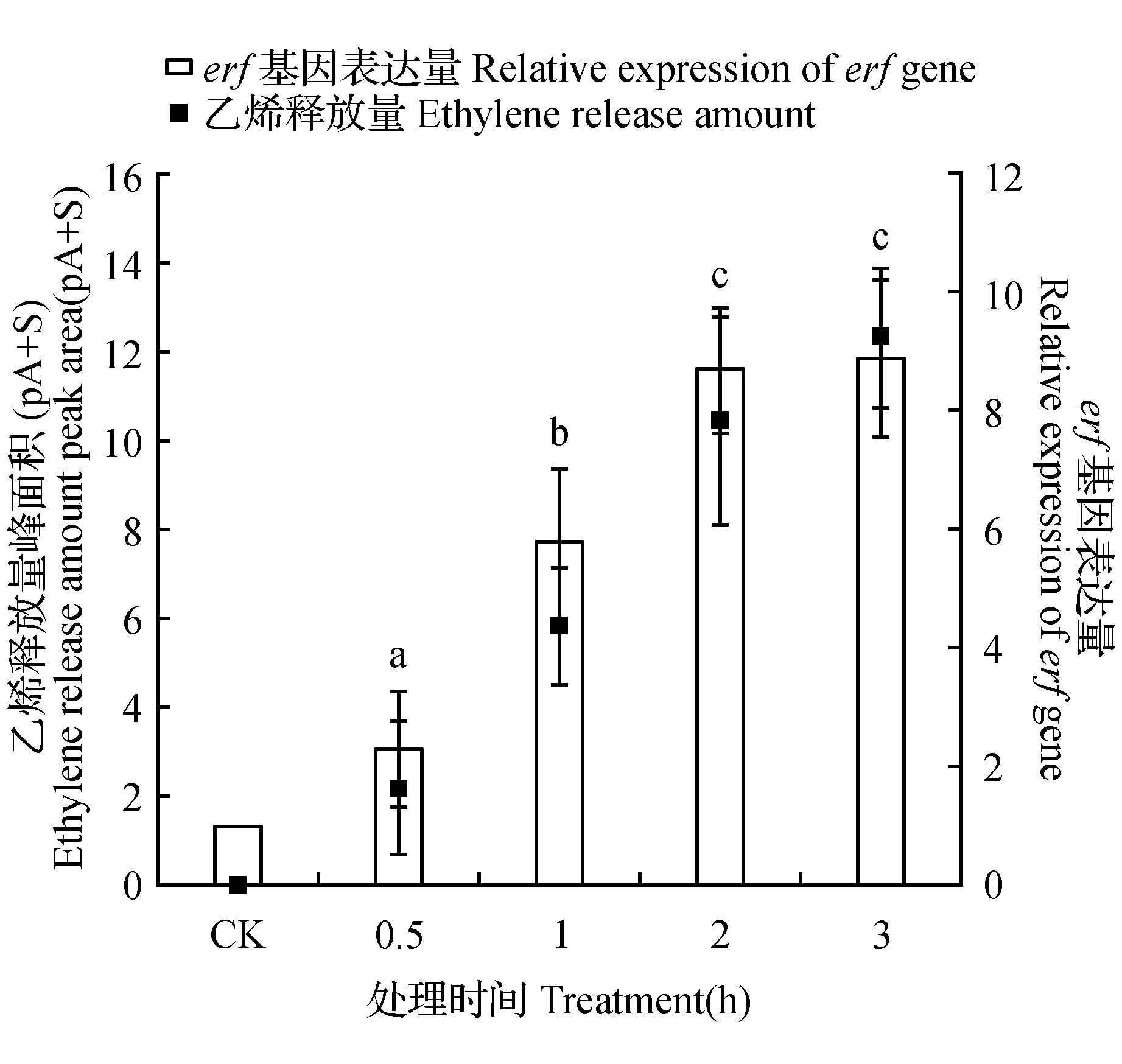
图2 乙烯利处理对长春花乙烯释放量和erf基因表达的影响 字母表示erf基因表达量之间的差异显著性。Fig.2 The effect of ethephon treatment on ethylene release amount and erf gene expression in C.roseus The letters represent the significance of difference in erf gene expression between treatments.

图3 乙烯利处理对长春花中生物碱合成的影响Fig.3 The effect of ethephon on the accumulations of alkaloids in C.roseus
ERF转录因子是乙烯信号途径中调控植物乙烯反应的关键,所以erf基因的表达量可以反映外源乙烯的施加对长春花内源乙烯信号转导的影响。乙烯利处理对长春花erf基因表达影响很大。由图2可以看出,随着乙烯利处理时间的延长,erf基因表达量显著升高(P<0.05)。处理时间为0.5~2 h时,erf表达量显著急剧上升(P<0.05);处理3 h后,erf表达量是对照组的8.9倍。
2.2 外源乙烯对长春花生物碱含量的影响
检测乙烯利处理后长春花中4种重要生物碱含量(图3),结果表明:处理1~3天时,乙烯利处理组的长春碱含量与未施加处理的对照组的差异不明显;处理3~4天后,乙烯利处理组的长春碱含量显著高于对照组。
2.3 外源乙烯对长春花生物碱合成途径关键酶基因表达的影响
为了进一步验证乙烯对长春花长春碱生物合成的影响,检测了长春碱合成途径中关键酶基因(str,CrPRX)的表达量(图4)。乙烯处理后str和CrPRX基因表达量显著上升,str基因表达量是对照的3.44倍,CrPRX基因表达量上升了167%。

图4 乙烯利处理对长春花中生物碱合成途径关键酶基因str、CrPRX表达量的影响Fig.4 The effect of ethephon on the expression of key enzyme genes(str,CrPRX) in alkaloids biosynthesis pathway in C.roseus
2.4 外源乙烯对长春花植株生长的影响
乙烯利处理影响长春花生长(表2),结果表明:与对照组相比,处理组随着乙烯利施加时间积累,长春花单株生物量和株高被抑制,根长和根重影响不显著与对照组相似,茎秆直径增加。乙烯利处理4 d后,单株生物量和株高分别下降了2.7%、4.9%;茎秆直径增加了4.8%。
2.5 外源乙烯对长春花光合作用的影响
对比乙烯利处理前后长春花光合作用参数(表3),结果表明:与对照组相比,处理组净光合速率、气孔导度和蒸腾速率都呈下降趋势,胞间CO2浓度却上升。净光合速率下降幅度较大,约下降了38.9%,其次是气孔导度下降10.9%,蒸腾速率下降了9.3%,胞间CO2浓度上升了19.3%。
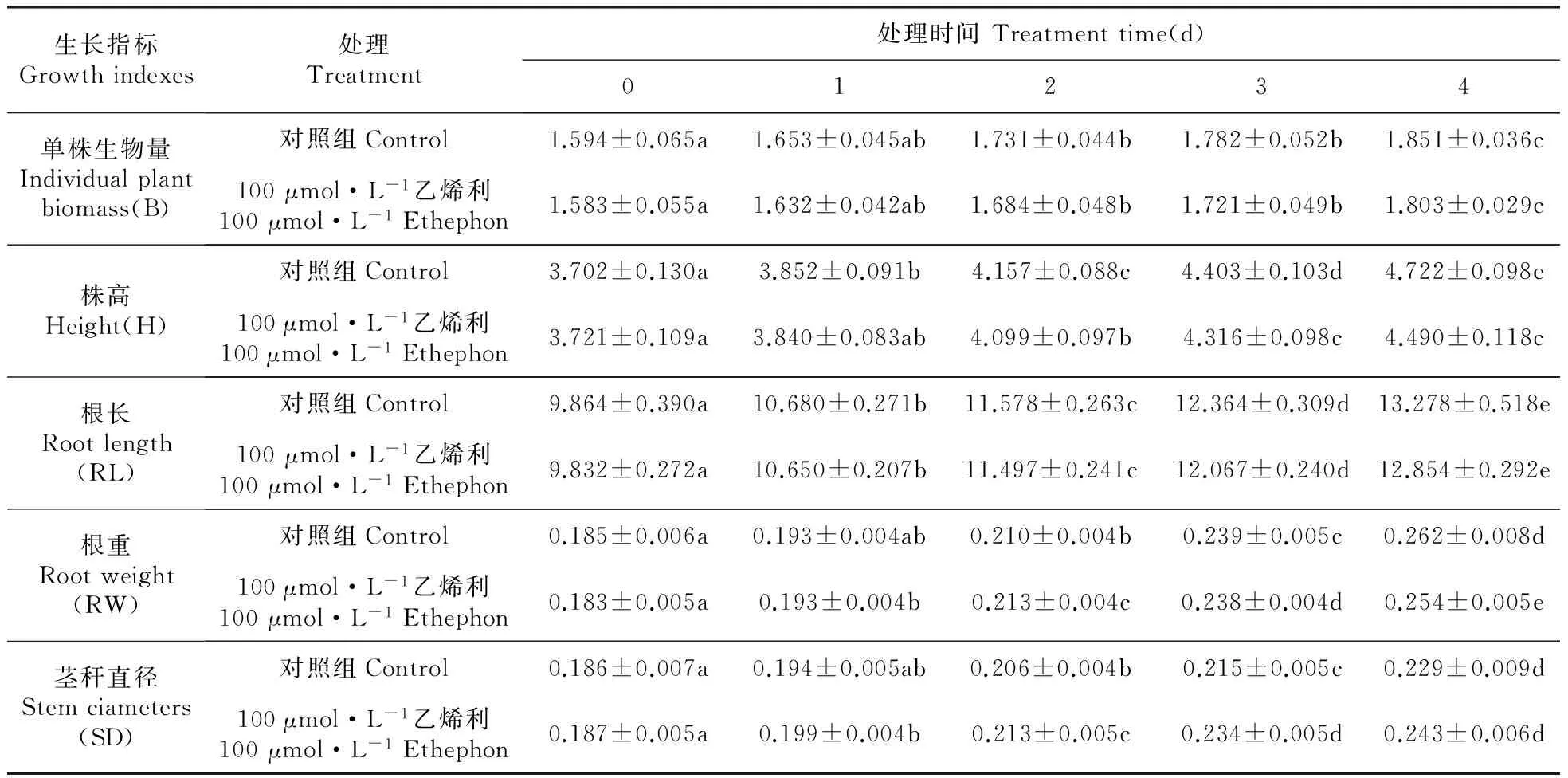
表2 乙烯利处理对长春花生长的影响
表3乙烯利处理对长春花光合作用的影响
Table3TheeffectofethephonontheaccumulationsofalkaloidsinC.roseus
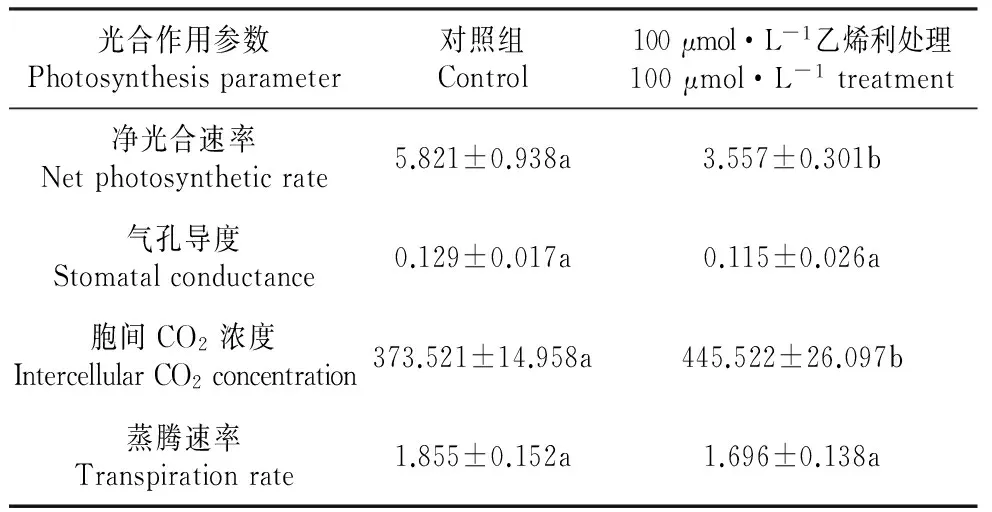
光合作用参数Photosynthesisparameter对照组Control100μmol·L-1乙烯利处理100μmol·L-1treatment净光合速率Netphotosyntheticrate5.821±0.938a3.557±0.301b气孔导度Stomatalconductance0.129±0.017a0.115±0.026a胞间CO2浓度IntercellularCO2concentration373.521±14.958a445.522±26.097b蒸腾速率Transpirationrate1.855±0.152a1.696±0.138a
2.6 生物碱、光合参数和生长指标之间相关性
分析乙烯利处理4 d前后长春花生物碱、光合参数和生长指标之间的相关性(表4),表明3种生物碱之间存在显著正相关性(P<0.05)。分析光合参数与生物碱之间相关性,表明净光合速率与3种生物碱呈显著负相关性(P<0.05);气孔导度与长春碱、文多灵之间显著负相关(P<0.05),但与长春质碱相关性不显著。生长指标中茎秆直径与3种生物碱之间存在显著正相关性(P<0.05),株高与3种生物碱之间显著负相关(P<0.05),单株生物量与长春碱、文多灵之间存在显著负相关性(P<0.05),但与长春质碱之间相关性不显著。光合参数与生长指标相关性分析表明净光合速率与单株生物量、茎秆直径、株高之间存在显著相关性,气孔导度、胞间CO2浓度与生长指标相关性不显著。
表4生物碱、光合参数和生长指标之间相关性分析
Table4Thecorrelationanalysisofalkaloids,photosyntheticparametersandgrowthindexes

生物碱Alkaloids光合参数Photosynthesisparameter生长指标GrowthindexesVINBVINCATPnGsCiBSDHVINB1 VIN0.962**1 CAT0.900*0.924**1 Pn-0.993**-0.978**-0.914*1 Gs-0.871*-0.869*-0.7240.875*1 Ci0.6060.6460.372-0.652-0.6111 B-0.832*-0.830*-0.6420.842*0.644-0.864*1 SD0.887*0.927**0.871*-0.887*-0.6540.554-0.859*1 H-0.918**-0.858*-0.891*0.929**0.688-0.5560.768-0.7861
*P<0.05;**P<0.01
3 讨论
长春花可产生大量的萜类吲哚生物碱(TIAs)具有重要的药理作用,目前分离和鉴定出130多种TIAs[21],其中长春碱这种二萜生物碱具有抗肿瘤的功效,长春花是医疗上应用广泛的抗癌药物主要原料之一。长春碱体外合成具有种种技术限制,目前临床上的长春碱主要以人工种植为主要来源之一。由于植物体内含量较少,所以如何提高长春花中长春碱的产量,是长春花人工种植值得研究的问题[22]。乙烯利在农业上是一种植物调节剂,通过植物吸收后在细胞内分解为乙烯分子[23],通过外部施加乙烯利提高内源乙烯含量,与本研究结果一致。乙烯利处理也促进乙烯信号响应因子基因erf转录(图2),erf基因上调表达反映了外源乙烯利处理使细胞内乙烯信号加强。
前人和本研究都发现外源乙烯处理能够使长春花中生物碱含量升高[15]。异胡豆苷含量在乙烯处理下显著升高,并且催化异胡豆苷合成的关键酶基因str也显著上调表达(图3~4),说明乙烯调控通过调控异胡豆苷合成酶的含量来促进异胡豆苷合成。文多灵和长春质碱对于乙烯利处理较为敏感,处理1天后这两种生物碱含量就显著升高(P<0.05),长春碱作为文多灵和长春质碱缩合形成的二萜生物碱,在处理1~2天时含量与对照组没有明显差异,这可能与这条合成途径上的限速酶含量有关。处理3~4天后长春碱含量显著高于对照组,Wang等研究表明施加乙烯利处理使长春碱含量升高可能是通过在转录水平上促进长春碱的合成酶CrPrx基因上调表达来实现的[15],与本研究结果一致,但ERF转录因子如何调控CrPrx基因的表达尚不清楚需要进一步研究。
乙烯对植物伸长生长具有抑制作用,这是因为乙烯在光照下和黑暗中都抑制细胞伸长[24],研究表明乙烯对伸长生长的抑制作用主要是通过调节细胞骨架重排[24~27]、细胞壁松弛[27~29]和吸收水分增加膨压的途径。本研究表明乙烯利处理后长春花株高和单株生物量有显著下降,根长也有所下降,但下降幅度不明显;另外乙烯利处理组的茎秆直径明显高于对照组(表2)。
气孔参与植物光合作用和水分代谢,是植物体内与外界环境之间气体和水分交换的重要媒介。前人对不同处理时间下外源乙烯调控植物气孔运动的研究表明乙烯通过促进拟南芥叶片中H2O2合成诱导气孔关闭[30~33],也可以诱导番茄和蚕豆气孔关闭[34]。本研究结果显示乙烯利处理后,长春花气孔导度(Gs)下降(表3),表明外源乙烯处理诱导长春花叶片气孔关闭。乙烯利处理后净光合速率(Pn)低于对照组,但胞间CO2浓度(Ci)高于对照组,说明适于非气孔因素导致的净光合速率下降。净光合速率与长春花单株生物量、株高和茎秆直径生长与生物碱之间存在明显相关性,推测单株生物量下降与净光合速率减弱有关。
分析生物碱、光合参数和生长指标之间的相关性(表4),可以看出净光合速率与单株生物量(B)和株高(H)呈显著正相关(P<0.05),但与茎秆直径(SD)呈显著负相关(P<0.05),推测是由于净光合速率降低导致植物生物量下降。另外,分析表明净光合速率与长春碱(VIB)、文多灵(VIN)和长春质碱(CAT)之间呈显著负相关(P<0.05)。生物碱的含量与长春花的生长指标之间也存在显著相关性,这主要与乙烯对植物生长的影响有关。由相关性分析结果可知,单株生物量与长春碱、文多灵呈显著负相关(P<0.05),株高与长春碱、文多灵和长春质碱呈显著负相关(P<0.05),长春花茎秆直径与长春碱、文多灵和长春质碱呈显著正相关(P<0.05)。乙烯合成调控因子和乙烯信号转导途径调控因子已经证实可以上调植物次生代谢物含量[35~37]。随着外源乙烯的处理,单株生物量和株高受到抑制,但次生代谢物含量增加,在代谢水平上推测外源乙烯促进次生代谢物合成,抑制与次生代谢途径无关的初生代谢物,但需要进一步验证。
4 结论
外源乙烯利促进长春花内部乙烯含量上升,诱导乙烯信号途径下游erf基因表达。外源乙烯抑制长春花生物量积累、茎根伸长生长,但促进茎秆直径增加,对根重影响不大。乙烯利处理4天后长春花净光合速率、气孔导度下降,胞间CO2浓度上升,说明是非气孔因素导致净光合速率下降。乙烯处理下生理指标与生物碱含量之间存在明显的相关性。净光合速率与长春花单株生物量、株高和茎秆直径生长与生物碱之间存在明显相关性。乙烯利处理促进长春质碱、文多灵和长春碱等次生代谢产物积累,同时也促进长春碱合成途径中关键酶基因str和CrPRX上调表达。长春碱、文多灵、长春质碱与单株生物量和株高负相关,与茎秆直径显著正相关。
1.祖元刚,王非,马书荣,等.长春花生活史型研究[M].北京:科学出版社,2006.
Zu Y G,Wang F,Ma S R,et al.The life history pattern research ofCatharanthusroseus[M].Beijing:Science Press,2006.
2.常博文,冯时,赵晓菊,等.浙江富阳和海南文昌人工种植长春花生物碱积累组织特异性对比[J].植物研究,2012,32(3):381-384.
Chang B W,Feng S,Zhao X J,et al.Organ-specific distribution of alkaloid accumulations inCatharanthusroseusartificially cultivated in Fuyang,Zhejiang Province and Wenchang,Hainan Province[J].Bulletin of Botanical Research,2012,32(3):381-384.
3.Liu J,Cai J,Wang R,et al.Transcriptional regulation and transport of terpenoid indole alkaloid inCatharanthusroseus:exploration of new research directions[J].International Journal of Molecular Sciences,2016,18(1):53.
4.李其林,张高兰,赖增伟,等.文多灵生物碱中关键中间体的合成研究[J].云南民族大学学报:自然科学版,2012,21(6):391-394.
Li Q L,Zhang G L,Lai Z W,et al.Synthesis of the key intermediate in the total synthesis of vindoline[J].Journal of Yunnan University of Nationalities(Natural Sciences Edition),2012,21(6):391-394.
5.柏道鸣,周广涛,代龙.阳离子交换树脂纯化长春花中文多灵和长春质碱的工艺优选[J].辽宁中医药大学学报,2012,14(12):182-184.
Bo D M,Zhou G T,Dai L.Research on purification process of vindoline and catharanthine fromCatharanthusroseusby means of cation exchange resin[J].Journal of Liaoning University of TCM,2012,14(12):182-184.
6.向蓓蓓,朱晔荣,王文娟,等.盐胁迫对长春花愈伤组织生长及阿玛碱积累的影响[J].中草药,2011,42(1):167-170.
Xiang B B,Zhu Y R,Wang W J,et al.Effects of salt stress on growth and ajmalicine accumutation ofCatharanthusroseuscalli[J].Chinese Traditional and Herbal Drugs,2011,42(1):167-170.
7.宫爽,孙佳明,田淋淋,等.天然药物中生物碱类成分抗肿瘤活性[J].吉林中医药,2014,34(9):927-931.
Gong S,Sun J M,Tian L L,et al.Research progress of the anti-tumor effect of alkaloids of natural medicine[J].Jilin Journal of Traditional Chinese Medicine,2014,34(9):927-931.
8.李学涛,程岚,姜英,等.长春碱亲水基修饰阳离子脂质体对荷瘤小鼠的抗肿瘤作用研究[J].中国药房,2015,26(31):4339-4341.
Li X T,Cheng L,Jiang Y,et al.Study on Anti-tumor effects of vinblastine hydrophilic group modified cationic liposomes in tumor-bearing mice[J].China Pharmacy,2015,26(31):4339-4341.
9.王淼,李秋荣.利用真空渗入法在烟草植物叶片中表达异胡豆苷合酶(英文)[J].生物化学与生物物理学报,2002,34(6):703-706.
Wang M,Li Q R.Transient expression of strictosidine synthase in tobacco leaves by vacuum infiltration[J].Acta Biochimica et Biophysica Sinica,2002,34(6):703-706.
10.El-Maarouf-Bouteau H,Sajjad Y,Bazin J,et al.Reactive oxygen species,abscisic acid and ethylene interact to regulate sunflower seed germination[J].Plant,Cell & Environment,2015,38(2):364-374.
11.Van De Pole B,Smet D,Van Der Straeten D.Ethylene and hormonal cross talk in vegetative growth and development[J].Plant Physiology,2015,169(1):61-72.
12.Ma N,Tan H,Liu X H,et al.Transcriptional regulation of ethylene receptor and CTR genes involved in ethylene-induced flower opening in cut rose(Rosahybrida) cv.Samantha[J].Journal of Experimental Botany,2006,57(11):2763-2773.
13.Ueda H,Kusaba M.Strigolactone regulates leaf senescence in concert with ethylene inArabidopsis[J].Plant Physiology,2015,169(1):138-47.
14.Cheng M C,Liao P M,Kuo W W,et al.The Arabidopsis ETHYLENE RESPONSE FACTOR1 regulates abiotic stress-responsive gene expression by binding to different cis-acting elements in response to different stress signals[J].Plant Physiology,2013,162(3):1566-1582.
15.Xi W,Pan Y J,Chang B W,et al.Ethylene-induced vinblastine accumulation is related to activated expression of downstream TIA pathway genes inCatharanthusroseus[J].BioMed Research International,2016,2016:3708187.
16.Liu J,Liu Y,Wang Y,et al.The combined effects of ethylene and MeJA on metabolic profiling of phenolic compounds inCatharanthusroseusrevealed by metabolomics analysis[J].Frontiers in Physiology,2016,7:217.
17.Yahia A,Kevers C,Gaspar T,et al.Cytokinins and ethylene stimulate indole alkaloid accumulation in cell suspension cultures ofCatharanthusroseusby two distinct mechanisms[J].Plant Science,1998,133(1):9-15.
18.Kays S J,Pallas J E,Jr.Inhibition of photosynthesis by ethylene[J].Nature,1980,285(5759):51-52.
19.Cheng Y D,Guan J F.Involvement of pheophytinase in ethylene-mediated chlorophyll degradation in the peel of harvested ‘Yali’ Pear[J].Journal of Plant Growth Regulation,2014,33(2):364-372.
20.杨蕾,唐中华,祖元刚.高效液相色谱法同时测定长春花中的文多灵、长春质碱和脱水长春碱[J].色谱,2007,25(4):550-552.
Yang L,Tang Z H,Zu Y G.Simultaneous determination of vindoline,catharanthine and anhydrovinblastine inCatharanthusroseusby high performance liquid chromatography[J].Chinese Journal of Chromatography,2007,25(4):550-552.
21.邢世海,王荃,潘琪芳,等.长春花萜类吲哚生物碱的生物合成途径[J].西北植物学报,2012,32(9):1917-1927.
Xing S H,Wang Q,Pan Q F,et al.Research progress of Terpenoid Indole Alkaloids (TIAs) biosynthetic pathway ofCatharanthusroseus[J].Acta Botanica Boreali-Occidentalia Sinica,2012,32(9):1917-1927.
22.谢阳姣,何志鹏.乙烯利对苦玄参生长的影响[J].南方农业学报,2013,44(7):1100-1104.
Xie Y J,He Z P.Effects of ethrel on growth ofPicriafel-terraeLour[J].Journal of Southern Agriculture,2013,44(7):1100-1104.
23.牛玉,戚志强,韩旭,等.矮壮素和乙烯利对樱桃番茄幼苗生长的影响[J].热带作物学报,2013,34(12):2353-2357.
Niu Y,Qi Z Q,Han X,et al.Effect of plant chlormequat and ethephon on growth of cherry tomato seedlings[J].Chinese Journal of Tropical Crops,2013,34(12):2353-2357.
24.Le J,Vandenbussche F,Van Der Straeten D,et al.Position and cell type-dependent microtubule reorientation characterizes the early response of theArabidopsisroot epidermis to ethylene[J].Physiologia Plantarum,2004,121(3):513-519.
25.Le J,Vandenbussche F,De Cnodder T,et al.Cell elongation and microtubule behavior in theArabidopsishypocotyl:responses to ethylene and auxin[J].Journal of Plant Growth Regulation,2005,24(3):166-178.
26.Bashline L,Lei L,Li S D,et al.Cell wall,cytoskeleton,and cell expansion in higher plants[J].Molecular Plant,2014,7(4):586-600.
27.Polko J K,Van Zanten M,Van Rooij J A,et al.Ethylene-induced differential petiole growth inArabidopsisthalianainvolves local microtubule reorientation and cell expansion[J].New Phytologist,2012,193(2):339-348.
28.Sasidharan R,Voesenek L A C J,Pierik R.Cell wall modifying proteins mediate plant acclimatization to biotic and abiotic stresses[J].Critical Reviews in Plant Sciences,2011,30(6):548-562.
29.Vissenberg K,Fry S C,Verbelen J P.Root hair initiation is coupled to a highly localized increase of xyloglucan endotransglycosylase action inArabidopsisroots[J].Plant Physiology,2001,127(3):1125-1135.
30.Hou Z H,Liu G H,Hou L X,et al.Regulatory function of polyamine oxidase-generated hydrogen peroxide in ethylene-induced stomatal closure inArabidopsisthaliana[J].Journal of Integrative Agriculture,2013,12(2):251-262.
31.Liu J,Liu G H,Hou L X,et al.Ethylene-induced nitric oxide production and stomatal closure inArabidopsisthalianadepending on changes in cytosolic pH[J].Chinese Science Bulletin,2010,55(22):2403-2409.
32.Desikan R,Hancock J T,Bright J,et al.A role for ETR1 in hydrogen peroxide signaling in stomatal guard cells[J].Plant Physiology,2005,137(3):831-834.
33.高晶晶,王瑞斌,贺军民.乙烯对UV-B辐射诱导蚕豆气孔关闭的调控效应[J].西北植物学报,2011,31(4):690-696.
Gao J J,Wang R B,He J M.Involvement of ethylene in the UV-B-induced stomatal closure in broad bean[J].Acta Botanica Boreali-Occidentalia Sinica,2011,31(4):690-696.
34.王娟,佘小平,郭静.乙烯和H2O2在光/暗调控气孔运动中的作用[J].陕西师范大学学报:自然科学版,2009,37(5):74-77.
Wang J,She X P,Guo J.Roles of ethylene and H2O2in light/dark-regulated stomatal movement[J].Journal of Shaanxi Normal University(Natural Science Edition),2009,37(5):74-77.
35.Danekar A M,Teo G,Defilippi B G,et al.Effect of down-regulation of ethylene biosynthesis on fruit flavor complex in apple fruit[J].Transgenic Research,2004,13(4):373-384.
36.Von Dahl C C,Winz R A,Halitschke R,et al.Tuning the herbivore-induced ethylene burst:the role of transcript accumulation and ethylene perception inNicotianaattenuata[J].The Plant Journal,2007,51(2):293-307.
37.Shoji T,Kajikawa M,Hashimoto T.Clustered transcription factor genes regulate nicotine biosynthesis in tobacco[J].The Plant Cell,2010,22(10):3390-3409.

