越橘茎尖离体培养条件的研究
李艳霞 邓继峰 李桂君*
(1.黑龙江省林业科学研究所,哈尔滨 150081; 2.沈阳农业大学林学院,沈阳 110866)
茎尖组织培养具有培养时间短,繁殖倍数高,不受季节影响的特点,已被广泛应用于农作物、果树、花卉等领域[1~3]。通过微茎尖培养直接诱导成苗,不仅可以获得无病毒植株,还可用于种质资源保存、遗传转化等多种研究[4~5]。
越橘(Vacciniumvitis-idaeaL.)是杜鹃花科(Ericaceae)越橘属(Vaccinium)多年生浆果类植物[6]。果实富含维生素、有机酸、糖类、微量元素和类黄酮等[7],具有抗菌消炎、抗氧化、防癌、预防心血管疾病、改善视力和增强免疫力等作用[8],是集营养、药用和经济价值为一体的经济林树种,近年来倍受人们的关注。
目前国外已经培育出了近百个越橘优良品种,且已形成了产业化。虽然我国对越橘的研究、开发和利用较晚,但在种质资源收集、引种栽培、繁殖等方面取得了一定进展。各类越橘的繁殖方法不同,但组织培养法更能适合越橘快速发展的需要[9],在国外通过茎尖培养获得脱病毒苗,在生产上得到了广泛应用。国内有关越橘组织培养主要有,金彦磊等[10]和田新华[11]等对越橘叶片、子叶、胚轴、腋芽及茎段为外植体的组培快繁进行了研究。而对越橘微茎尖进行离体培养缺乏系统研究。因此,本研究以越橘为材料,旨在建立越橘茎尖离体培养及植株再生组培体系,为越橘无病毒苗繁育、种质资源保存以及商业化生产等奠定基础。
1 材料与方法
1.1 外植体消毒
剪取当年生越橘优树嫩梢,用自来水冲洗30 min。在超净工作台上,用75%的酒精溶液消毒30 s,无菌水冲洗2次,转到0.1%升汞溶液中灭菌5~8 min,再用无菌水冲洗5次,最后用无菌滤纸吸干表面水份备用。
1.2 培养基筛选试验
分别以MS、WPM、改良的WPM(用708 mg·L-1的Ca(NO3)2·4H2O、202 mg·L-1的KNO3代替WPM培养基中的CaCl2和K2SO4)为基本培养基,培养基中分别添加ZT 0.05 mg·L-1、GA30.1 mg·L-1和IBA 0.5 mg·L-1,蔗糖20 g·L-1,琼脂6 g·L-1,pH值5.4。在超净工作台上,于解剖镜下剥取带有1~2个叶原基的茎尖接种在以上培养基上,每瓶接种6个茎尖,每个处理接种5瓶,3次重复,共接种90个茎尖。进行暗培养一周后转入光培养,培养温度均为25±2℃,光照培养时光周期为14 h·d-1,光照强度为2 200 lx,以下实验条件均与此相同。2个月后统计成苗率及生长情况。
1.3 激素诱导试验
在超净工作台上,于解剖镜下剥取带有1~2个叶原基的茎尖迅速接种于改良的WPM培养基上,培养基中分别添加0.01、0.05、0.08、0.1 mg·L-1的ZT(反式玉米素),添加0.1、0.5、1.0 mg·L-1的IBA,添加0.1 mg·L-1的GA3。
1.4 茎尖长度试验
分别剥取0.1~0.3、0.3~0.5、0.5~0.7和0.7~1.0 mm的茎尖迅速接种到WPM(改良)培养基上,培养基中分别添加ZT 0.05 mg·L-1、GA30.1 mg·L-1和IBA 0.5 mg·L-1。
1.5 增殖培养试验
将由小茎尖诱导的植株切成1~1.5 cm长的段,转接到增殖培养基上。增殖培养基以WPM(改良)培养基为基本培养基,附加0.1、0.2 mg·L-1的GA3,0.5、1.0、1.5、2.0 mg·L-1的ZT一个月后统计增殖倍数及生长情况。
1.6 生根移栽
选取增殖继代培养2~3次的健壮试管苗在温室中炼苗,3~4 d后成簇取出(带有愈伤组织),用清水冲洗基部,去除培养基。在浓度为500 mg·L-1的IBA中浸泡5 min,用消毒的水苔包裹苗,仅露出1/3~1/4顶部,栽到96孔的小营养钵诱导生根,用透光的塑料薄膜拱棚保温保湿,相对湿度控制在85%左右,温度控制在25℃,诱导生根,40 d调查生根率。移栽基质为草炭∶蛭石(体积比)=2∶1组成的基质。
1.7 数据统计分析
按下列方法统计茎尖离体培养成苗率以及增殖系数:
茎尖成苗率=(茎尖成活数/接种茎尖数)×100%
(1)
丛生芽增殖系数=诱导出丛生芽总数/诱导出丛生芽的外植体数
(2)
2 结果与分析
2.1 培养基种类对茎尖生长的影响
茎尖接种到3种培养基上后,成苗率有显著差异(表1)。接种到MS培养基上的茎尖诱导的苗生长较弱、淡黄。茎尖接种到改良的WPM培养基上比接种在MS以及WPM培养基上生长健壮,茎尖诱导成苗率达到84.5%,因此WPM(改良)培养基为茎尖诱导成苗的最佳培养基。
表1培养基类型对茎尖生长的影响
Table1TheeffectsofdifferentmediumtypesonV.vitis-idaeastemapexgrowth
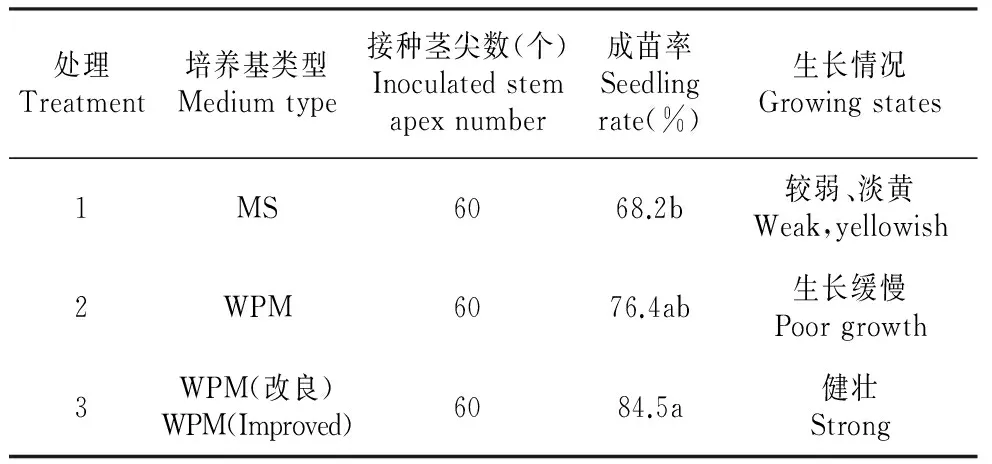
处理Treatment培养基类型Mediumtype接种茎尖数(个)Inoculatedstemapexnumber成苗率Seedlingrate(%)生长情况Growingstates1MS6068.2b较弱、淡黄Weak,yellowish2WPM6076.4ab生长缓慢Poorgrowth3WPM(改良)WPM(Improved)6084.5a健壮Strong
注:同一列不同字母表示在P<0.05水平下差异显著性下同。
Note:The different letters at the same column are significant atP<0.05 level.The same as below.
2.2 激素对越橘茎尖诱导的影响
越橘茎尖接种到培养基后,10 d左右茎尖生长点开始转绿,2个月左右由茎尖诱导的芽长度可达0.8~1.0 cm,但不同培养基诱导茎尖生长情况各异。由表2~3可见,在茎尖诱导过程中,激素配比对茎尖诱导成苗率有显著影响。ZT浓度对茎尖分化有很大影响,随着ZT浓度的增高,茎尖诱导产生的簇状芽数量也随之增多;ZT浓度为0.1 mg·L-1以下时,茎尖诱导产生芽的数量随之减少,茎尖大多为单芽。在茎尖诱导过程中,IBA浓度对茎尖生长也有很大影响,IBA浓度达到1.0 mg·L-1时,茎尖生长受抑制,长势差。处理8能够诱导获得健壮的单芽成苗,成苗率为91.2%。处理13和14虽然成苗率也很高,而且可以诱导簇状芽,但幼芽不健壮。因此以处理8WPM(改良)+ZT 0.05 mg·L-1+IBA 0.5 mg·L-1+GA30.1 mg·L-1为越橘茎尖诱导最佳激素及浓度配比组合。
表2不同激素对越橘茎尖诱导的方差分析
Table2TheANOVAanalysisofdifferenthormoneonV.vitis-idaeastemapexinduced
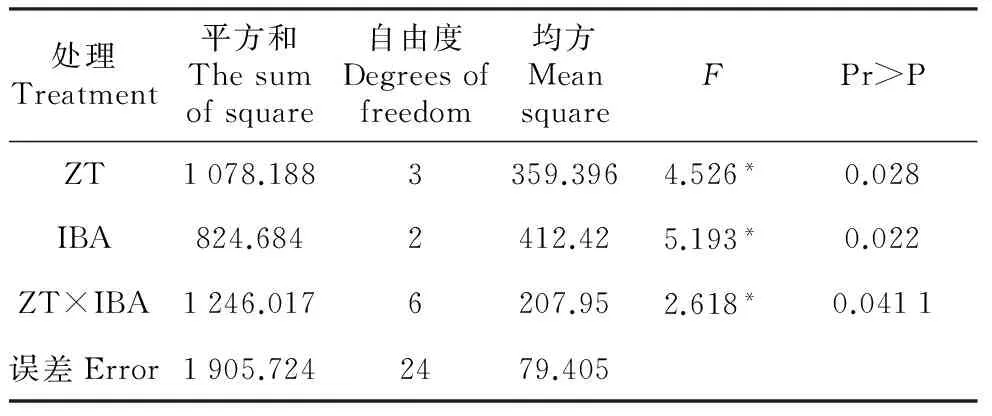
处理Treatment平方和Thesumofsquare自由度Degreesoffreedom均方MeansquareFPr>PZT1078.1883359.3964.526*0.028IBA824.6842412.425.193*0.022ZT×IBA1246.0176207.952.618*0.0411误差Error1905.7242479.405
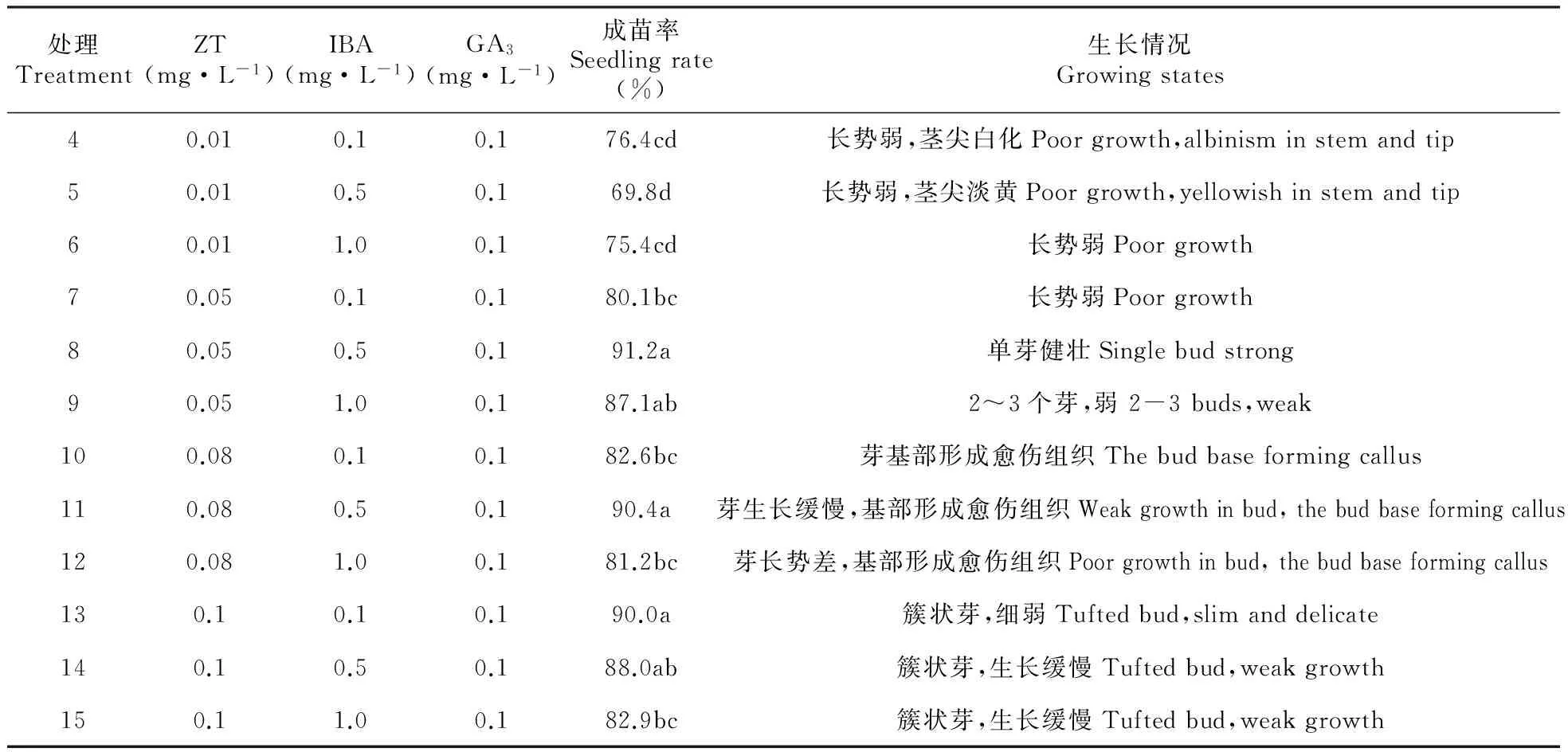
表3 不同激素对越橘茎尖诱导的影响
表4不同长度茎尖诱导分化成苗率
Table4Theseedlingrateofdifferentlengthofstemapexinduction
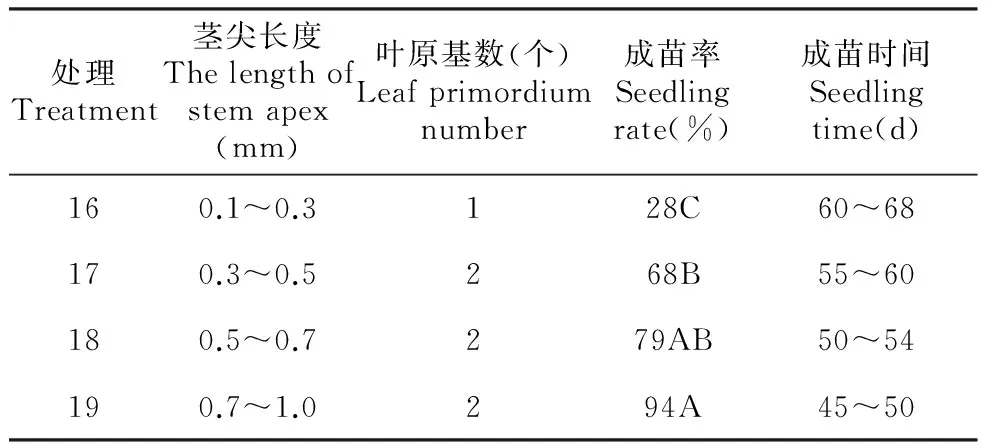
处理Treatment茎尖长度Thelengthofstemapex(mm)叶原基数(个)Leafprimordiumnumber成苗率Seedlingrate(%)成苗时间Seedlingtime(d)160.1~0.3128C60~68170.3~0.5268B55~60180.5~0.7279AB50~54190.7~1.0294A45~50
注:同一列不同字母表示在P<0.01水平下差异显著性。
Note:The different letters at the same column are significant atP<0.01 level.
2.3 茎尖长度对诱导成苗率的影响
由表4可见,茎尖的大小直接影响着诱导成苗率,茎尖越大成苗率越高,成苗时间越短。当越橘茎尖长度为0.1~0.3 mm时茎尖成苗率仅为28%,成苗时间需要60~68 d;茎尖长度达到0.3~0.5 mm时,茎尖成苗率为68%,成苗时间为55~60 d;茎尖长度达到0.5~0.7 mm时,茎尖成苗率为79%,成苗时间为50~54 d;当茎尖长度为0.7~1.0 mm时,茎尖成活率高达94%,成苗时间为45~50 d。
2.4 增殖培养
将越橘茎尖诱导培养的苗转接到增殖培养基上进行培养,一个月调查丛生芽增殖系数及生长情况。由表5可见,不同浓度的ZT和GA3对苗的增殖和高生长有显著影响。在增殖培养过程中,不定芽的增殖系数随着ZT浓度的升高呈先升高而后下降的趋势ZT浓度在0.5~1.5 mg·L-1范围内,ZT浓度为0.5 mg·L-1时,苗的增殖系数最低为2.2,随着ZT浓度升高,苗增殖系数增加;当ZT为2.0 mg·L-1时,苗的增殖降低为3.1倍;GA3浓度对苗的高生长有一定影响,当浓度达到0.1时苗健壮,当浓度达到0.2时越橘生长有抽长现象。综合增殖系数、苗高以及生长情况,处理21WPM(改良)+ZT 1.0 mg·L-1+GA30.1 mg·L-1为最佳增殖培养基,增殖系数为3.8倍,苗高为2.44 cm,生长健壮。
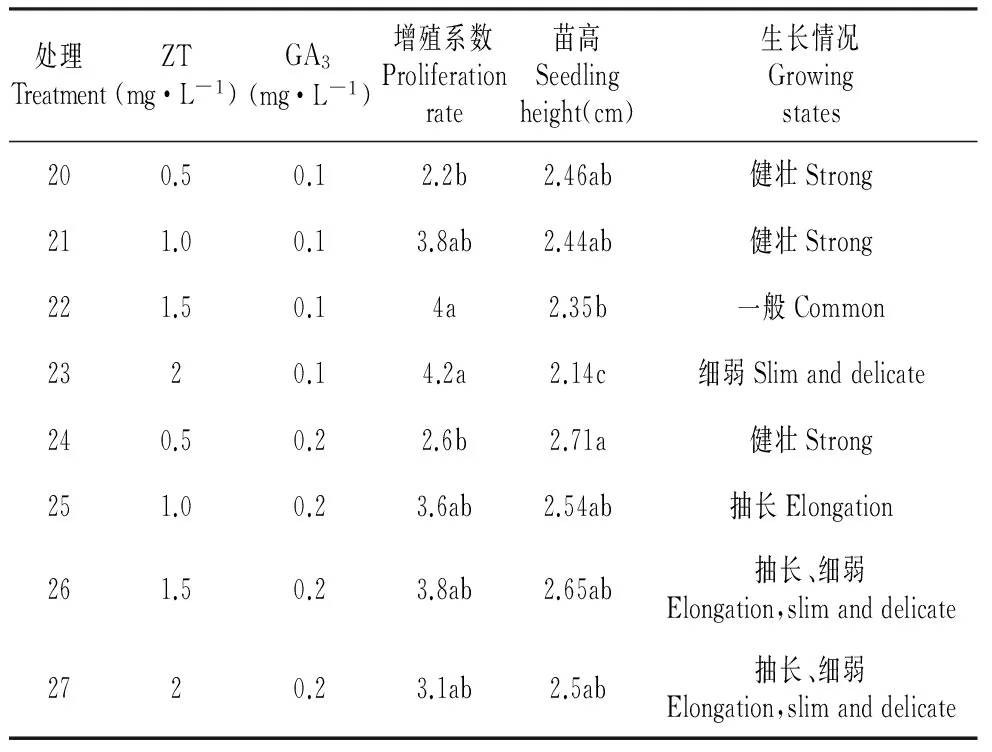
表5 激素对幼苗增殖的影响
2.5 生根与移栽
选取增殖继代培养2~3次的健壮试管苗,温室中炼苗3~4 d后成簇取出(带有愈伤组织),用清水冲洗基部,去除培养基。在浓度为500 mg·L-1的IBA中浸泡5 min,用消毒的水苔包裹苗,仅露出1/3~1/4顶部,栽到96孔的小营养钵诱导生根,用透光的塑料薄膜拱棚保温保湿,相对湿度控制在85%左右,温度控制在25℃,诱导生根,40 d后生根率达76.2%,平均根长1.44 cm。苗木生根后连同水苔一起移栽到草炭∶蛭石(体积比)=2∶1组成的基质中,对湿度控制在65%左右,温度控制在25℃左右,移栽初期适当遮荫,防治阳光直射,以后逐渐增加日照时间和强度,同时注意通风,移栽成活率达85.9%。
3 讨论
植物激素是影响植物的关键因子之一,在组织培养中起重要作用,选择适宜的激素以及激素浓度极其关键[12~13]。Julia Meiners[14]等研究发现ZT对越橘的初始诱导以及增殖培养有主导作用。段祖安[15]等侧芽进入初代培养时,在0.5~2.0 mg·L-1范围内,ZT浓度越高侧芽生长越好。本研究通过对越橘茎尖诱导培养试验发现,ZT浓度低于0.1 mg·L-1有利于茎尖诱导形成单芽,ZT浓度达到0.5 mg·L-1时,有利于组织分化形成丛生芽。越橘茎尖接种在WPM(改良)+ZT 0.05 mg·L-1+IBA 0.5 mg·L-1+GA30.1 mg·L-1的培养基中可诱导产生健壮的芽。增殖培养阶段,ZT浓度在0.5~1.5 mg·L-1范围内,适当地提高其浓度,则有利于提高繁殖系数。当ZT浓度超过1.5 mg·L-1时,增殖系数降低,有效芽数量减少。越橘不同组培阶段所需激素浓度有一定差异,分析产生这种差异的原因,可能与外植体不同有很大因素。
茎尖大小是影响成苗率的重要因素,茎尖越大成苗率越高,相反茎尖越小成苗率越低[16]。进行越橘茎尖培养时,采用0.1~0.3 mm长的茎尖,成苗率28%;采用0.3~0.5 mm长的茎尖,成苗率能达到68%;茎尖长度达到0.5~0.7 mm时,茎尖成苗率为79%;当茎尖长度为0.7~1.0 mm时,茎尖成苗率高达94%。另外,越橘茎尖越小成苗时间越长,茎尖越大成苗时间越短,浦艳吉[13]对欧洲李和樱桃李茎尖的研究中也得到同样的结论。
与其他外植体如茎段、叶片等诱导相比,以微茎尖为外植体进行组织培养,可以减少污染,防止品种退化,由茎尖直接诱导成苗,还能够减少变异。另外,微茎尖培养还是脱毒技术的基础。利用越橘茎尖进行离体诱导、增殖及生根移栽是一套完整的技术,可为今后脱毒研究提供基础。
1.陆春霞,梁贵秋,唐燕梅.马铃薯茎尖脱毒、复壮及病毒检测研究[J].西南师范大学学报:自然科学版,2010,35(1):111-114.
Lu C X,Liang G Q,Tang Y M.Recovery of virus-free potato plant through meristem of apex stem and virus-free detection[J].Journal of Southwest China Normal University:Natural Science Edition,2010,35(1):111-114.
2.谢璇,许轲,谢闽新,等.苹果茎尖培养快繁体系的优化[J].植物生理学报,2015,51(12):2152-2156.
Xie X,Xu K,Xie M X,et al.Optimization of rapid micropropagation system of apple meristem-tip culture[J].Plant Physiology Journal,2015,51(12):2152-2156.
3.尤燕平,彭诗怡,朱文莹,等.茎尖培养法脱除菊花B病毒的研究[J].南京农业大学学报,2013,36(5):144-148.
You Y P,Peng S Y,Zhu W Y,et al.Study on the elimination ofChrysanthemumvirusB by using meristem-tip culture[J].Journal of Nanjing Agricultural University,2013,36(5):144-148.
4.王淼淼,马晓月,张学英,等.苹果抗寒矮化砧木71-3-150茎尖培养快繁体系建立[J].西部林业科学,2014,43(6):44-47.
Wang M M,Ma X Y,Zhang X Y,et al.Study on rapid micropropagation technique of shoot tip culture of cold-resistant apple dwarf rootstock 71-3-150[J].Journal of West China Forestry Science,2014,43(6):44-47.
5.甘专,刘伟,马孟增,等.毛葡萄茎尖的离体培养与植株再生[J].西南农业学报,2013,26(3):1164-1168.
Gan Z,Liu W,Ma M Z,et al.Invitroshoot-tip culture and regeneration ofVitisheyneana[J].Southwest China Journal of Agricultural Sciences,2013,26(3):1164-1168.
6.Lehtonen H M,Lehtinen O,Suomela J P,et al.Flavonol glycosides of sea buckthorn(Hippophaёrhamnoidesssp.sinensis) and lingonberry(Vacciniumvitis-idaea) are bioavailable in humans and monoglucuronidated for excretion[J].Journal of Agricultural and Food Chemistry,2010,58(1):620-627.
7.祖桂芳,赵晓红,崔胜楠.红豆越桔活性成分研究及开发利用[J].生命科学,2009,21(1):151-155.
Zu G F,Zhao X H,Cui S N.Research of active substances aboutVacciniumvitis-idaeaL. and its development and application[J].Chinese Bulletin of Life Sciences,2009,21(1):151-155.
8.Andres-Lacueva C,Shukitt-Hale B,Galli R L,et al.Anthocyanins in aged blueberry-fed rats are found centrally and may enhance memory[J].Nutritional Neuroscience,2005,8(2):111-120.
9.邢瑞丹,刘庆忠,陈新,等.越橘组织培养及基因工程的研究进展[J].安徽农业科学,2009,37(20):9369-9371.
Xing R D,Liu Q Z,Chen X,et al.Research progress on tissue culture and gene engineering of blueberry[J].Journal of Anhui Agricultural Sciences,2009,37(20):9369-9371.
10.金彦磊,王秀华,杨永富,等.越橘离体培养的组织学研究[J].黑龙江八一农垦大学学报,2009,21(1):25-29.
Jin Y L,Wang X H,Yang Y F,et al.Histological studies on morphogenesis ofVacciniumvitis-idaeaculturedinvitro[J].Journal of Heilongjiang August First Land Reclamation University,2009,21(1):25-29.
11.田新华,邢亚娟,张建瑛,等.红豆越橘离体培养关键技术研究[J].森林工程,2015,31(2):57-60.
Tian X H,Xing Y J,Zhang J Y,et al.Study on key techniques ofinvitroculture fromVaccinniumvitis-idaeaL.[J].Forest Engineering,2015,31(2):57-60.
12.Hammatt N.Promotion by phloroglucinol of adventitious root formation in micropropagated shoots of adult wild cherry(PrunusaviumL.)[J].Plant Growth Regulation,1994,14(2):127-132.
13.浦艳吉,李国怀,姚延兴,等.李茎尖离体培养与植株再生[J].华中农业大学学报,2009,28(2):214-217.
Pu Y J,Li G H,Yao Y X,et al.Shoot-tipsinvitroculture and regeneration of plum[J].Journal of Huazhong Agricultural University,2009,28(2):214-217.
14.Meiners J,Melanie S,Szankowski I.Efficient in vitro regeneration systems forVacciniumspecies[J].Plant Cell,Tissue and Organ Culture,2007,89(2-3):169-176.
15.段祖安,李建华,强薇,等.越桔品种‘达柔’离体培养快繁技术体系的研究[J].山农业大学学报:自然科学版,2008,39(4):506-510.
Duan Z A,Li J H,Qiang W,et al.Tudy on system of exbody culture and rapid propagation ofVaccinium‘Darong’[J].Journal of Shandong Agricultural University:Natural Science,2008,39(4):506-510.
16.Manganaris G A,Economou A S,Boubourakas I N,et al.Elimination of PPV and PNRSV through thermotherapy and meristem-tip culture in nectarine[J].Plant Cell Reports,2003,22(3):195-200.

