黄芪种子萌发及萌发后生长过程中黄酮类化合物合成的动态变化
杨 楠 王 曦 郭晓瑞 刘 洋 唐中华 王洪政
(东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040)
膜荚黄芪(Astragalusmembranaceus(Fisch.) Bunge.)及其变种蒙古黄芪(AstragalusmembranaceusBunge var.mongholicus(Bge.) Hsiao)属于豆科(Leguminosae)植物,它们的干燥根是我国重要的中药材,具有提高免疫功能、抗感染、抗氧化以及改善心血管功能等多种生理活性[1~3]。黄芪根中的主要药用成分包括黄酮、皂苷和多糖三大类,其中黄酮主要为芒柄花素、毛蕊异黄酮和毛蕊异黄酮苷等[4]。目前,关于黄芪的资源培育和药用理论方面的研究较多,但是对于其种子萌发生理的研究较为少见。
种子萌发是植物生活史的开始,萌发和萌发后生长的情况直接决定着植物形态建成以及成株的状态[5]。已有研究表明,活性氧,特别是H2O2对植物种子萌发和萌发后生长具有明显的调控作用[6~9]。早在吸胀阶段,种子组织中即出现了明显的H2O2及其它种类活性氧的累积[10]。活性氧的积累可以作为信号物质调控植物的生长发育,但是过高的氧化水平会对植物本身造成了氧化胁迫,引起植物代谢障碍甚至细胞死亡[11~12]。因此,植物需要在萌发和萌发后生长过程中提高其体内的抗氧化能力,以保证植物免于氧化胁迫。
黄酮作为天然的自由基清除剂与抗氧化剂,在植物抗氧化中具有重要作用。在拟南芥、大豆、鹰嘴豆和羽扇豆发芽过程中均发现了黄酮类化合物合成的增加[13~16],暗示着黄酮类化合物可能在植物种子发芽过程中对提高其抗氧化能力做出了一定贡献。本研究以膜荚黄芪和蒙古黄芪为实验材料,通过对比研究它们在不同萌发和萌发后生长时期主要黄酮类活性成分含量以及关键合成酶基因表达的动态变化,以期揭示黄酮类化合物在黄芪萌发和萌发后生长中的生物合成变化规律以及它们可能发挥的作用。
1 材料与方法
1.1 实验材料
膜荚黄芪(Astragalusmembranaceus(Fisch.) Bunge,以下简称A.membranaceus)和蒙古黄芪(AstragalusmembranaceusBunge var.mongholicus(Bge.) Hsiao,以下简称A.membranaceusvar.mongholicus)的种子均购自河北省安国市元泰药用植物种子站。毛蕊异黄酮苷(Calycosin-7-O-β-D-glucoside)、毛蕊异黄酮(Calycosin)和芒柄花素(Formononetin)标准品均购自上海纯优生物科技有限公司。色谱级甲醇、乙腈购于北京百灵威化学有限公司,去离子水(电阻率高于18.2 MΩ·cm-1)取自Milli-Q水纯化系统(Millipore,USA),丙酮(分析纯)购自天津富宇精细化工有限公司,碳酸钙(分析纯)购自天津致远化学试剂有限公司。
1.2 实验方法
1.2.1种子萌发及萌发后生长实验
挑选饱满健康的蒙古黄芪和膜荚黄芪种子,用10%次氯酸钠浸泡15~20分钟后用自来水和蒸馏水分别清洗4次。待种子在蒸馏水中于15℃黑暗环境中吸胀24 h后,将其播撒于铺有3层用蒸馏水浸润滤纸的15 cm培养皿中(150粒/皿)进行发芽。环境条件为光照/黑暗14/10 h,恒温25℃,72%湿度。实验总共进行9天,每天都播种新种子并从不同发芽时间的培养皿中选出具有代表性的种子进行拍照。
1.2.2UPLC-MS黄酮含量测定
在实验第9天,将发芽0~8天的种子或幼苗收获后在液氮中研磨成粉。准确称取1.00 g样品粉末,加入20 mL 80%乙醇超声辅助提取45 min,过滤后残渣再加入20 mL溶剂提取一次,合并两次提取液,在真空条件下浓缩至干。用1 mL色谱级甲醇复溶样品,14 000 r·min-1离心10 min,上清液保存于-20℃备用,样品测定前用0.45 μm的微孔滤膜进行过滤。
色谱条件:超高效液相色谱系统(ACQUITY UPLC system,Waters,USA);色谱柱为ACQUITY UPLC BEH C18Column(1.7 μm,2.1 mm×50 mm);柱温为25℃;进样量为5 μL;流动相由水和乙腈组成,流速保持在0.25 mL·min-1,8%乙腈(0~1 min)→34%乙腈(1~1.5 min)→34%乙腈(1.5~4 min)→60%乙腈(4~6 min)→60%乙腈(6~7 min)→8%乙腈(7~7.5 min)→8%乙腈(7.5~9 min)。
质谱条件:电喷雾离子源喷雾电压为5 500 V,离子源雾化温度为500℃,雾化气压为25 psi,气帘气压为20 psi。毛蕊异黄酮苷:m/z 446.9→284.2,去簇电压104 V,碰撞电压24 V,碰撞室射出电压8 V;毛蕊异黄酮:m/z 285.0→269.9,去簇电压117 V,碰撞电压33 V,碰撞室射出电压17 V;芒柄花素:m/z 269.0→196.2,去簇电压80 V,碰撞电压50 V,碰撞室射出电压17 V。
1.2.3黄酮生物合成关键酶基因的qRT-PCR分析
发芽0~8 d的种子或幼苗RNA的提取按照Trizol试剂盒说明书进行,然后参照反转录试剂盒(TOYOBO,Japan)说明书合成cDNA第一链。qRT-PCR使用SYBR Premix Ex Taq(TaKaRa,Japan),反应体系为25 μL:12.5 μL 2.5×RealMasterMix/20×SYBR solution、2 μL模板cDNA、1 μL正义端引物、1 μL反义端引物以及超纯水8.5 μL。黄酮生物合成关键酶基因PAL(Genbank No.EF567076)、C4H(Genbank No.HQ339960)、CHS(Genbank No.JQ048940)、CHR(Genbank No.HM357239)、CHI(Genbank No.DQ205407)、IFS(Genbank No.JF912329)、I3’H(Genbank No.JQ609280)的特异性引物由Primer premier 5合成获得[17]。此外,在NCBI上只有黄芪黄酮生物合成关键酶基因4CL的部分片段UCGT(Genbank No.KF355973)。通过与其他4CL基因序列相似性比对,使用简并引物获得扩增片段[17]。使用的特异性引物见表1。PCR反应条件:94℃ 30 s;56℃ 30 s;72℃ 30 s;35个循环。基因相对表达量采用2-ΔΔCT方法计算。
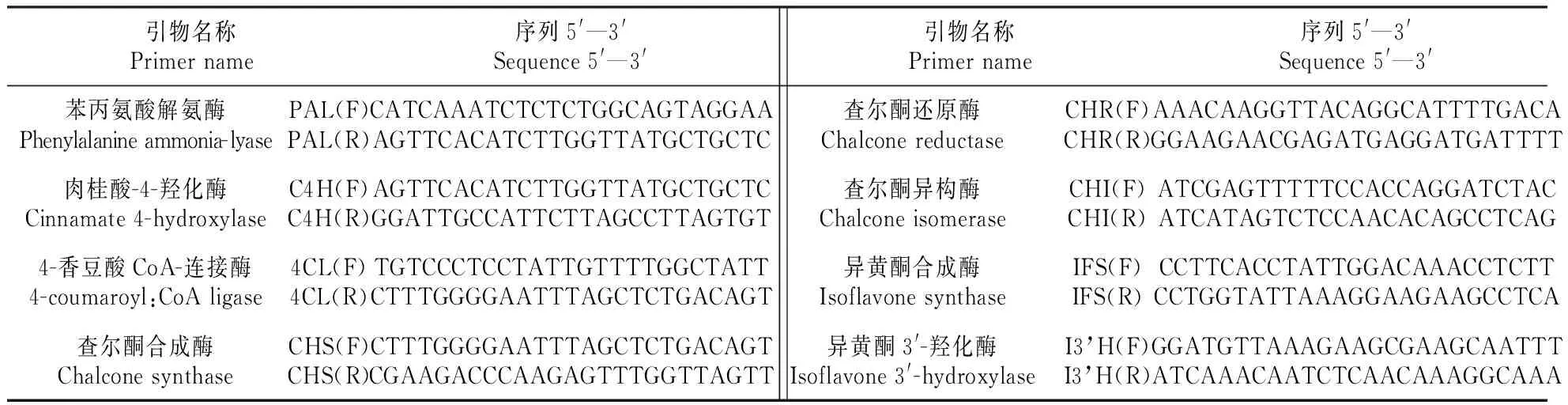
表1 RT-PCR引物设计
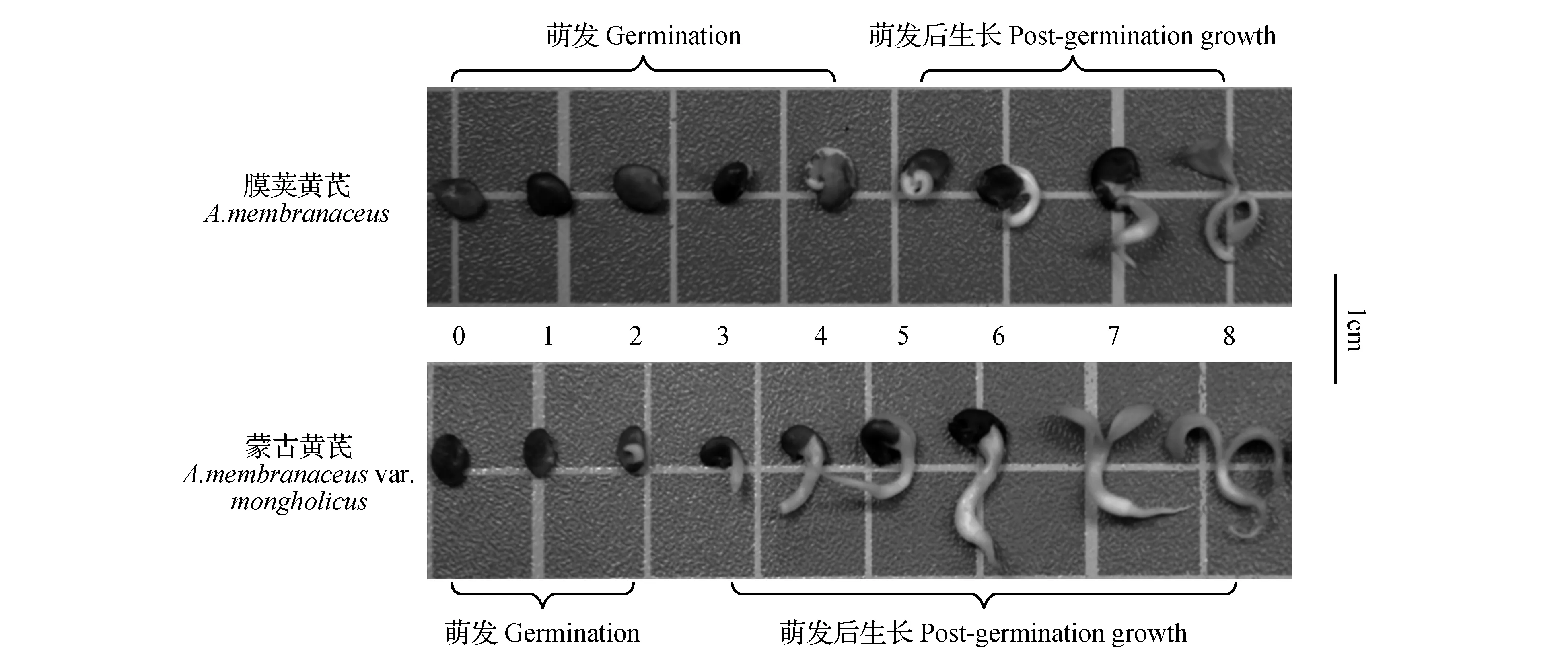
图1 膜荚黄芪与蒙古黄芪萌发及萌发后生长进程Fig.1 The processes of germination and post-germination growth in A.membranaceus and A.membranaceus var. mongholicus
2 结果与分析
2.1 膜荚黄芪与蒙古黄芪萌发及萌发后生长进程
膜荚黄芪和蒙古黄芪在吸胀后0~8 d的形态见图1。蒙古黄芪种子在吸胀后第2天出现了露白,第3天胚根突出种皮,随后胚轴开始伸长,第5天种皮开始破裂,同时子叶变绿,第7天子叶伸开。膜荚黄芪种子萌发要明显晚于蒙古黄芪,第3天开始种子才出现露白,第4天胚根突出种皮,第8天子叶脱离种皮并变绿。根据植物种子发芽的定义,对蒙古黄芪来说,0~2天为萌发阶段,3~8天为萌发后生长阶段;对膜荚黄芪而言,0~4天为萌发阶段,5~8天为萌发后生长阶段。
2.2 膜荚黄芪与蒙古黄芪萌发及萌发后生长过程中主要黄酮类化合物含量的变化
吸胀后,膜荚黄芪和蒙古黄芪种子中毛蕊异黄酮的含量均明显高于毛蕊异黄酮苷和芒柄花素(表2),说明毛蕊异黄酮是它们中最主要的黄酮种类。当两种种子进行比较时,膜荚黄芪中毛蕊异黄酮的含量明显高于蒙古黄芪,而芒柄花素含量则明显低于蒙古黄芪。
表2膜荚黄芪和蒙古黄芪萌发及萌发后生长过程中主要黄酮类化合物含量
Table2Contentvariationofthemajorflavonoidsduringgerminationandpost-germinationgrowthinA.membranaceusandA.membranaceusvar.mongholicus
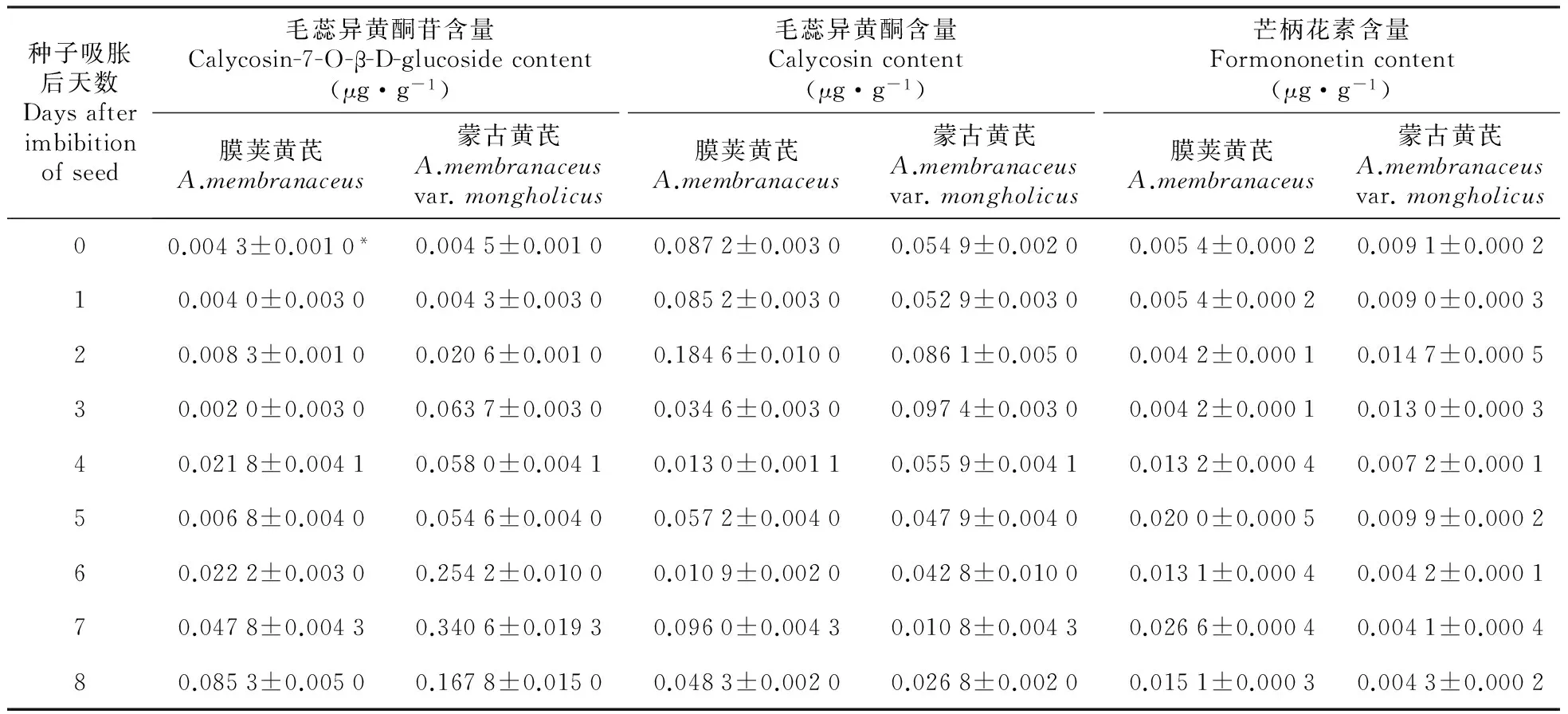
种子吸胀后天数Daysafterimbibitionofseed毛蕊异黄酮苷含量Calycosin-7-O-β-D-glucosidecontent(μg·g-1)毛蕊异黄酮含量Calycosincontent(μg·g-1)芒柄花素含量Formononetincontent(μg·g-1)膜荚黄芪A.membranaceus蒙古黄芪A.membranaceusvar.mongholicus膜荚黄芪A.membranaceus蒙古黄芪A.membranaceusvar.mongholicus膜荚黄芪A.membranaceus蒙古黄芪A.membranaceusvar.mongholicus00.0043±0.0010*0.0045±0.00100.0872±0.00300.0549±0.00200.0054±0.00020.0091±0.000210.0040±0.00300.0043±0.00300.0852±0.00300.0529±0.00300.0054±0.00020.0090±0.000320.0083±0.00100.0206±0.00100.1846±0.01000.0861±0.00500.0042±0.00010.0147±0.000530.0020±0.00300.0637±0.00300.0346±0.00300.0974±0.00300.0042±0.00010.0130±0.000340.0218±0.00410.0580±0.00410.0130±0.00110.0559±0.00410.0132±0.00040.0072±0.000150.0068±0.00400.0546±0.00400.0572±0.00400.0479±0.00400.0200±0.00050.0099±0.000260.0222±0.00300.2542±0.01000.0109±0.00200.0428±0.01000.0131±0.00040.0042±0.000170.0478±0.00430.3406±0.01930.0960±0.00430.0108±0.00430.0266±0.00040.0041±0.000480.0853±0.00500.1678±0.01500.0483±0.00200.0268±0.00200.0151±0.00030.0043±0.0002
注:*采用以干物质为基础的3次测定值的平均值和误差值来表示。
Note:*mean and error values are expressed on a dry matter basis for the three measurements.
随着膜荚黄芪种子萌发的开始,毛蕊异黄酮苷和芒柄花素的含量出现了明显升高,分别比吸胀后升高了407%和144%,而毛蕊异黄酮的含量则出现了显著降低,仅为吸胀后的15%。在蒙古黄芪中,发芽当天3种黄酮含量则都出现了明显升高。
进入萌发后生长过程,膜荚黄芪中毛蕊异黄酮苷的含量出现连续的升高并在第8天达到最高值,毛蕊异黄酮和芒柄花素的含量则出现了震荡性的变化,它们同时在第5和7天出现震荡高峰。在蒙古黄芪中,毛蕊异黄酮苷含量也出现了明显的连续升高,但是它在第7天达到顶点后在第8天出现显著的降低,毛蕊异黄酮和芒柄花素的含量则出现了明显的下降趋势,其中毛蕊异黄酮下降的幅度大于芒柄花素。
此外,从3种黄酮总量来看,吸胀后膜荚黄芪中的含量稍高于蒙古黄芪(图2)。在种子萌发和萌发后生长过程中,黄酮总量在两种黄芪中均出现了双峰式变化。在膜荚黄芪中,黄酮总量分别在第2天和第7天达到峰值,两个峰值大小相近。在蒙古黄芪中,两个峰值则分别出现在第3天和第7天,并且第7天的峰值明显大于第3天。同时,在蒙古黄芪种子萌发阶段,它所含3种黄酮总量低于膜荚黄芪,但是进入萌发后生长过程后,其所含3种黄酮的总量则明显高于膜荚黄芪。
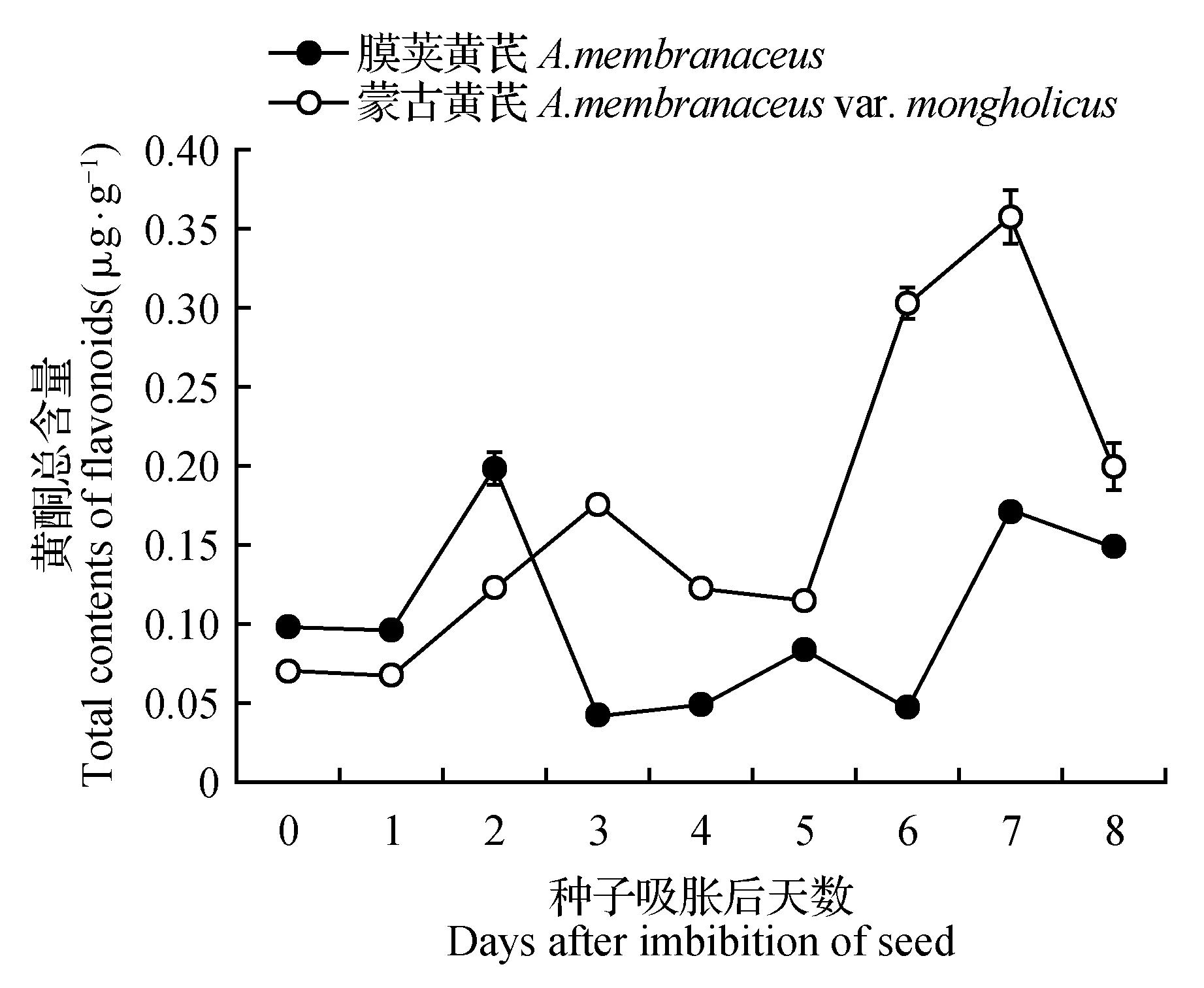
图2 膜荚黄芪与蒙古黄芪萌发及萌发后生长过程中3种主要黄酮总量的变化 所有实验进行了3次重复,误差线代表标准误差。下同。Fig.2 The total contents of the three flavonoids in during germination and post-germination growth in A.membranaceus and A.membranaceus var. mongholicusAll experiments were performed in triplicate, and error bars represent SE.The same as below.
2.3 膜荚黄芪与蒙古黄芪萌发及萌发后生长过程中主要黄酮类化合物生物合成途径酶基因表达情况的变化
膜荚黄芪中,吸胀后种子中PAL、C4H和4CL基因转录水平的表达量明显高于蒙古黄芪,CHS、CHR和IFS的表达量则明显低于蒙古黄芪(图3)。在种子发芽前,膜荚黄芪种子中除C4H外,其它途径酶基因的表达量均在第3天出现了明显的升高,而在发芽当天又都显著降低。在随后的萌发后生长过程中,PAL、C4H、4CL、CHS、CHR和IFS的表达量又比发芽当天小幅升高。此外,膜荚黄芪中我们检测的所有途径酶基因都在第8天达到了最大表达量,分别为吸胀后的2~3倍。
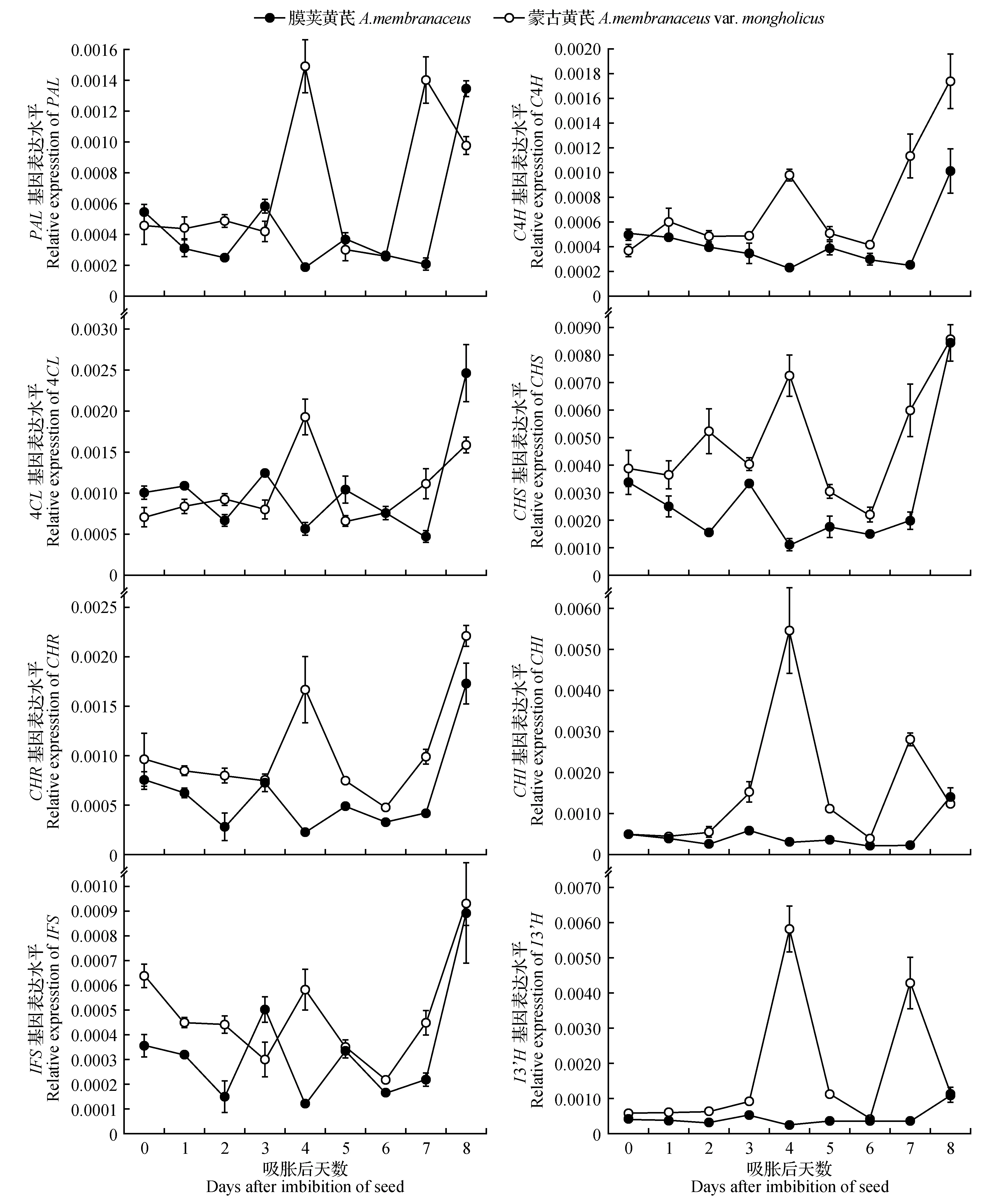
图3 膜荚黄芪与蒙古黄芪萌发及萌发后生长过程中主要黄酮类化合物生物合成途径酶基因表达情况Fig.3 The expression of enzymes in flavonoid synthesis pathway during germination and post-germination growth in A.membranaceus and A.membranaceus var. mongholicus
在蒙古黄芪种子萌发过程中,PAL、4CL、CHR、CHI和I3’H基因表达量都没有出现较大变化,C4H和CHS表达分别在露白和发芽当日出现明显升高,而IFS表达则在露白当日出现了明显降低。萌发后生长过程中,所有途径酶的表达量在第4天都出现了大幅度升高,特别是PAL、CHI和I3’H基因,它们在第4天的表达量分别达到了吸胀后的3.3、11.5和10.4倍。随后,所有途径酶的表达量在第6天下降到等于或低于吸胀后的水平后,C4H、4CL、CHS、CHR和IFS表达量在第7~8天又出现了连续升高,而PAL、CHI和I3’H表达量则在第7天升高后第8天下降。
同时,从整个萌发和萌发后生长阶段来看,蒙古黄芪中主要黄酮合成途径酶基因的表达水平总体高于膜荚黄芪,这种情况在萌发后生长中尤为突出。
3 讨论
植物种子的萌发过程开始于种子吸胀,结束于胚轴突破种皮等周围结构并明显伸出[15]。根据此发芽标准,我们发现吸胀后膜荚黄芪和蒙古黄芪种子的萌发时间分别为4和2天。其中,膜荚黄芪开始萌发的时间与段琦梅等的结果相一致[16],而蒙古黄芪开始萌发的时间则稍长于李景欣等的实验结果,在他们的实验中第1天种子发芽率已经达到了14%[18],这可能与所使用种子的休眠状况不同有关系。除了种皮坚硬引起的黄芪种子休眠外[19],黄芪种子中还存在内源发芽抑制物质,蒙古黄芪种子的水浸液对党参种子的萌发产生了明显的抑制做作用[20]。此外,在早前使用上一年新收蒙古黄芪种子进行萌发的研究中,发现不经去种皮处理的种子在吸胀后第4天才开始萌发[21]。
活性氧与脱落酸和赤霉素一起参与了植物种子萌发的调控。外源H2O2浸种处理后引起了大麦种子内源ABA含量的降低,并且促进了种子的萌发[22]。同时,在种子吸胀阶段,随着种子含水量的逐渐升高,活性氧的含量出现爆发式增长,这对于打破种子休眠、促进种子发芽和萌发后生长以及松弛细胞壁具有重要作用[23~25]。但是,种子内的活性氧必须被控制在一定水平,以免对种子细胞造成伤害,因此种子在萌发过程中需要抗氧化系统来清除多余的活性氧,这对于种子萌发的成功至关重要[26~28]。在我们的实验中,膜荚黄芪和蒙古黄芪种子在萌发过程中3种主要黄酮含量及其总量在吸胀后2天都出现了明显的升高。黄酮类化合物作为高效的天然抗氧化剂已经广为人知,因此推测其含量升高可能在提高种子抗氧化能力上发挥了一定作用。
在植物中,黄酮类化合物的生物合成受多种环境因子的调控,包括光照在内[29~31]。本研究中两种黄芪种子是在光照条件下进行萌发和萌发后生长的,种子萌发后上胚轴和子叶在接受光照后变绿。我们发现膜荚黄芪和蒙古黄芪在各自种子萌发后1天(下胚轴伸出变绿)以及子叶伸出种皮时均出现了较高的黄酮类化合物积累,说明在黄芪种子萌发后生长过程中光照促进了黄酮类化合物的生物合成。
黄芪中的黄酮类化合物来源于苯丙烷类代谢途径。首先,苯丙氨酸经PAL、C4H和4CL依次催化被转化为4-香豆酸-CoA,随后在CHS的催化作用下将苯丙烷类代谢引入到黄酮类化合物的合成方向[32~33]。CHI在黄芪黄酮类化合物生物合成中起到重要作用,因为它催化了查尔酮转化为黄烷酮的反应[33~34]。IFS和I3’H则分别催化了黄芪黄酮类化合物前体物质大豆黄素的合成以及芒柄花素向毛蕊异黄酮的转化。在我们的研究中,蒙古黄芪种子萌发过程中PAL、C4H、4CL和CHS基因转录表达均明显升高,下游基因表达则未出现明显变化甚至有所降低,说明蒙古黄芪萌发中主要通过上调上游途径来增加黄酮类物质的合成。与蒙古黄芪不同,除C4H外,膜荚黄芪中所有途径酶基因的转录表达均在发芽前1天发生了大幅度升高,表明上游和下游途径均参与了膜荚黄芪种子萌发黄酮类物质的积累。此外,在实验第4天蒙古黄芪中所有途径酶基因的表达均出现明显升高,但是同一时间黄酮类物质的积累并没有出现明显增加,直到第6天才出现较大幅度的增加,暗示这一时期途径酶基因转录上调与黄酮类物质合成变化之间似乎存在一定时间的延迟。不过,当第7天蒙古黄芪中毛蕊异黄酮苷和3种黄酮总量得到峰值时,所有途径酶的表达均出现了明显升高,表明不同生长阶段黄酮类化合物的合成与途径酶表达水平之间的时间关系十分复杂。同时,我们发现这种现象也存在于膜荚黄芪中。在第5天,膜荚黄芪中几乎所有途径酶基因表达出现了明显升高,同一时间毛蕊异黄酮、芒柄花素以及3种黄酮总量也都显著增加,但是当第8天途径酶基因表达再次升高时,除毛蕊异黄酮苷外,其它两种黄酮含量均出现下降。
综上所述,膜荚黄芪和蒙古黄芪中种子萌发以及萌发后生长中的光照都诱导了3种主要黄酮类化合物的积累。途径合成酶基因转录表达水平对其含量变化具有重要的调控作用,这种调控作用在两种黄芪萌发过程中存在不同的模式,并且萌发后生长中选择性地存在较为复杂的时间延迟效应。
1.Yao M C,Qi Y,Bi K S,et al.A precolumn derivatization high-performance liquid chromatographic method with improved sensitivity and specificity for the determination of Astragaloside Ⅳ inRadixastragali[J].Journal of Chromatographic Science,2000,38(8):325-328.
2.Lee D Y,Noh H J,Choi J,et al.Anti-inflammatory cycloartane-type saponins ofAstragalusmembranaceus[J].Molecules,2013,18(4):3725-3732.
3.Du H W,Zhao X L,Zhang A H,et al.Rapid separation,identification and analysis ofAstragalusmembranaceusFisch using liquid chromatography-tandem mass spectrometry[J].Journal of Chromatographic Science,2014,52(3):226-231.
4.张冬青,汪德清.黄芪总黄酮生物学活性作用研究进展[J].中国中药杂志,2010,35(2):253-256.
Zhang D Q,Wang D Q.Progressive studies on biological activity of total flavonoids ofAstragalus[J].China Journal of Chinese Materia Medica,2010,35(2):253-256.
5.Zhang H X,Irving L J,Mcgill C,et al.The effects of salinity and osmotic stress on barley germination rate:sodium as an osmotic regulator[J].Annals of Botany,2010,106(6):1027-1035.
6.Ye N H,Zhu G H,Liu Y G,et al.Ascorbic acid and reactive oxygen species are involved in the inhibition of seed germination by abscisic acid in rice seeds[J].Journal of Experimental Botany,2012,63(5):1809-1822.
7.Ishibashi Y,Kasa S,Sakamoto M,et al.A role for reactive oxygen species produced by NADPH oxidases in the embryo and aleurone cells in barley seed germination[J].PLoS One,2015,10(11):e0143173.
9.Bailly C.Active oxygen species and antioxidants in seed biology[J].Seed Science Research,2004,14(2):93-107.
10.Zhang Y,Chen B X,Xu Z J,et al.Involvement of reactive oxygen species in endosperm cap weakening and embryo elongation growth during lettuce seed germination[J].Journal of Experimental Botany,2014,65(12):3189-3200.
11.Gapper C,Dolan L.Control of plant development by reactive oxygen species[J].Plant Physiology,2006,141(2):341-345.
12.Apel K,Hirt H.Reactive oxygen species:metabolism,oxidative stress,and signal transduction[J].Annual Review of Plant Biology,2004,55:373-399.
13.Kubasek W L,Shirley B W,Mckillop A,et al.Regulation of flavonoid biosynthetic genes in germinatingArabidopsisseedlings[J].The Plant Cell,1992,4(10):1229-1236.
15.徐恒恒,黎妮,刘树君,等.种子萌发及其调控的研究进展[J].作物学报,2014,40(7):1141-1156.
Xu H H,Li N,Liu S J,et al.Research progress in seed germination and its control[J].Acta Agronomica Sinica,2014,40(7):1141-1156.
16.段琦梅,梁宗锁,慕小倩,等.黄芪种子萌发特性的研究[J].西北植物学报,2005,25(6):1246-1249.
Duan Q M,Liang Z S,Mu X Q,et al.Germination characteristics ofAstragalusmembranaceusseeds[J].Acta Botanica Boreali-Occidentalia Sinica,2005,25(6):1246-1249.
17.Kim Y B,Thwe A A,Li X H,et al.Accumulation of flavonoids and related gene expressions in different organs ofAstragalusmembranaceusBge[J].Applied Biochemistry and Biotechnology,2014,173(8):2076-2085.
18.李景欣,高春宇,毕晓秀.NaCl胁迫对黄芪种子萌发及幼苗生长的影响[J].内蒙古林业科技,2005,(3):11-14.
Li J X,Gao C Y,Bi X X.Impaction to the NaCl stress in the stage of seed germination and Seedlings ofRadisastragali[J].Inner Mongolia Forestry Science & Technology,2005,(3):11-14.
19.Shibata T,Sakai E,Shimomura K.Effect of rapid freezing and thawing on hard-seed breaking inAstragalusmongholicusBunge(Leguminosae)[J].Journal of Plant Physiology,1995,147(1):127-131.
20.郭凤霞,武志江,陈垣,等.蒙古黄芪种子水浸液对不同种党参种子萌发及幼苗生长的影响[J].中国中药杂志,2012,37(22):3375-3380.
Guo F X,Wu Z J,Chen H,et al.Effect ofAstragalusmembranaceusvar.mongholicusseed extracts on seed germination and seedling growth of differentCodonopsispilosulacaltiver[J].China Journal of Chinese Materia Medica,2012,37(22):3375-3380.
21.张琳,秦雪梅.黄芪种子萌发实验[J].中药材,1994,17(11):9-10.
Zhang L,Qin X M.Germination experiment ofAstragalusmembranaceusseeds[J].Journal of Chinese Medicinal Materials,1994,17(11):9-10.
22.Wang M,Van Der Meulen R M,Visser K,et al.Effects of dormancy-breaking chemicals on ABA levels in barley grain embryos[J].Seed Science Research,1998,8(2):129-137.
23.Liu X J,Xing D,Li L L,et al.Rapid determination of seed vigor based on the level of superoxide generation during early imbibitions[J].Photochemical & Photobiological Sciences,2007,6(7):767-774.
24.Oracz K,El-Maarouf-Bouteau H,Kranner I,et al.The mechanisms involved in seed dormancy alleviation by hydrogen cyanide unravel the role of reactive oxygen species as key factors of cellular signaling during germination[J].Plant Physiology,2009,150(1):494-505.
25.Müller K,Linkies A,Vreeburg R A M,et al.In vivo cell wall loosening by hydroxyl radicals during cress seed germination and elongation growth[J].Plant Physiology,2009,150(4):1855-1865.
26.El-Maarouf-Bouteau H,Bailly C.Oxidative signaling in seed germination and dormancy[J].Plant Signaling & Behavior,2008,3(3):175-182.
27.Tommasi F,Paciolla C,De Pinto M C,et al.A comparative study of glutathione and ascorbate metabolism during germination ofPinuspineaL.seeds[J].Journal of Experimental Botany,2001,52(361):1647-1654.
28.Diaz-Vivancos P,Barba-Espín G,Hernández J A.Elucidating hormonal/ROS networks during seed germination:insights and perspectives[J].Plant Cell Reports,2013,32(10):1491-1502.
29.Kreuzaler F,Ragg H,Fautz E,et al.UV-induction of Chalcone synthase mRNA in cell suspension cultures ofPetroselinumhortense[J].Proceedings of the National Academy of Sciences of the United States of America,1983,80(9):2591-2593.
30.Ryder T B,Hedrick S A,Bell J N,et al.Organization and differential activation of a gene family encoding the plant defense enzyme chalcone synthase inPhaseolusvulgaris[J].Molecular and General Genetic MGG,1987,210(2):219-233.
31.谢灵玲,赵武玲,沈黎明.光照对大豆叶片苯丙氨酸裂解酶(PAL)基因表达及异黄酮合成的调节[J].植物学通报,2000,17(5):443-449.
Xie L L,Zhao W L,Shen L M.Light regulation of the expression ofPALgene in soybean leaves and isoflavone synthesis[J].Chinese Bulletin of Botany,2000,17(5):443-449.
32.欧阳光察,薛应龙.植物苯丙烷类代谢的生理意义及其调控[J].植物生理学通讯,1988,24(3):9-16.
Ouyang G C,Xue Y L.Physiological role and regulation of phenylpropanoid metabolism in plant[J].Plant Physiology Communications,1988,24(3):9-16.
33.Xu R Y,Nan P,Yang Y X,et al.Ultraviolet irradiation induces accumulation of isoflavonoids and transcription of genes of enzymes involved in the calycosin-7-O-β-D-glucoside pathway inAstragalusmembranaceusBge.var.mongholicus(Bge.) Hsiao[J].Physiologia Plantarum,2011,142(3):265-273.
34.李琳玲,程华,许锋,等.植物查尔酮异构酶研究进展[J].生物技术通讯,2008,19(6):935-937.
Li L L,Cheng H,Xu F,et al.Progress of chalcone isomerase in plants[J].Letters in Biotechnology,2008,19(6):935-937.

