白桦BpBEE1基因启动子的表达特性分析
许思佳 颜 斌 董京祥 武丹阳 李慧玉*
(1.东北林业大学林木遗产育种国家重点实验室,哈尔滨 150040; 2.东北林业大学,哈尔滨 150040)
bHLH(basic Helix-Loop-Helix)转录因子是一类在生物界广泛存在的转录因子家族,其通过特定的氨基酸残基与靶基因相互作用,进而调节相关基因的表达[1]。1989年,从小鼠中首次鉴定出bHLH转录因子E12和E47以来,越来越多的bHLH转录因子在线虫、果蝇、小鼠和人类中得到了分离鉴定[2]。随着研究的不断深入,在植物中功能也陆续被揭示。目前,在拟南芥中有162个成员,在水稻中则有167个成员,并且都已被定位到了染色体上[3~4]。研究发现bHLH转录因子在植物的生长发育,花形成和种子的萌发,控制气孔细胞的分化及保卫细胞的形成,生物合成及信号转导等生长阶段都发挥重要的作用[5~12]。对于bHLH的研究多集中在草本植物中,木本植物研究较少。在柽柳中ThbHLH1诱导了抗逆性基因LEAs和HSPs的表达并通过提高土壤的渗透势来提高非生物胁迫的耐受能力[13];低温条件下,苹果中MdbHLH3基因能调控花青素的积累和果实的颜色[14];胡杨PebHLH35基因过表达后通过减少气孔的数量,降低气孔开度,降低蒸腾速率,减少耗水量,提高光合作用来增强耐旱性[15]。
BEE(Brassinolide Enhanced Expression)基因所编码的蛋白质是属于bHLH超家族的一员,是调控油菜素内酯(BR)信号转导的重要元件[16]。在研究BR应答下游基因BRI1复合体时发现了3个基因,它们编码亲缘关系相近的碱性/螺旋—环—螺旋(bHLH)蛋白,于是将这3个基因命名为BEE1,BEE2,BEE3。在拟南芥中发现3个BEE基因是BR信号途径中是早期应答受体,该基因间存在功能冗余,3个基因同时突变的拟南芥表现出植株矮小和开花延迟等现象。除此之外,还发现在拟南芥的幼苗中,bHLH类蛋白BEE和BIM能正调控光响应途径[17]。对BEE基因的功能研究仅限于此。
白桦(Betulaplatyphylla)为我国北方的主要用材树种,也是天然次生林的先锋树种,在天然林更替方面起到了重要作用。本研究以东北白桦(B.platyphylla)为试材,根据白桦基因组序列,克隆获得了BpBEE1基因的启动子,通过启动子组织部位表达、激素及胁迫处理分析其表达特性,为揭示BpBEE1基因的功能提供理论依据。
1 材料与方法
1.1 试验材料
BpBEE1基因启动子克隆材料取自东北林业大学林木遗传育种试验基地10年生已开花结实的白桦,拟南芥为哥伦比亚野生型。DNA提取剂盒和纯化试剂盒购于天根生物技术公司;ExTaq聚合酶、T4连接酶、BamHⅠ内切酶、SmaⅠ内切酶购于宝生物工程(大连)有限公司;农杆菌EHA105和pBI101载体均为本实验室保存。
1.2 实验方法
1.2.1白桦BpBEE1基因启动子的克隆
根据白桦基因组序列,在BpBEE1基因ATG的上游1 750 bp位置设计引物,在上、下游引物的5′端分别引入核酸内切酶酶切位点(BamHⅠ)和(SmaⅠ)构建pBI101-BpBEE1promoter-GUS植物表达载体,引物由上海生工公司合成,上、下游引物序列分别为:5′-CGGGATCCCCCATCATGCTTGCATTTGG-3′(BamHⅠ);5′-ACGCGTCGACCCTGTGAAGCAGCATCATCC-3′(SmaⅠ)。以白桦植物基因组DNA为模板,PCR扩增带有酶切位点的BpBEE1基因的上游启动子片段,反应体系如下:10×KOD Buffer 2 μL,2.5 mmol·L-1dNTPs 2 μL,DNA 模板2 μL,上下游引物各为10 mmol·L-10.6 μL,KOD Plus Neo 0.3 μL,无菌水补足20 μL。PCR扩增程序:94℃预变性4 min;94℃变性45 s,58℃退火45 s,72℃延伸2 min,30个循环;72℃延伸10 min。PCR产物经1.0%琼脂糖凝胶电泳检测,并进行胶回收纯化,回收后用核酸测定仪测其浓度,送公司测序。
1.2.2白桦BpBEE1基因启动子序列分析
采用PLACE[18](http://www.dna.affrc.go.jp/PLACE/)和Plant CARE[19](http://bioinformatics.psb.ugent.be/webtools/plantcare/html)网站上预测启动子序列中所含有的顺式作用元件。
1.2.3pBI101-promBpBEE1启动子植物表达载体的构建
分别对BpBEE1启动子胶回收产物和植物表达载体pBI101质粒进行BamHⅠ和SmaⅠ双酶切。酶切产物经1.0%琼脂糖凝胶电泳检测。使用OMEGA纯化试剂盒对得到的启动子片段和载体的酶切产物进行纯化,纯化后产物用T4DNA连接酶16℃过夜连接,连接反应完成后,通过热击法将连接产物转化到大肠杆菌Trans5α感受态细胞中。PCR检测条带位置正确的阳性克隆送往上海英俊生物公司测序。保存经测序比对正确的重组质粒,通过电击法将构建好的植物表达载体转入农杆菌EHA105中,转化子经PCR验证后保存备用。
1.3 拟南芥的遗传转化
采用农杆菌介导的浸花法进行遗传转化[20]。获得的T0代种子在含有50 μg·μL-1卡那霉素的1/2MS培养基上进行筛选。提取生长3周的抗性植株基因组DNA,以非转基因拟南芥(NT)为阴性对照,同时设阴性水对照,对转基因植株进行PCR扩增,以检测目的基因是否成功导入到植物体内。
1.4 转基因拟南芥的组织化学染色分析
(1)将pBI101-promBpBEE1启动子转基因拟南芥T3代纯合系的种子消毒后,播种于1/2 MS培养基上,分别在播种后1、2、5和8周取材,放置于5 mL试管中进行GUS染色(GUS染液:50 mmol·L-1磷酸钠缓冲液(pH7.0),10 mmol·L-1EDTA·2Na溶液,0.1%Triton X-100,0.5 mmol·L-1亚铁氰化钾,0.5 mmol·L-1铁氰化钾,1 mg·L-1X-Gluc),37℃条件下暗培养过夜,将染色后的拟南芥材料置于脱色液(脱色液∶无水乙醇与冰乙酸以3∶1比例混合)中脱色6~8 h,期间需更换脱色液。待脱色完全后,观察GUS染色情况并照相保存。
(2)将pBI101-promBpBEE1启动子转基因拟南芥T3代纯合系的种子消毒后,播种于1/2 MS培养基上,待播种2周长出2片真叶时,分别进行激素和胁迫处理,处理条件如下:1 mmol·L-1SA、100 μmol·L-1MeJA、100 μmol·L-1IAA、100 μmol·L-1GA3、1 μmol·L-1BZR、1 μmol·L-1BL、20% PEG600、200 μmol·L-1NaCl。分别吸取100 μL的激素、NaCl、PEG600在培养基表面,用涂布棒涂均匀,同时设置涂有100 μL无菌水的培养基作为对照,随后将拟南芥幼苗置于培养基表面,培养24 h后进行GUS染色,观察染色情况并照相保存。
2 结果与分析
2.1 pBI101-promBpBEE1的克隆
以多年生白桦的叶片DNA为模板,根据白桦基因组获得的BpBEE1上游启动子序列设计特异引物,进行PCR扩增,扩增产物于1%琼脂糖凝胶中进行电泳检测,结果显示在1 750 bp处获得特异条带(图1),并与目标条带大小一致,并通过测序进一步确认为目的片段。

图1 BpBEE1启动子的克隆 1. DL2000 Marker(2 000,1 000,750,500,250,100 bp);2. BpBEE1启动子Fig.1 BpBEE1 promoter clone 1. DL2000 Marker(2 000,1 000,750,500,250,100 bp);2. BpBEE1 promoter
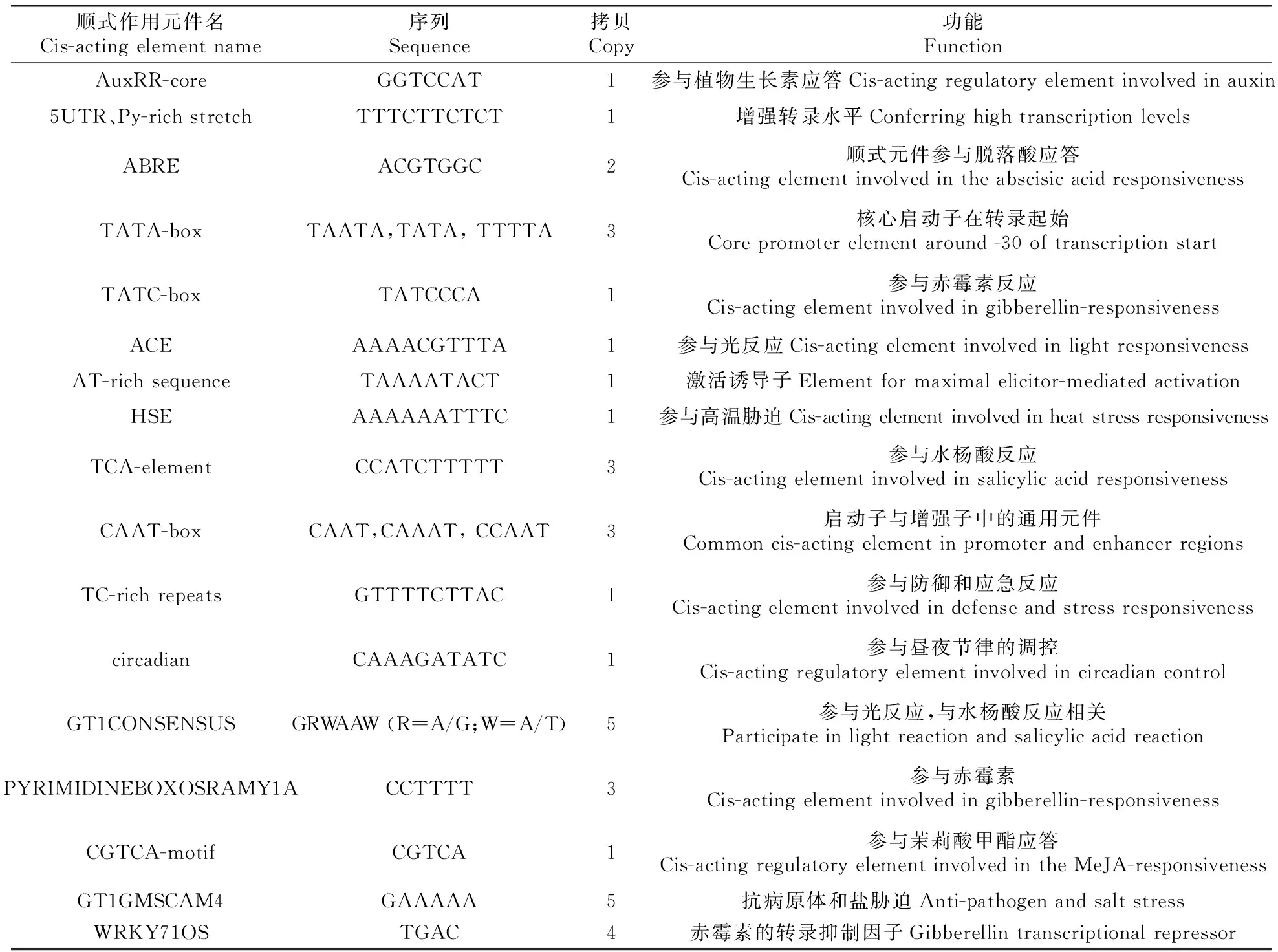
顺式作用元件名Cis-actingelementname序列Sequence拷贝Copy功能FunctionAuxRR-coreGGTCCAT1参与植物生长素应答Cis-actingregulatoryelementinvolvedinauxin5UTR、Py-richstretchTTTCTTCTCT1增强转录水平ConferringhightranscriptionlevelsABREACGTGGC2顺式元件参与脱落酸应答Cis-actingelementinvolvedintheabscisicacidresponsivenessTATA-boxTAATA,TATA,TTTTA3核心启动子在转录起始Corepromoterelementaround-30oftranscriptionstartTATC-boxTATCCCA1参与赤霉素反应Cis-actingelementinvolvedingibberellin-responsivenessACEAAAACGTTTA1参与光反应Cis-actingelementinvolvedinlightresponsivenessAT-richsequenceTAAAATACT1激活诱导子Elementformaximalelicitor-mediatedactivationHSEAAAAAATTTC1参与高温胁迫Cis-actingelementinvolvedinheatstressresponsivenessTCA-elementCCATCTTTTT3参与水杨酸反应Cis-actingelementinvolvedinsalicylicacidresponsivenessCAAT-boxCAAT,CAAAT,CCAAT3启动子与增强子中的通用元件Commoncis-actingelementinpromoterandenhancerregionsTC-richrepeatsGTTTTCTTAC1参与防御和应急反应Cis-actingelementinvolvedindefenseandstressresponsivenesscircadianCAAAGATATC1参与昼夜节律的调控Cis-actingregulatoryelementinvolvedincircadiancontrolGT1CONSENSUSGRWAAW(R=A/G;W=A/T)5参与光反应,与水杨酸反应相关ParticipateinlightreactionandsalicylicacidreactionPYRIMIDINEBOXOSRAMY1ACCTTTT3参与赤霉素Cis-actingelementinvolvedingibberellin-responsivenessCGTCA-motifCGTCA1参与茉莉酸甲酯应答Cis-actingregulatoryelementinvolvedintheMeJA-responsivenessGT1GMSCAM4GAAAAA5抗病原体和盐胁迫Anti-pathogenandsaltstressWRKY71OSTGAC4赤霉素的转录抑制因子Gibberellintranscriptionalrepressor
2.2 BpBEE1启动子序列元件分析
利用PLACE和Plant CARE数据库对BpBEE1基因启动子进行元件预测分析(图2和表1),发现该序列上除了含有启动子的基本转录元件TATA-box和CAAT-box外,还含有多个与激素相关的元件,其中与水杨酸应答有关的元件有GT1CONSENSUST和TCA-element,位点分别有5个和3个;赤霉素应答相关的元件有WRKY71OS、PYRIMIDINEBOXOSRAMY1A和TATC-box、位点分别有4个、3个和1个;2个脱落酸应答元件ABRE;1个植物生长素应答有关的元件AuxRR-core;1个茉莉酸甲酯应答元件CGTCA-motif,1个高温胁迫元件HSE,1个抗病原体和盐胁迫的元件GT1GMSCAM,多个光响应元件等。由此可以推测该基因可能参与到了白桦的激素应答,高温胁迫响应,光响应等生物学过程中。
2.3 pBI101-promBpBEE1-GUS载体构建
以测序确定正确的PCR产物为模板进行PCR扩增,通过酶切、连接构建载体pBI101-promBpBEE1-GUS,分别以pro-BpBEE1-F和pro-BpBEE1-R为引物进行菌液PCR检测,结果显示在1 750 bp处获得特异条带,并与目标条带大小一致(图3A)。
为了确认pBI101-promBpBEE1载体序列是否正确,对重组的pBI101的插入片段进行测序,经序列比对发现测序结果与BpBEE1基因启动子的DNA序列完全相同,表明此植物表达载体已经构建成功。将构建成功的pBI101-promBpBEE1载体质粒转化入根癌农杆菌EHAl05内,PCR检测无误后(图3B),向菌液中加入等体积的50%无菌甘油并保存于-80℃冰箱,用于后续的拟南芥转化。
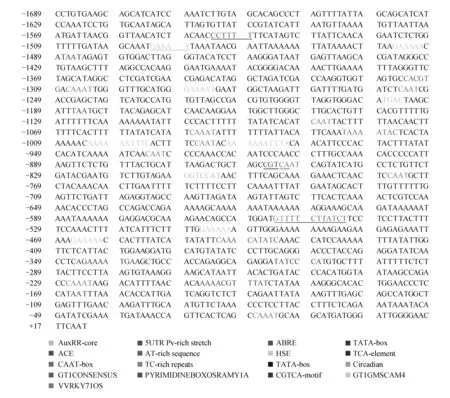
图2 BpBEE1启动子作用元件示意图Fig.2 BpBEE1 promoter action element diagram
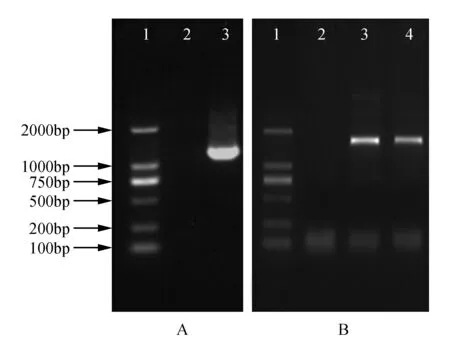
图3 构建BpBEE1启动子载体过程PCR检测 A.重组载体质粒的检测:1. DL2000 Maker;2.水对照; 3~4.重组载体质粒 B.工程菌PCR检测:1. DL2000 Maker;2.水对照;3~4.农杆菌样品Fig.3 Construction of BpBEE1 promoter vector for PCR detection A. Detection of recombinant vector: 1. DL2000 Maker; 2. Water control; 3-4. Recombinant vector plasmid B. Detection of engineering bacteria PCR: 1. DL2000 Maker; 2. Water control; 3-4. Agrobacterium samples
2.4 转pBI101-promBpBEE1启动子拟南芥的分子检测
以转基因拟南芥的叶片为模板提取植物总DNA,进行PCR扩增,扩增产物于1%琼脂糖凝胶中进行电泳检测,结果显示在1 750 bp处获得特异条带,并与目标条带大小一致(图4),说明BpBEE1启动子已转入拟南芥中。
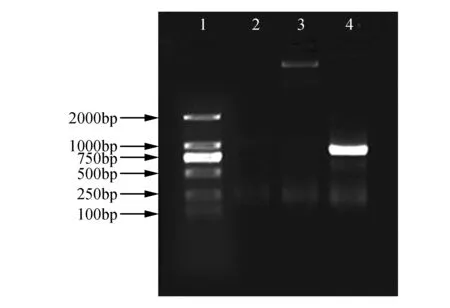
图4 转BpBEE1启动子拟南芥PCR检测 1. DL2000 Marker;2.水对照;3.WT;4.试样Fig.4 BpBEE1 gene promoter transgenic Arabidopsis PCR detection 1. DL2000 Marker; 2. Water control; 3. WT; 4. Sample
2.5 转pBI101-promBpBEE1启动子拟南芥的组织化学染色分析
将不同生长时期的拟南芥组织分别GUS染色,从图中可以看到,在拟南芥幼苗生长至2片子叶(1周)时,转基因幼苗没有被GUS染成蓝色(图5A);当拟南芥幼苗出现2片真叶(2周)时,真叶的叶柄和叶脉位置被染成蓝色,其他部位没有着色(图5B);当拟南芥生长至开花(5周)时,叶脉、茎、主根分别呈现蓝色和浅蓝色(图5:C~F),花未着色(图5E);当拟南芥生长结果夹(8周)时,果夹和茎没有被明显染成蓝色(图5:G~H),而叶脉和主根的部分被GUS染成蓝色(图5:I~J)。
2.6 不同激素对于转基因拟南芥GUS染色的影响
我们对生长2周的转基因拟南芥分别进行激素及胁迫处理发现,转基因拟南芥在不同激素处理之后GUS的活性有一定的变化。MeJA、SA、BL和ABA处理后GUS活性增强,其中MeJA、SA、BL处理后的GUS染色最深,ABA次之;IAA、BZR、GA3、NaCl和PEG处理后的GUS酶活性无明显变化(图6)。
3 讨论
植物bHLH转录因子广泛地参与了植物的生长发育过程。拟南芥bHLH家族复合物LHW(LONESOME HIGHWAY)和TMO5(TARGET OF MONOPTEROS5)能够与植物激素的信号分子相结合从而调控维管的早期发育[21];转AtbHLH129基因的过表达拟南芥株系呈现根伸长的现象[22];拟南芥AtGL2基因能结合bHLH家族中与根毛发育相关的基因RHD6,RSL1,RSL2,LRL1及LRL2的上游区域,从而抑制这些基因的表达[23]。通过对转promoter-BEE1拟南芥进行组织部位染色发现,在叶脉、根部以及茎部GUS活性增强,说明白桦BpBEE1基因可能参与这些组织部位的发育。
通过对BpBEE1启动子顺式作用元件分析预测得知,BpBEE1启动子序列除了含有启动子的核心元件外,还含有一些激素响应元件。JA是植物生长发育过程中必不可少的植物激素,并能诱导次生代谢产物的生物合成而bHLH类等转录因子能够影响JA的合成从而调控次生代谢产物的积累。研究发现bHLH类基因JAMYC2、JAMYC10能够对茉莉酸信号做出响应,在植物茉莉酸信号转导途径中起到重要的调控作用;苹果中的MdMYC2基因与拟南芥的MYC2基因具有很高的同源性,MdMYC2结合AtJAZ3基因(JA信号转导的抑制蛋白)的G-Box来调节对MeJA的敏感程度[24];BpBEE1启动子序列含有JA应答元件CGTCA-motif,我们对转BpBEE1启动子的拟南芥进行MeJA处理后发现,GUS的活性明显提高,说明BpBEE1参与JA应答过程。在拟南芥中AtbHLH129过表达后会通过抑制ABA合成相关基因ABI1,SnRK2.2,SnRK2.3及SnRK2.6的表达来负调控ABA的响应[22];在苦荞中FtbHLH3基因能提高转基因拟南芥的耐旱性,并发现在胁迫株系中ABA生物合成基因AtNCED的表达明显增强,BpBEE1启动子序列含有2个ABA应答元件ABRE,并且ABA处理后,转BpBEE1启动子的拟南芥GUS的活性提高[25]。前人研究发现,BEE是BR的早期应答基因[17],而BL是BR的主要成分,本实验也证实经BL处理后转基因拟南芥的GUS活性明显增强。因此,BEE基因可能通过激素信号影响植物的生长发育。除此之外,本文将进一步对该基因的功能进行深入研究,为揭示白桦BpBEE1基因的功能提供理论基础。
1.刘晓月,王文生,傅彬英.植物bHLH转录因子家族的功能研究进展[J].生物技术进展,2011,01(6):391-397.
Liu X Y,Wang W S,Fu B Y.Research Progress of Plant bHLH Transcription Factor Family[J].Current Biotechnology,2011,01(6):391-397.
2.Murre C,Mccaw P S,Baltimore D.A new DNA binding and dimerization motif in immunoglobulin enhancer binding,daughterless,MyoD,and myc proteins[J].Cell,1989,56(5):777-783.
3.Li X,Duan X,Jiang H,et al.Genome-Wide Analysis of Basic/Helix-Loop-Helix Transcription Factor Family in Rice andArabidopsis[J].Plant Physiology,2006,141(4):1167-1184.
4.Toledoortiz G,Huq E,Quail P H.TheArabidopsisbasic/helix-loop-helix transcription factor family.[J].Plant Cell,2003,15(8):1749-1770.
5.Heisler M G,Atkinson A,Bylstra Y H,et al.SPATULA,a gene that controls development of carpel margin tissues inArabidopsis,encodes a bHLH protein.[J].Development,2001,128(7):1089.
6.Penfield S,Josse E M,Kannangara R,et al.Cold and Light Control Seed Germination through the bHLH Transcription Factor SPATULA[J].Current Biology,2005,15(22):1998-2006.
7.Macalister C A,Ohashiito K,Bergmann D C.Transcription factor control of asymmetric cell divisions that establish the stomatal lineage[J].Nature,2007,445(7127):537-540.
8.Rajnish Khanna,Yu Shen,Colleen M M,et al.The basic helix-loop-helix transcription factor PIF5 acts on ethylene biosynthesis and phytochrome signaling by distinct mechanisms[J].Plant Cell,2007,19(12):3915-3929.
9.Kim D H,Yamaguchi S,Lim S,et al.SOMNUS,a CCCH-type zinc finger protein inArabidopsis,negatively regulates light-dependent seed germination downstream of PIL5.[J].Plant Cell,2008,20(5):1260.
10.Gonzalez A,Zhao M,Leavitt J A.Regulation of the anthocyanin biosynthetic pathway by the TTG1/bHLH/Myb transcriptional complex inArabidopsisseedlings[J].Plant Journal,2008,53(5):814-827.
11.Niwa Y,Yamashino T,Mizuno T.The circadian clock regulates the photoperiodic response of hypocotyl elongation through a coincidence mechanism inArabidopsisthaliana[J].Plant & Cell Physiology,2009,50(4):838.
12.Xu J,Yang C,Yuan Z,et al.The ABORTED MICROSPORES regulatory network is required for postmeiotic male reproductive development inArabidopsisthaliana[J].Plant Cell,2010,22(1):91-107.
13.Ji X,Nie X,Liu Y,et al.AbHLHgene from Tamarix hispida improves abiotic stress tolerance by enhancing osmotic potential and decreasing reactive oxygen species accumulation[J].Tree Physiol,2016,36(2):193-207.
14.Xie X B,Li S,Zhang R F,et al.The bHLH transcription factor MdbHLH3 promotes anthocyanin accumulation and fruit colouration in response to low temperature in apples[J].Plant Cell,2012,35(11):1884-1897.
15.Dong Y,Wang C,Han X,et al.A novel bHLH transcription factor PebHLH35 fromPopuluseuphraticaconfers drought tolerance through regulating stomatal development,photosynthesis and growth inArabidopsis[J].Biochemical and Biophysical Research Communications,2014,450(1)453-458.
16.任鸿雁,王莉,马青秀,等.油菜素内酯生物合成途径的研究进展[J].植物学报,2015,50(6):768-778.
Ren H Y,Wang L,Ma Q X,et al.Advances in biosynthesis of brassinolide[J].Chinese Bulletin of Botany,2015,50(6):768-778.
17.Friedrichsen D M,Nemhauser J,Muramitsu T,et al.Three redundant brassinosteroid early response genes encode putative bHLH transcription factors required for normal growth[J].Genetics,2002,162(3):1445-1456.
18.Higo K,Ugawa Y,Iwamoto M,et al.Plant cis-acting regulatory DNA elements(PLACE) database[J].Nucleic Acids Res,1999,27(1):297-300.
19.Lescot M,Déhais P,Thijs G,et al.PlantCARE,a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences[J].Nucleic Acids Research,2002,30(1):325.
20.Bechtold N,Ellis J,Pelletier G.In planta Agrobacterium mediated genetransfer by infiltration of adultArabidopsisthalianaplants[J].Life Sciences,1993,316:1192-1199.
21.Ohashi-Ito K,Fukuda H.Functional mechanism of bHLH complexes during early vascular development[J].Current Opinion in Plant Biology,2016,33:42-47.
22.Tian H,Guo H,Dai X,et al.An ABA down-regulated bHLH transcription repressor gene,bHLH129 regulates root elongation and ABA response when overexpressed inArabidopsis[J].Scientific Reports,2015,5(17587):17587.
23.Lin Q,Ohashi Y,Kato M,et al.GLABRA2 Directly Suppresses Basic Helix-Loop-Helix Transcription Factor Genes with Diverse Functions in Root Hair Development[J].Plant Cell,2015,27(10):2894.
24.Niu Y,Figueroa P,Browse J.Characterization of JAZ-interacting bHLH transcription factors that regulate jasmonate responses inArabidopsis[J].Journal of Experimental Botany,2011,62(6):2143.
25.Yao P F,Li C L,Zhao X R,et al.Overexpression of a Tartary Buckwheat Gene,FtbHLH3,Enhances Drought/Oxidative Stress Tolerance in TransgenicArabidopsis[J].Frontiers in Plant Science,2017,8.

