黄独微型块茎低温离体保存的GC/MS代谢组学分析
尹明华 邓红根 蒋 妍 万 琳 吴丽霞 凌 飞 汪金华
(上饶师范学院生命科学学院,上饶 334001)
薯蓣属(DioscoreaL.)为单子叶植物纲、薯蓣科(Dioscoreaceae)中最大的一个属。我国薯蓣属植物分为6个组,即根状茎组、丁字形毛组、顶生翅组、基生翅组、复叶组、周生翅组。黄独(D.bulbiferaL.)属于基生翅组,其地下块茎黄药子,含有diosbulbin A-H 8种黄独素,还含有黄酮类、蒽醌类、鞣质及糖类、淀粉等,具有凉血,降火,消瘿,解毒等功效,主治甲状腺肿大、咽喉肿痛、咯血、百日咳等病,也可用于多种癌症的治疗[1]。由于黄独野生种质资源的过度开采和使用,其产量已逐年萎缩,且多采用营养繁殖的方法进行栽培,病毒感染严重,品质也在不断退化。因此,对黄独种质资源实施有效保存已迫在眉睫。离体保存技术克服了传统种植保存占用土地、易受病虫害和自然灾害的影响、管理费用高等缺点,具有占用空间小、可排除病虫和病毒等的侵染、生产上需要即可快速地大量繁殖、费用低廉等优点,目前受到广泛的关注和重视[2]。离体保存主要有超低温和低温二种方式。超低温保存是将材料贮存在液氮中,是一种比较稳妥的长期保存种质的方法;而低温保存则是通过降低温度,抑制植物材料的生长,从而延长其继代时间,与超低温保存比起来,具有简单方便、操作容易,适合用于植物种质资源的中短期保存[3]。
微型块茎又称零余子,是薯蓣属植物腋芽形成的变态块茎,也俗称“珠芽”,具有体积小,便于储存和运输等优点,常作为大田种植的繁殖材料,尤其是利用脱毒苗获得的脱毒微型块茎更是优质种苗的重要来源[4]。目前,对薯蓣属植物微型块茎的诱导[5~11]、休眠和萌发[12]多有报道,但关于薯蓣属微型块茎的低温保存研究极少,在国内,韦本辉等[13]对淮山微型块茎的低温保存进行了研究;在国外,Ovono等[14]对山药(Dioscoreacayenensis-D.rotundatacomplex)的微型块茎进行了低温(18℃)保存,指出其微型块茎在18℃下低温保存2~4周后需要24周以上的时间才能萌发。我们对黄独微型块茎的低温保存进行了前期研究,对其低温保存期间的解剖结构、生理生化指标进行了检测[15],但植物低温胁迫下会产生自身免疫应答反应,代谢物在这种免疫反应中扮演着非常重要的角色。代谢产物的水平可以被看作生物系统对遗传或环境变化的最终响应,有利于更直观有效地了解生物学过程及其机理[16]。代谢组学是研究生物体或者组织甚至单个细胞的全部小分子代谢物成分及其随时间变化而变化的学科[17]。在众多代谢组学分析技术中,气相色谱—质谱联用(GC-MS)技术较为成熟,分辨率高、灵敏度高、重现性好,拥有大量标准质谱图数据库且成本相对低廉,很早就应用到植物代谢组学研究领域,迄今仍然是主要分析平台之一[18]。目前,低温对模式植物拟南芥代谢的影响研究较深入。Cook等[19]使用GC-TOF/MS大规模研究拟南芥冷害的代谢应答途径,结果表明冷驯化与代谢组密切相关。在黄独微型块茎的低温保存过程中,其代谢产物的水平有何变化尚未见相关报道。本文以黄独微型块茎为研究对象,基于GC-MS的代谢组学方法,结合统计学与生物信息学分析手段,对其低温保存的代谢组学进行分析,旨在为黄独微型块茎的低温离体保存以及其后续萌发提供理论依据。
1 材料和方法
1.1 材料和仪器
黄独微型块茎(上饶师范学院生命科学学院植物组织培养室提供)。
1.2 方法
1.2.1微型块茎的诱导及其低温离体保存
利用黄独试管苗的带芽茎段,接种到MS+KT 2 mg·L-1+NAA 0.5 mg·L-1+蔗糖60 g·L-1的液体培养基中,使其诱导出微型块茎,然后挑选出直径约0.5 cm的微型块茎转移到无菌100 mL三角瓶(空瓶)中,然后进行4℃低温离体保存。试验材料分成4℃处理组(以Con4表示)和25℃对照组(以Con25表示),保存60 d后进行GC-MS代谢组学检测。
1.2.2低温离体保存微型块茎的代谢组学检测
把以上两组试验样品100 mg在液氮中磨碎,并转移到10 mL离心管,加入1 400 μL 100%的甲醇(预冷至-20℃),然后涡旋振荡30 s,60 μL的核糖醇(0.2 mg·mL-1)作为内标,涡旋振荡30 s,放入超声波清洗机处理15 min,加入750 μL氯仿与1 400 μL水震荡混合混匀,4 000 r·min-1离心15 min,上清转移到一个新的离心管,样品用氮气吹干,加入60 μL甲氧基吡啶溶液(15 mg·mL-1)涡旋振荡30 s,过夜反应16 h。最后,加入60 μL BSTFA试剂(含1%三甲基氯硅烷),常温条件下反应60 min。经过以上的反应,为次生代谢物含量的样品进行了测定,使用检测设备为Agilent 7890A/5975C 气—质联用仪(安捷伦,美国)。GC/MS检测程序:色谱条件:色谱柱HP-5MS毛细管柱(5% phenyl methyl silox:30 m×250 μm i.d.,0.25 μm;agilent J&W scientific,Folsom,CA);分流进样,进样量1 μL,分流比20∶1。进样口温度280℃;离子源温度250℃;接口温度150℃。程序升温起始温度40℃;保持5 min,以10℃·min-1升至300℃,保持5 min。载气为氦气,流速1 mL·min-1。MS条件:电喷雾电离(ESI)源,全扫描方式,电子能量70eV;四极杆扫描范围m/z 35-780。
1.2.3数据处理和分析
利用GC-MS预处理软件XCMS(www.bioconductor.org/)对Agilent 7890A/5975C气质联用仪检测获得的原始文件进行数据预处理。首先从Agilent MSD ChemStation工作站获得的原始的GC/MS数据转换成CDF格式(Net CDF)。然后利用XCMS程序进行峰识别、峰过滤、峰对齐等工作,逐一考察及优化了各个参数,并通过手动提取任意质量色谱峰来验证结果的准确性,最终确定了XCMS的各个参数。除了XCMS默认的参数以外进行了如下的调整:xcmsSet(fwhm=3,snthresh=3,mzdiff=0.5,step=0.1,steps=2,ma=300),retcor(method=“obiwarp”,plottype=c(“deviation”)),bandwidth(bw)为2,minfrac=0.3。为了分析多元线性回归,XCMS的最终结果导出至EXCLE进行进一步的分析。对原始数据进行归一化处理,方法是内标法(ribitol))。对样本进行信息比对分析,并对得到数据进行生物信息学分析,分析包括:数据预处理,化合物鉴定,主成分分析(PCA分析),偏最小二乘法—判别分析(PLS-DA分析),差异化合物筛选。
2 结果与分析
2.1 代谢物注释
对上述获得的保留时间、质核比及峰强的矩阵(共213个变量)进行代谢物的注释,注释所用数据库为NIST商业数据库(NIST 2008)和wiley 9代谢组数据库。最终获得90个可以被数据库注释的变量。大量的物质由于信号低或者没有数据库收录而没有被注释到。
2.2 所有样本主成分分析(PCA)
首先对所有样本进行主成分分析。在Simca-P 11.0软件中,数据采用Par变换,首先进行主成分分析(Principal Component Analysis,PCA)进行无监督的数据分析,观察各族数据的聚类并去除离群样本。结果表明,R2X为0.598,Q2为-0.004 5,由此可以推断模型质量较好,拟合处理能够有效的找出样品分类的最大差异,适合做后续分析。两组PCA得分图(Scores plot)如图1所示,样本基本都处于95%置信区间(Hotelling T2 ellipse)内。
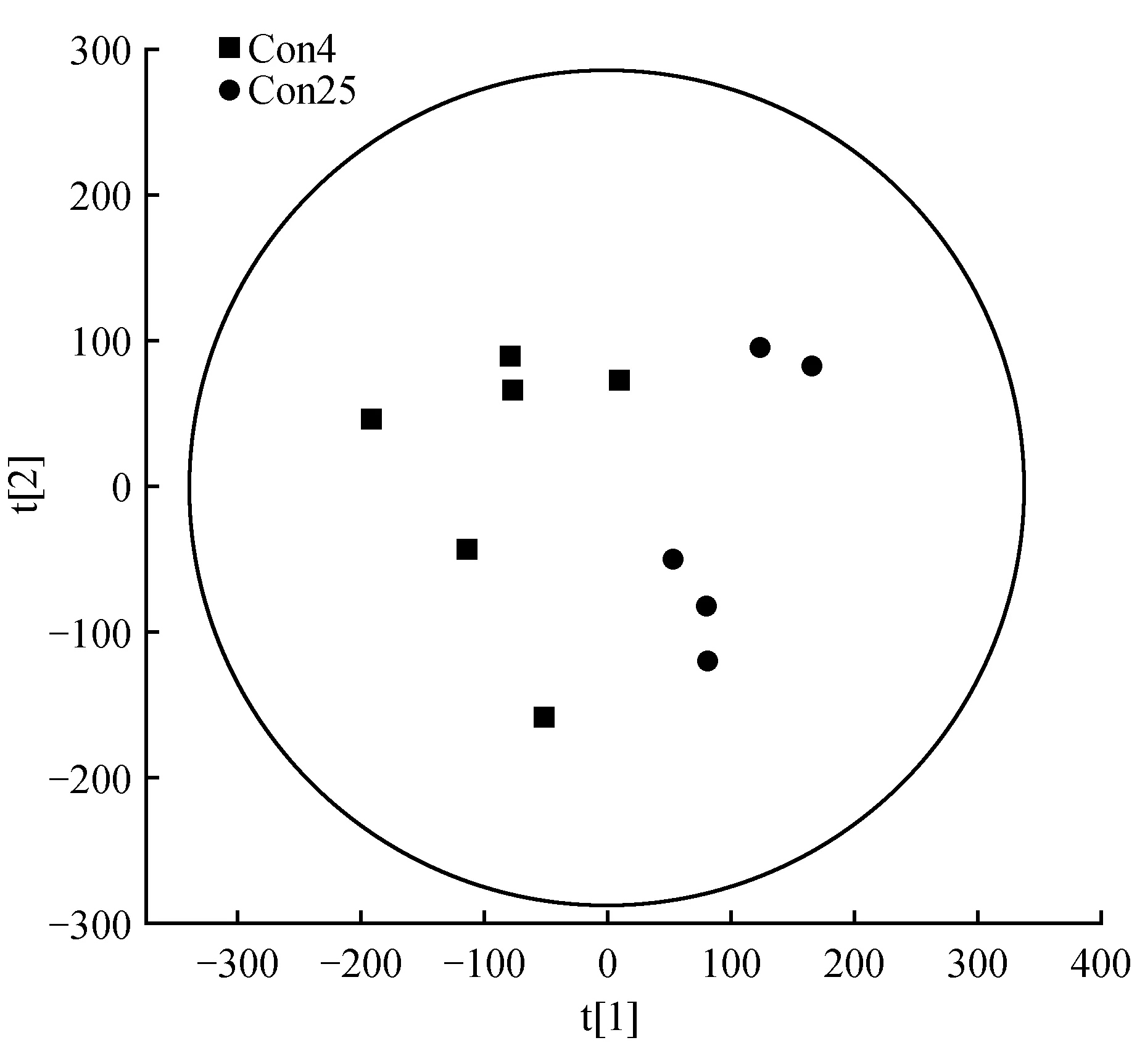
图1 处理组和对照组PCA得分图Fig.1 PCA score chart of treatment group and control group
2.3 所有样本偏最小二乘方—判别分析(PLS-DA)
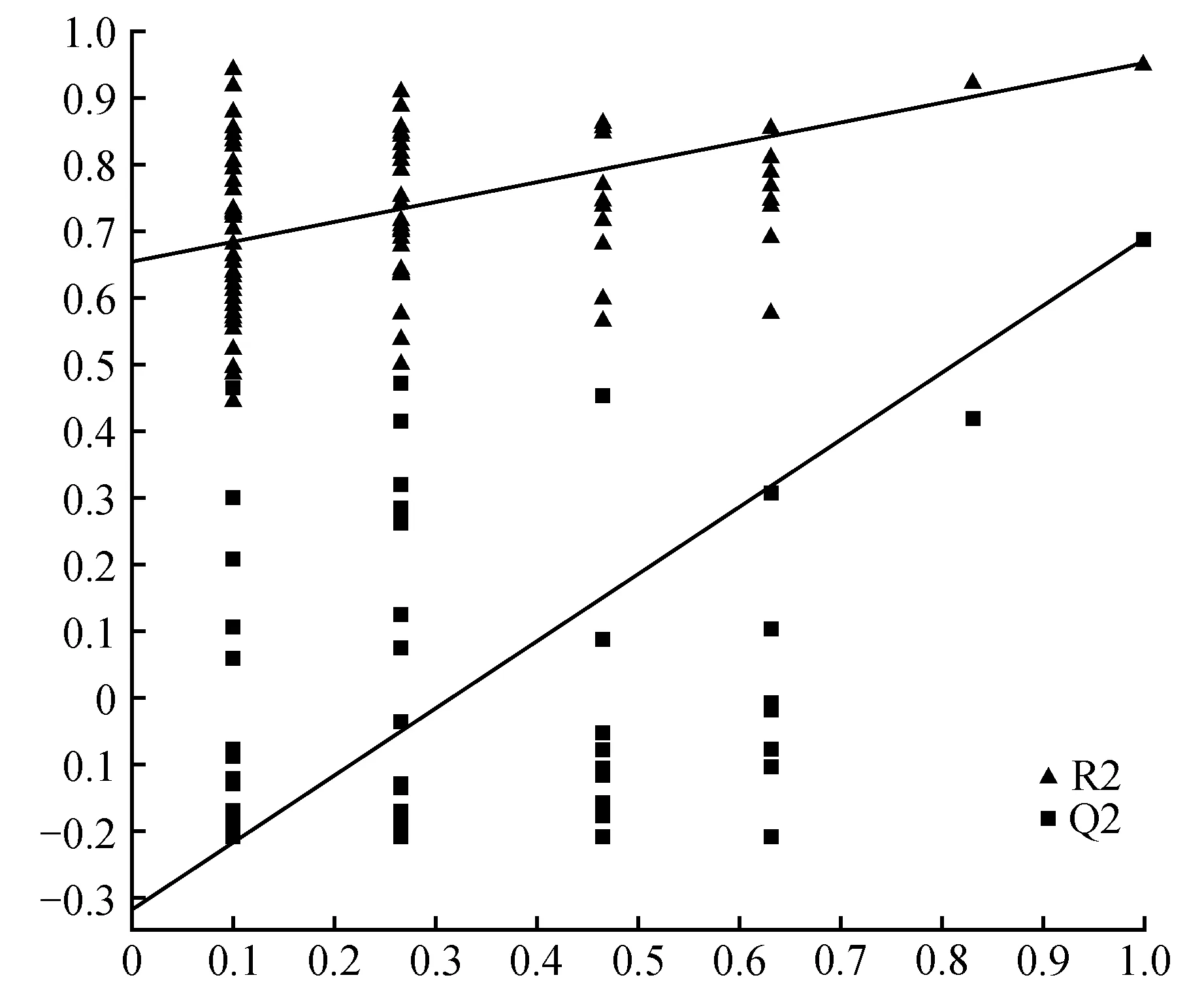
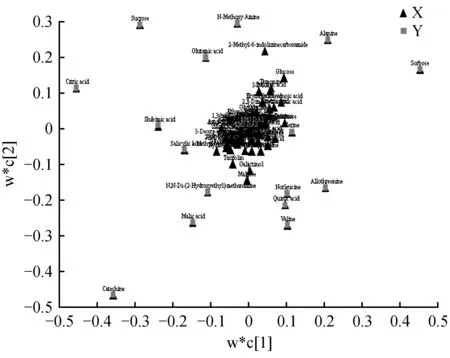
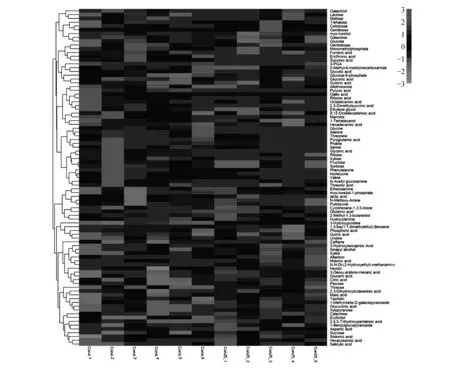
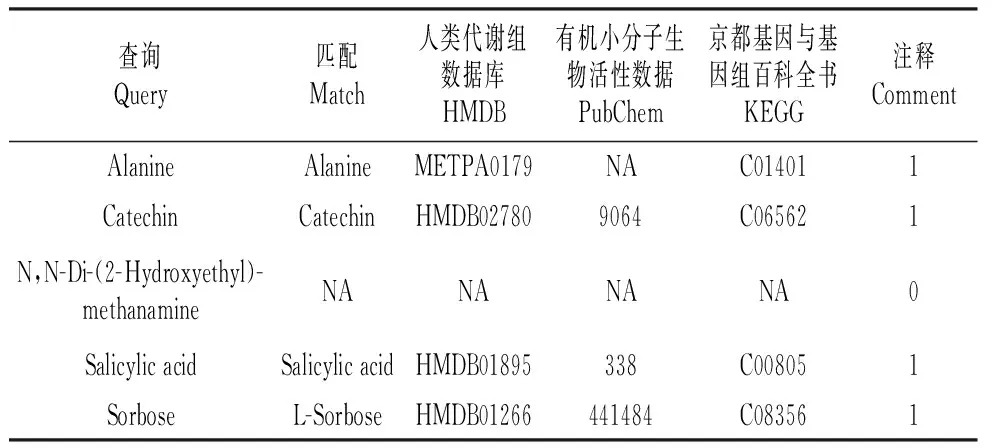
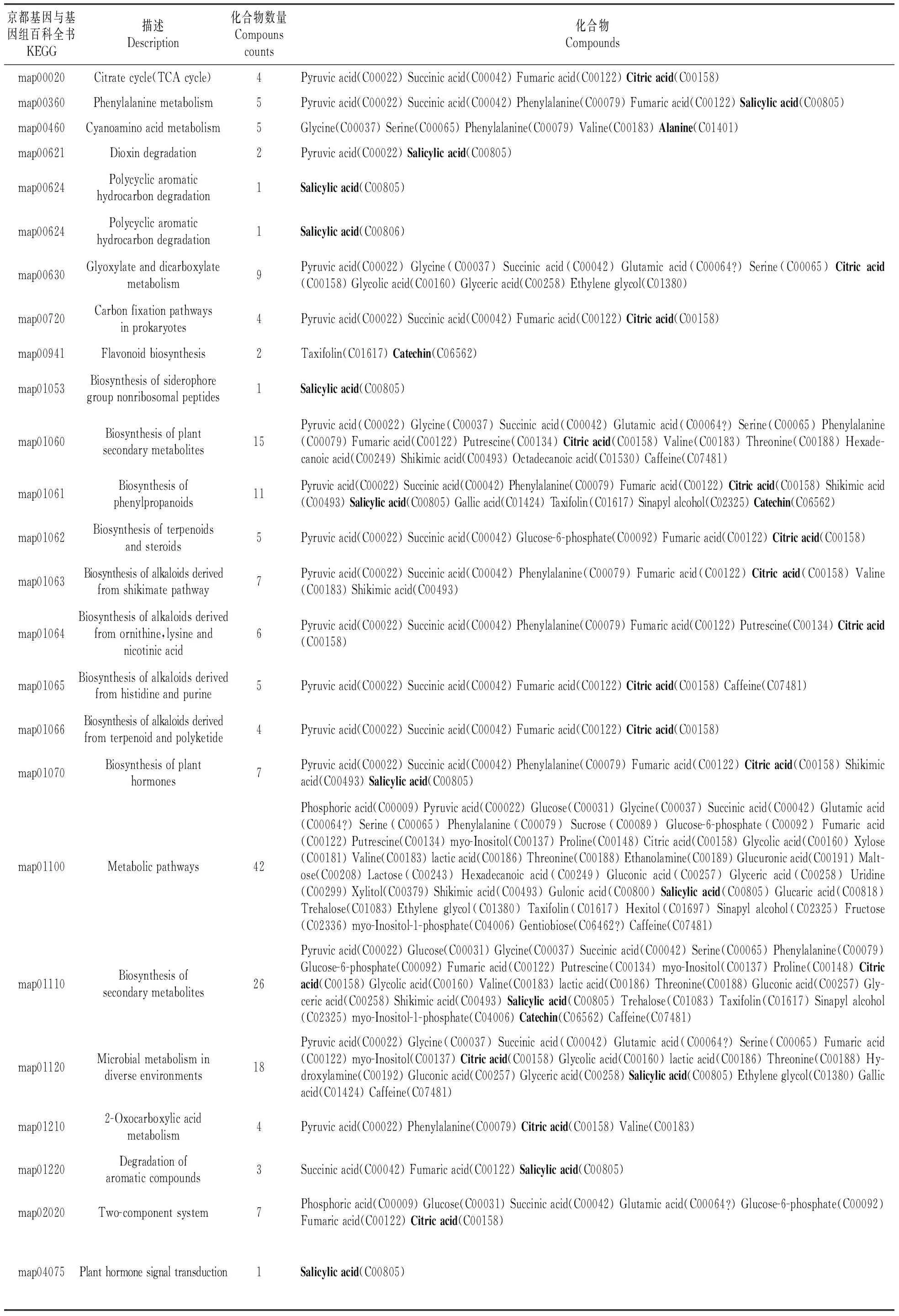
用偏最小二乘判别分析(Partial Least Squares-Discriminant Analysis,PLS-DA)进行有监督的数据分析,并采用置换检验(permutation test)防止PLS-DA模型的过度拟合。并进一步通过PLS-DA模型变量的VIP值(Variable Importance on Projection)对差异变量进行筛选。本节采用PLS-DA这种监督的多维统计分析方法对这样本进行模型分析。并进一步对模型的质量用交叉验证法进行检验,并用交叉验证后得到的R2X和Q2(分别代表模型可解释的变量及模型的可预测度)对模型有效性进行评判。结果表明,R2X为0.451,R2Y为0.954,Q2为0.688。得分图如图2所示(横坐标为第1主成分得分,用t表示;纵坐标为第2主成分得分,用t表示)。R2Y(即监督模型的解释率)说明PLS-DA模型已经可以很好地解释各组样本之间的差异。在此之后,对于PLS-DA模型进行置换检验(permutation test),100次验证结果显示R2在Y轴上的截距为0.654,Q2在Y轴上的截距为-0.319(图3)。从各组的模型预测参数的R2X、R2Y、Q2Y来看,上述的模型是有效和可靠的,因其符合以下标准[20]:Q2Y>0.5被认为是有效的模型,Q2Y>0.9被认为是出色的模型,0 在载荷图中(Loading plot)中(图4),离原点越远的点表示对各组分类的贡献越大。 图2 处理组和对照组的PLS-DA得分图Fig.2 PLS-DA score chart of treatment group and control group 图3 处理组和对照组的PLS-DA置换检验图Fig.3 PLS-DA permutation test chart of treatment group and control group 图4 处理组和对照组的PLS-DA载荷图Fig.4 PLS-DA loading plot of treatment group and control group 对获得的代谢物进行样本和代谢物的双向聚类,所用方法为:层次聚类。从图5可以看出哪些样本具有相似的代谢谱,哪些代谢物具有相似的代谢方式,并聚集在一起,聚类软件为R语言(www.r-project.org)包Pheatmap。 对所有的代谢物进行时间序列的关联性分析,采用方法为皮尔森相关系数(Pearson correlation coefficients)分析,关联性矩阵用R语言的pheatmap包进行热图的绘制(图6)。代谢物之间的相关系数的计算同时综合了所有时间点。其中1为表示完全正相关,-1为表示完全负相关。 图5 处理组和对照组代谢物热图分析Fig.5 Thermal analysis of treatment group and control group 采用学生氏T检验来寻找差异代谢物,阈值为P<0.05,并结合倍第一主成分的VIP值(Variable Importance in the Projection)来判断差异的代谢物(FC>=1.5或者FC<0.75),差异结果见表1。处理组和对照组的差异性代谢物有丙氨酸(Alanine)、儿茶素(Catechin)、柠檬酸(Citric acid)、N,N-双(2-羟乙基)甲胺(N,N-Di-(2-Hydroxyethyl)-methanamine)、水杨酸(Salicylic acid)和山梨糖(Sorbose)。 图6 处理组和对照组代谢物×代谢物相关性分析Fig.6 Correlation analysis of metabolites×metabolites of treatment group and control group Table2KEGGcommentsofdifferentialmetabolites 查询Query匹配Match人类代谢组数据库HMDB有机小分子生物活性数据PubChem京都基因与基因组百科全书KEGG注释CommentAlanineAlanineMETPA0179NAC014011CatechinCatechinHMDB027809064C065621N,N-Di-(2-Hydroxyethyl)-methanamineNANANANA0SalicylicacidSalicylicacidHMDB01895338C008051SorboseL-SorboseHMDB01266441484C083561 注:1.确切注释;2.有疑问;0.无注释 Note:1. The exact notes; 2. A question; 0. No comment 对差异代谢物进行KEGG compound名称注释。获得KEGG compound ID(表2)。并进行KEGG pathway注释工作。获得KEGG pathway(表3)。在黄独微型块茎4℃离体保存中,丙氨酸(Alanine)参与氰基氨基酸代谢;儿茶素(Catechin)参与次生代谢产物生物合成、黄酮类化合物的生物合成和苯丙素的生物合成;水杨酸(Salicylic acid)参与多环芳烃降解、微生物在不同环境中的代谢、植物激素信号转导、次生代谢产物生物合成、二恶英降解、苯丙氨酸代谢、芳烃降解、植物激素生物合成、铁载体组非核糖体肽合成和苯丙素的生物合成等。柠檬酸(Citric acid)参与来自鸟氨酸、赖氨酸和烟酸的生物碱生物合成、组氨酸和嘌呤的生物碱生物合成、微生物在不同环境中的代谢、植物次生代谢产物的生物合成、2-氧代羧酸代谢、萜类和类固醇的生物合成、原核生物固碳途径、次生代谢产物生物合成、 来自莽草酸途径的生物碱生物合成、来自萜类化合物和聚酮的生物碱生物合成、柠檬酸循环(TCA循环)、植物激素生物合成、乙醛酸和二羧酸代谢、双组分系统、苯丙素的生物合成以及来自鸟氨酸,赖氨酸和烟酸的生物碱生物合成等。 表3 差异代谢物的KEGG pathway注释 代谢组学为较为全面地研究植物复杂代谢过程及其产物,从而为分析植物次生代谢网络结构、限速步骤,解析细胞活动过程,是研究植物体内复杂生理代谢物的波动是一种非常有效的方法[21]。本研究通过对黄独低温离体保存的微型块茎进行GC/MS代谢组学分析,结果表明,与黄独微型块茎25℃离体保存相比较,黄独微型块茎4℃离体保存的差异性代谢物有丙氨酸(Alanine)、儿茶素(Catechin)、N,N-双(2-羟乙基)甲胺(N,N-Di-(2-Hydroxyethyl)-methanamine)、水杨酸(Salicylic acid)和山梨糖(Sorbose)。 其中,丙氨酸(Alanine)在黄独微型块茎低温离体保存中主要参与氰基氨基酸代谢;儿茶素(Catechin)是主要的类黄酮化合物之一,具有抗氧化、抗诱变、抗癌、抗心血管疾病、紫外线辐射的保护作用以及抗糖尿病、抗菌消炎、减肥和帕金森病的治疗等作用[22]。在黄独微型块茎低温离体保存中主要参与次生代谢产物生物合成、黄酮类化合物的生物合成和苯丙素的生物合成。 水杨酸(Salicylic acid)是植物体内普遍存在的一种酚类化合物,可以诱导植物产生系统获得性抗性[23]。水杨酸可以提高植物抵抗高温、低温、盐害、重金属及干旱等逆境的能力,还可以诱导植物产生抗病性[24]。在黄独微型块茎低温离体保存中主要参与多环芳烃降解、微生物在不同环境中的代谢、植物激素信号转导、次生代谢产物生物合成、二恶英降解、苯丙氨酸代谢、芳烃降解、植物激素生物合成、铁载体组非核糖体肽合成和苯丙素的生物合成等。 柠檬酸(Citric acid)代谢涉及到柠檬酸合成与降解二个方面,其合成途径以三羧酸(TCA)循环为主,其降解有γ-氨基丁酸(GABA)途径和谷氨酰胺合成酶(GS)途径。柠檬酸代谢涉及到许多不同的酶,主要有柠檬酸合成酶、顺乌头酸酶、异柠檬酸脱氢酶、谷氨酸脱羧酶等[25]。同时,柠檬酸作为植物体内广泛存在的一类生物小分子,可以为植物细胞提供质子,从而启动很多代谢反应,与植物逆境生理密切相关,是植物体内关键的代谢物,参与C4循环等众多代谢途径,可以显著提高植物体的耐酸性和对逆境的抗性[26]。在黄独微型块茎低温离体保存中主要参与来自鸟氨酸、赖氨酸和烟酸的生物碱生物合成、组氨酸和嘌呤的生物碱生物合成、微生物在不同环境中的代谢、植物次生代谢产物的生物合成、2-氧代羧酸代谢、萜类和类固醇的生物合成、原核生物固碳途径、次生代谢产物生物合成、来自莽草酸途径的生物碱生物合成、来自萜类化合物和聚酮的生物碱生物合成、柠檬酸循环(TCA循环)、植物激素生物合成、乙醛酸和二羧酸代谢、双组分系统、苯丙素的生物合成以及来自鸟氨酸,赖氨酸和烟酸的生物碱生物合成等。 黄独低温离体保存微型块茎差异代谢物的初步发现为进一步了解黄独微型块茎低温离体保存的分子机制奠定了基础,也为低温离体保存黄独微型块茎的破除休眠以及其后续萌发提供了理论依据。 1.黄含含,李霞,高文远,等.薯蓣属药用植物的亲缘关系研究[J].中国中药杂志,2015,40(17):3470-3479. Huang H H,Li X,Gao W Y,et al.Studies on genetic relationship ofDioscorea[J].China Journal of Chinese Materia Medica,2015,40(17):3470-3479. 2.刘月学,刘小军,王家福,等.低温等因素对枇杷种质离体保存的影响[J].植物资源与环境学报,2004,13(1):28-31. Liu Y X,Liu X J,Wang J F,et al.Effects of low temperature and another condition onEriobotryajaponicagermplasm preservationinvitro[J].Journal of Plant Resources and Environment,2004,13(1):28-31. 3.史永忠,潘瑞炽,王小菁,等.铁皮石斛种质资源的低温离体保存[J].应用与环境生物学报,2000,6(4):326-330. Shi Y Z,Pan R C,Wang X J,et al.Invitroconservation ofDendrobiumofficinaleat low temperature[J].Chinese Journal of Applied and Environmental Biology,2000,6(4):326-330. 4.王运英,张晓丽,白英豪,等.山药微型块茎萌发影响因素研究[J].北方园艺,2015(17):194-196. Wang Y Y,Zhang X L,Bai Y H,et al.Impact factors in germination of microtubers fromDioscoreaopposita[J].Northern Horticulture,2015(17):194-196. 5.Alizadeh S,Mantell S H,Viana A M.Invitroshoot culture and microtuber induction in the steroid yamDioscoreacompositaHemsl[J].Plant Cell,Tissue and Organ Culture,1998,53(2):107-112. 6.John J L,Courtney W H,Decoteau D R.The influence of plant growth regulators and light on microtuber induction and formation inDioscoreaalataL.cultures[J].Plant Cell,Tissue and Organ Culture,1993,34(3):245-252. 7.Li M J,Li J H,Liu W,et al.A protocol forinvitroproduction of microtubers in Chinese yam(Dioscoreaopposita)[J].Bioscience,Biotechnology,and Biochemistry,2014,78(6):1005-1009. 8.Onjo M,Park B J,Hayashi M.Effects of plant growth regulators on plantlet growth and enlargement of microtubers of water yam(DioscoreaalataL.)invitro[J].Japanese Society for Tropical Agriculture,2001,45(2):142-147. 9.Jova M C,Kosky R G,Cullar E E,et al.Efficiency of semi-automated culture systems on microtubers formation of yam(DioscoreaalataL.)[J].Biotechnologie,Agronomie,Société et Environnement,2012,16(1):45-47. 10.Li M J,Li J H,Wang Y P,et al.A simple method for microtuber production inDioscoreaoppositausing single nodal segments[J].Pakistan Journal of Botany,2015,47(2):665-668. 11.Uchendu E E,Sobowale O O,Odimegwu J,et al.Invitrosucrose concentration influences microtuber production and diosgenin content in white yam(DioscorearotundataPoir)[J].InvitroCellular & Developmental Biology-Plant,2016,52(6):563-570. 12.Bazabakana R,Fauconnier M L,Diallo B,et al.Control ofDioscoreaalatamicrotuber dormancy and germination by jasmonic acid[J].Plant Growth Regulation,1999,27(2):113-117. 13.韦本辉,唐荣华,韦威泰,等.淮山零余子不同贮藏方式对出苗及苗期生长影响的研究[J].广西农业生物科学,2004,23(1):28-30. Wei B H,Tang R H,Wei W T,et al.Effects of different store ways on budding rate and seedling growth in yam bulbil[J].Journal of Guangxi Agricand Biol Science,2004,23(1):28-30. 14.Ovono P O,Kevers C,Dommes J.Effects of storage conditions on sprouting of microtubers of yam(Dioscoreacayenensis-D.rotundatacomplex)[J].Comptes Rendus Biologies,2010,333(1):28-34. 15.尹明华,洪森荣,夏瑾华,等.黄独微型块茎低温保存及其萌发苗遗传稳定性研究[J].广西植物,2015,35(5):733-740. Yin M H,Hong S R,Xia J H,et al.Low temperature conservation ofDioscoreabulbiferamicrotuber and genetic stability of its germination seedling[J].Guihaia,2015,35(5):733-740. 16.赵杰才,麻彦,周琴,等.沙米和藜麦种子代谢组比较分析[J].中国食物与营养,2016,22(12):64-68. Zhao J C,Ma Y,Zhou Q,et al.Comparative analysis on metabolomics ofAgriophyllumsquarrosumandChenopodiumquinoaseeds[J].Food and Nutrition in China,2016,22(12):64-68. 17.陈冬梅,李忠,张志兴,等.基于GC-MS分析的水稻代谢组学研究策略[J].中国稻米,2015,21(6):1-6. Chen D M,Li Z,Zhang Z X,et al.Metabolomics research strategies of rice based on GC-MS[J].China Rice,2015,21(6):1-6. 18.段礼新,漆小泉.基于GC-MS的植物代谢组学研究[J].生命科学,2015,27(8):971-977. Duan L X,Qi X Q.GC-MS-based plant metabolomics researches[J].Chinese Bulletin of Life Sciences,2015,27(8):971-977. 19.Cook D,Fowler S,Fiehn O,et al.From the Cover:a prominent role for the CBF cold response pathway in configuring the low-temperature metabolome ofArabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(42):15243-15248. 20.Eriksson L,Johansson E,Kettaneh-wold N,et al.Multi and megavariate data analysis.Part Ⅰ.Basic principles and applications:2nd ed[M].Umea,Sweden:Umetrics Academy,2006. 21.淡墨,高先富,谢国祥,等.代谢组学在植物代谢研究中的应用[J].中国中药杂志,2007,32(22):2337-2341. Dan M,Gao X F,Xie G X,et al.Application of metabolomics in research of plant metabolites[J].China Journal of Chinese Materia Medica,2007,32(22):2337-2341. 22.夏涛,高丽萍.类黄酮及茶儿茶素生物合成途径及其调控研究进展[J].中国农业科学,2009,42(8):2899-2908. Xia T,Gao L P.Advances in biosynthesis pathways and regulation of flavonoids and catechins[J].Scientia Agricultura Sinica,2009,42(8):2899-2908. 23.彭浩,宋文路,王晓强.水杨酸、脱落酸对盐胁迫下玉米种子萌发和幼苗生长的影响[J].玉米科学,2016,24(6):75-78,87. Peng H,Song W L,Wang X Q.Effects on seed germination and seedling growth of maize under salt stress with salicy scid and abscisic acid[J].Journal of Maize Sciences,2016,24(6):75-78,87. 24.徐晓昀,郁继华,颉建明,等.外源水杨酸对低温胁迫下黄瓜幼苗抗氧化酶活性和基因表达的影响[J].干旱区地理,2016,39(6):1291-1297. Xu X Y,Yu J H,Xie J M,et al.Effects of exogenous salicylic acid on antioxidant enzyme activities and gene expression in cucumber seedlings under low temperature stress[J].Arid Land Geography,2016,39(6):1291-1297. 25.张规富,卢晓鹏,谢深喜.不同时期水分胁迫对椪柑果实柠檬酸代谢相关基因表达的影响[J].果树学报,2015,32(4):525-535. Zhang G F,Lu X P,Xie S X.Influence of water stress in different development stage on the citric acid metabolism-related genes expression in the Ponkan fruits[J].Journal of Fruit Science,2015,32(4):525-535. 26.肖玉明,卢晓鹏,黄成能,等.水分胁迫对温州蜜柑果实品质及柠檬酸代谢相关基因表达的影响[J].湖南农业大学学报:自然科学版,2014,40(3):281-287. Xiao Y M,Lu X P,Huang C N,et al.Effects of water stress on the fruit quality of citrate and the expression of genes related to metabolism of citric acid[J].Journal of Hunan Agricultural University:Natural Sciences,2014,40(3):281-287.
2.4 所有样本热图分析
2.5 代谢物关联性分析
2.6 差异显著的代谢物

2.7 差异代谢物的KEGG注释
3 讨论

