穗分化期外施24-表油菜素内酯(EBR)促进水稻源、库及籽粒灌浆的生理机制
李赞堂 王士银 姜雯宇, 张 帅, 张少斌 徐 江,*
1 中国农业科学院作物科学研究所, 北京 100081; 2 沈阳农业大学生物科学技术学院, 辽宁沈阳 110866
籽粒灌浆是水稻(Oryza sativaL.)生育期重要的生理生化过程, 其实质就是光合器官制造的同化物以蔗糖的形式运入籽粒, 并经一系列酶的催化作用转化为淀粉的过程[1]。其能力的强弱最终决定了籽粒重量和稻米产量[2]。水稻籽粒灌浆受源强(source capacity)和库强度(sink strength)的影响[3]。源强一般指生物量或贮藏在茎鞘中的碳水化合物转运到穗中的能力[4], 研究认为, 水稻籽粒灌浆的物质来源于花前贮存的碳水化合物及花后新生成的同化物[5]。库强度是指库摄取同化物的能力[6], 可以用库容(sink size)和库活性(sink activity)来表示[6-7], 库容一般指单位面积籽粒数与单个籽粒重的乘积[4], 库活性指可溶性糖转化为淀粉的生化效率[7-8]。库容的增大对源有正反馈调节作用, 能够增强源叶的光合作用, 促进光合产物的积累及其转运[4,9]; 但当光合同化物供应不足时, 单纯地增大库容并不足以使水稻增产, 如籽粒总数超过最适值, 产量将由于籽粒充实度的减小而降低[10]。因此, 通过增大库容来实现产量的提高必须建立在有足够大的源强和库活性的基础上。
谷类作物的灌浆结实除受遗传因子和光、温、水、肥等诸多环境因素调控外, 还在很大程度上取决于植物激素的平衡和调节。因此人们也一直很重视对植物内源激素和外源生长调节物质与籽粒灌浆结实关系的研究和应用[11]。油菜素甾醇类化合物(brassinosteroids, BRs)是一种甾醇类植物激素, 具有广谱高效的生理活性, 对种子萌发、输导组织的分化、株型构成及生殖器官的生长发育、光形态建成和抗逆等均有调控作用[12]。BRs还可以调控水稻植株体内糖类的代谢和转运, 促进蔗糖向籽粒运输,提高结实率和粒重[13]。24-表油菜素内酯(24-epibrassinolid, EBR)是一种人工合成的高活性油菜素内酯类似物[14], 喷施 EBR可以增加天竺葵的叶绿素含量、光合速率以及碳水化合物含量[15]。翁晓燕等[16]和王士银等[17]在水稻孕穗末至始穗期喷施 EBR, 提高了水稻净光合速率和源强, 促使谷粒发育良好,从而增加了水稻产量。已有研究表明, 油菜素甾醇类化合物对水稻生长发育和产量形成具有正向调节作用[12-13,16,18]。水稻产量与籽粒灌浆能力密切相关,而籽粒灌浆能力的强弱受源和库的影响。我们在穗分化期外施 EBR, 并研究分析源强、库容和库活性的变化, 以期明确其对水稻籽粒灌浆的影响及其生理机制。
1 材料与方法
1.1 材料与栽培概况
2013—2014年在中国农业科学院作物科学研究所昌平试验基地进行试验, 试验地耕作层含有机质23.08 g kg-1、全氮1.24 g kg-1、碱解氮109.35 mg kg-1、速效磷 102.14 mg kg-1、速效钾 197.15 mg kg-1。供试材料为粳稻品种日本晴(Nipponbare), 于4月22日播种, 5月30日移栽插秧, 株行距为15 cm × 20 cm, 每穴1株。
1.2 处理设置
在水稻穗分化期(80%以上的植株主茎已进入第一苞原基分化期)开始喷施EBR, T0、T1、T2处理浓度分别为0、0.2和1.0 µmol L-1, 溶液中加入0.1%Tween-20作为展布剂。从7月19日开始, 每隔2 d喷施一次, 共3次。处理时间为 16:00—18:00, 均匀喷施至叶面的溶液不滴落为度, 喷施量约为120 mL m-2。采取随机区组试验设计, 每个处理3个重复小区, 每个处理小区面积为1.5 m × 9.0 m, 其中每小区预留1.5 m2用于测产。
1.3 取样方法
在水稻初花期和收获期, 取长势一致的代表性植株 6株, 将地上部分分为上三叶、茎鞘、穗和其余部分, 105℃杀青80℃烘干后分别称重用于生物量的计算, 称重后将上三叶、茎鞘粉碎, 用于NSC (可溶性糖+淀粉)含量的检测。
在水稻开花盛期, 选穗型相对一致的单茎在穗顶部强势颖花开花当日挂牌, 标记每小区 200个穗子。分别在花后6、12、18、24、30、36 d取样, 每次取每个小区25个单茎, 取直接着生于穗顶部3个一次枝梗上的籽粒作为强势粒样本, 4个一次枝梗上直接着生于二次枝梗的籽粒作为弱势粒, 并留其上三叶。分别将摘下的强势粒、弱势粒、叶片各分成2份, 其中1份(叶片去叶脉)用液氮速冻2 min后保存在-80℃超低温冰箱用于酶活检测, 另一份 105℃杀青 30 min, 80℃烘干至恒重用于碳水化合物的检测。另外, 在收获期取20个挂牌的穗子, 分为强、弱势粒, 用于分析其糙米重和结实率。
1.4 测定项目及方法
1.4.1蔗糖、可溶性糖和淀粉含量的测定参考Yoshida等[19]的方法提取碳水化合物。称量 0.05 g样品至10 mL离心管中, 加入5 mL蒸馏水, 于100℃水浴40 min, 然后1370×g离心10 min, 取上清液,再重复上述步骤 2次, 然后将沉淀用蒸馏水清洗并离心, 最后将 3次离心所得上清液统一转入 25 mL容量瓶, 用蒸馏水定容, 所得溶液用于可溶性糖和蔗糖含量的检测。然后向上述沉淀中加入2 mL蒸馏水, 沸水浴糊化15 min, 冰水浴冷却后, 加入2 mL浓度为9.2 mol L-1高氯酸, 震荡酸解15 min, 然后加入2 mL蒸馏水混匀, 1790×g离心15 min, 取上清液, 向沉淀中再加入2 mL浓度为4.6 mol L-1的高氯酸, 重复上述操作。最后用蒸馏水清洗沉淀2次, 并离心, 将4次离心所得上清液一并转入25 mL容量瓶, 用蒸馏水定容, 用于淀粉含量测定。采用间苯二酚法检测蔗糖含量[20], 采用硫酸-蒽酮比色法测定可溶性糖和淀粉[21]。
1.4.2酶提取和检测低温环境下取样品籽粒25粒(叶片约 0.2 g), 手工剥去颖壳, 在预先冷冻的研钵内加2 mL提取液(50 mmol Hepes-NaOH, pH 7.5;5 mmol EDTA; 1 mmol DTT; 2 mmol KCl; 1%PVP-K30)研磨成匀浆, 转入10 mL离心管, 再分别加2 mL 和1 mL提取液洗涤研钵2次, 将提取液一并转入10 mL离心管, 4℃低温下16 000×g离心15 min, 上清液即为酶粗提取液。参照 Hubbard等[22]和Miron等[23]的方法检测蔗糖合酶(sucrose synthase,SS)和蔗糖磷酸合酶(sucrose phosphate synthase, SPS)活性, 参照 Zhu等[24]的方法检测酸性转化酶(acid invertase, AI)活性。
1.4.3产量分析收获期随机选取每小区3个样方, 调查并计算有效穗数, 取具有代表性的 10株考种, 统计其每穗粒数、结实率和千粒重。测量测产小区面积, 数取测产小区穗数, 收割测产。将每穗粒数乘以单位面积穗数即为单位面积籽粒数。
1.5 数据分析
使用Microsoft Excel 2003处理数据, 用SAS 9.2分析数据, 用SigmaPlot 10.0绘图。本文以2013年试验结果为主, 2014年对地上部分生物量、收获期库容及产量结果进行验证。
2 结果与分析
2.1 源强
2.1.1地上部分生物量由图1可知与对照相比,在初花期, 2种浓度EBR处理均极显著增加了水稻植株地上部分的生物量; 在收获期, T2处理极显著增加了水稻植株地上部分生物量, 而T1处理的地上部分生物量没有显著变化。

图1 初花期和收获期地上部分生物量Fig. 1 Aboveground biomass at flowering stage and harvesting stageA: 2013年地上部分生物量; B: 2014年地上部分生物量。FS: 初花期; HS: 收获期。*和**表示在0.05和0.01水平上处理与对照相比有显著性差异; T0、T1、T2分别表示0、0.2、1.0 µmol L-1的EBR处理。A: aboveground biomass in 2013, B: aboveground biomass in 2014, FS: flowering stage, HS: harvesting stage; * and **: significantly different between EBR treatments at the 0.05 and 0.01 probability levels, respectively. T0, T1, and T2: 0, 0.2, and 1.0 µmol L-1 EBR treatments,respectively.
2.1.2各营养器官 NSC含量无论是初花期还是收获期, 茎鞘作为同化物的贮藏器官, 其中的非结构性碳水化合物(non-structure carbohydrate, NSC)含量都远高于叶片。相较初花期, 收获期叶片中的NSC含量没有太大变化, 而茎鞘中NSC含量则明显减少。从不同 EBR处理间的情况来看, 初花期两EBR处理均显著增大了叶片和茎鞘内的 NSC含量;而收获期两EBR处理对营养器官中NSC含量的影响却不一致, T1处理显著增大了叶片和茎鞘中的NSC含量, 而T2处理却显著降低了地上部分各营养器官的NSC含量(图2), 推测T2处理可能更有效地促进了生育后期同化物向籽粒的运输。
2.1.3灌浆期叶片中SPS活性及其蔗糖含量作为蔗糖合成的关键酶, 叶片中的蔗糖磷酸合酶(SPS)活性在灌浆期表现为先升高后降低的规律, 其最高活性出现在花后24 d (图3-A)。虽然叶片中的蔗糖含量最大值也出现在花后 24 d, 但在整体趋势上与SPS活性并不一致, 表现为降低—升高—降低的趋势(图3-B)。从比较结果来看, 两EBR处理均显著增大了叶片花后12~30 d的SPS活性和花后6~24 d的蔗糖含量。在花后36 d, 两EBR处理水稻叶片中的SPS活性降低到与对照相同的水平, 而叶片中的蔗糖含量则显著降低。这些结果表明在灌浆后期, EBR处理促进蔗糖从叶片向外转运的作用大于促进蔗糖合成的作用。
2.2 收获期库容及产量
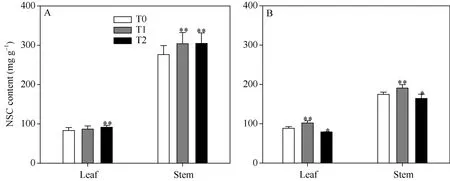
图2 叶片和茎鞘中的非结构性碳水化合物(NSC)含量Fig. 2 Non-structure carbohydrate (NSC) content in vegetative organsA: 初花期的NSC含量; B: 收获期的NSC含量。*和**表示在0.05和0.01水平上处理与对照相比有显著性差异; T0、T1、T2分别表示 0、0.2、1.0 µmol L-1的 EBR 处理。A: NSC content at flowering stage; B: NSC content at harvesting stage. * and **: significantly different between EBR treatments at the 0.05 and 0.01 probability levels, respectively; T0, T1, and T2: 0, 0.2, and 1.0 µmol L-1 EBR treatments, respectively.
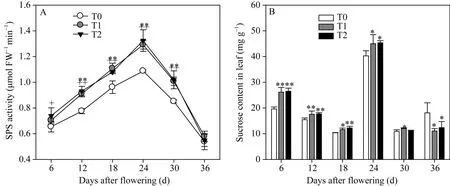
图3 灌浆期叶片蔗糖磷酸合酶(SPS)活性及其蔗糖含量Fig. 3 Activity of sucrose phosphate synthase (SPS) and content of sucrose in leaves*和**分别代表T1在0.05和0.01水平上的显著性; +和++分别代表T2在0.05和0.01水平上的显著性。T0、T1、T2分别表示0、0.2、1.0 µmol L-1的 EBR 处理。* and ** represent the significance of T1 at the 0.05 and 0.01 probability levels; + and ++ represent the significance of T2 at the 0.05 and 0.01 probability levels, respectively; T0, T1, and T2: 0, 0.2, and 1.0 µmol L-1 EBR treatments, respectively.
T1处理显著增加了籽粒的千粒重, 在 2013年和 2014年分别增大 9.2%和 4.2%, 平均增加 6.7%,对单位面积穗数、穗粒数和籽粒数影响不显著。T2处理对千粒重的增加不显著, 但却显著增加了单位面积穗数和穗粒数, 并极显著地增加了单位面积籽粒数, 2013年和2014年单位面积籽粒数分别增加了28.0%和26.9%, 平均增加27.45% (表1)。通过以上分析发现T1处理和T2处理均显著增大了水稻的库容, 但在库容的增大方式上存在差异, T1处理主要通过提高千粒重增大水稻库容; 而T2处理主要通过增加单位面积的穗数和穗粒数增大水稻库容。

表1 2013年和2014年不同处理库容变化Table 1 Sink size of different treatments in 2013 and 2014
两EBR处理的增产效果均达到了显著或极显著水平, 在 2013年和2014年 T1处理分别增产 8.3%和2.9%, 平均增产5.6%; T2处理分别增产17.5%和12.9%, 平均增产15.2%。相比之下, T2处理对产量的影响更大, 在2013年和2014年分别比T1处理增产8.5%和9.7%, 平均增产9.1%。
2.3 强、弱势粒库活性
2.3.1强、弱势粒中蔗糖裂解酶活性蔗糖合酶(SS)和酸性转化酶(AI)是催化蔗糖裂解的两个重要酶。在灌浆期, 强势粒(图4-A)和弱势粒SS活性(图4-B)均表现出先增大后减小的趋势, 其活性的最高点分别出现在花后18 d和24 d。两EBR处理的SS活性均表现出较对照增加的趋势。
从花后强、弱势粒AI酶活性变化的结果(图4-C,D)看, 各处理间的整体趋势一致。对于强势粒, T1和T2处理除了显著增加花后6 d和36 d AI活性外,其余时间差异不显著; 对于弱势粒, T1和T2处理显著增加了花后的AI活性。因此, EBR处理对弱势粒AI酶活性的影响较大, 对强势粒的影响相对较小。2.3.2强、弱势粒中的NSC含量随着灌浆的进行, 籽粒的NSC含量均表现出增加的趋势(图5)。两EBR处理显著增加了花后12 d至24 d强势粒的NSC含量, 但之后影响不显著, 花后 6 d强势粒的 NSC含量甚至有所降低。而对于弱势粒, 两EBR处理显著增加了花后12 d到36 d的NSC含量; T2处理显著降低了花后6 d的NSC含量。因此, 相较强势粒, 两EBR处理更显著地促进了弱势粒中光合产物的积累。2.3.3强、弱势粒中淀粉含量灌浆过程中, 籽粒的淀粉含量表现出增加趋势(图6)。相较对照, 两EBR处理使花后12 d到24 d强势粒的淀粉含量有不同程度升高, 但总体趋势差异不甚显著。而对于弱势粒, 虽然两EBR处理显著降低了花后6 d籽粒的淀粉含量, 但显著增加了花后12 d到36 d籽粒的淀粉含量。因此, 与强、弱势粒的NSC含量变化结果相似, 两EBR处理更显著增加了弱势粒的淀粉合成和积累。
2.3.4强、弱势粒糙米重和结实率由图7可知,无论是糙米重还是结实率, 强势粒都高于弱势粒。从 EBR处理的效果来看, 对弱势粒的影响更大, 能显著增加其糙米重和结实率, 而对于强势粒则作用不明显, 仅T1处理显著增加了强势粒的糙米重。
3 讨论
穗分化期外施 EBR能够显著增加水稻的产量,但两种浓度的EBR处理对水稻的调控效果存在显著差异。因此, 我们从源强、库容和库活性等方面分析两EBR处理, 阐述其促进水稻增产的生理机制。
3.1 EBR处理通过增加光合产物的合成和转运提高水稻源强
源强一般指生物量或贮藏在茎鞘中的碳水化合物转运到穗中的能力[4]; 而籽粒灌浆物质主要来自抽穗前的茎鞘贮藏物和抽穗后的光合产物[25-26]。因此, 源强可从光合产物的合成能力和转运能力两方面衡量。
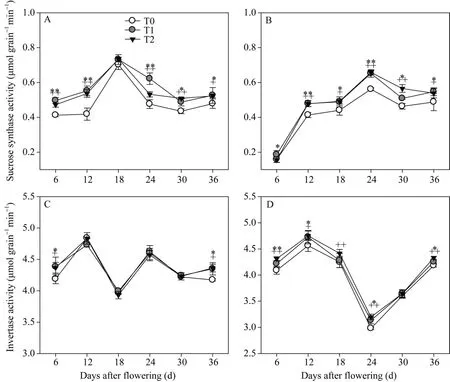
图4 灌浆期强、弱势粒中蔗糖裂解酶的活性Fig. 4 Sucrose lyase activity in superior grains and inferior grains at filling stage A: 强势粒中的SS(蔗糖合酶)活性; B: 弱势粒中的SS活性; C: 强势粒中的AI (酸性转化酶)活性; D: 弱势粒中的AI活性。*和**分别代表T1在0.05和0.01水平上的显著性, +和++分别代表T2在0.05和0.01水平上的显著性。T0、T1、T2分别表示0、0.2、1.0 µmol L-1的EBR处理。A: SS (sucrose synthase) activity in superior grains; B: SS activity in inferior grains; C: AI (acid invertase) activity in superior grains; D: AI activity in inferior grains. * and ** represent the significance of T1 at the 0.05 and 0.01 probability levels; + and ++ represent the significance of T2 at the 0.05 and 0.01 probability levels. T0, T1, and T2: 0, 0.2, and 1.0 µmol L-1 EBR treatments, respectively.
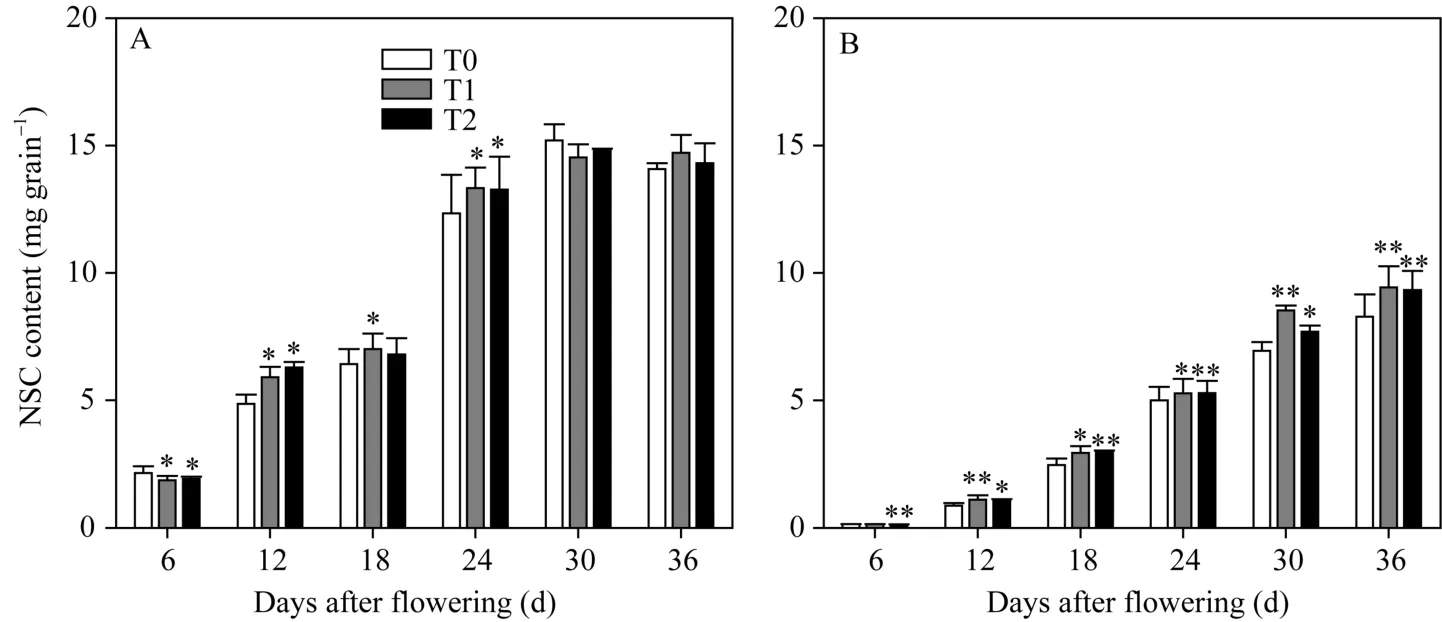
图5 灌浆期强、弱势粒中NSC积累Fig. 5 NSC accumulation in superior grains and inferior grains at filling stageA: 强势粒中的NSC积累; B: 弱势粒中的NSC积累。*和**表示在0.05和0.01水平上处理与对照相比有显著差异。T0、T1、T2分别表示0、0.2、1.0 µmol L-1的EBR处理。A: NSC accumulation in superior grains; B: NSC accumulation in inferior grains. * and **: significantly different from that of T0 at the 0.05 and 0.01 probability levels, respectively. T0, T1, and T2: 0, 0.2, and 1.0 µmol L-1 EBR treatments, respectively.

图6 灌浆期强、弱势粒中淀粉积累Fig. 6 Starch accumulation in superior grains and inferior grains at filling stageA: 强势粒中的淀粉积累; B: 弱势粒中的淀粉积累。*和**表示在0.05和0.01水平上处理与对照相比有显著差异。T0、T1、T2分别表示 0、0.2、1.0 µmol L-1的 EBR 处理。A: starch accumulation in superior grains; B: starch accumulation in inferior grains. * and **: significantly different from that of T0 at the 0.05 and 0.01 probability levels, respectively. T0, T1, and T2: 0, 0.2, and 1.0 µmol L-1 EBR treatments, respectively.

图7 收获期强、弱势粒糙米重和结实率Fig. 7 Brown rice weight and seed-setting rate of superior grains and inferior grains at harvesting stageA: 糙米重; B: 结实率。*和**表示在0.05和0.01水平上处理与对照相比有显著差异。T0、T1、T2分别表示0、0.2、1.0 µmol L-1的EBR处理。A: brown rice weight; B: seed-setting rate. * and **: significantly different from that of T0 at the 0.05 and 0.01 probability levels,respectively; T0, T1, and T2: 0, 0.2, and 1.0 µmol L-1 EBR treatments, respectively.
在初花期, T1处理和T2处理均显著增加了地上部分的生物量和营养器官的 NSC含量。在收获期,T1处理虽然没有显著增加地上部分生物量, 但显著提高了营养器官的NSC含量; T2处理显著增加了地上部分生物量。因此, 穗分化期外施EBR能够提高光合产物的合成。已有大量文献报道BRs能同时促进光系统II反应中心的电子传递和Rubisco的羧化活性, 从而有助于增加 CO2的同化[27-28], 本研究结果虽然显示EBR处理可以导致非结构性碳水化合物在营养器官中的累积, 但是目前还无法确知EBR处理在多大程度上提高了水稻叶片的光合速率, 对此,我们将在后续研究中进一步试验分析和探讨。
前人研究认为, 水稻籽粒灌浆物质的20%~40%来源于抽穗前茎鞘中贮存的物质[29]。初花期茎鞘中贮藏的NSC不仅是灌浆物质的一部分, 而且对提高灌浆初期籽粒的库活性、启动和促进籽粒灌浆起着重要作用[30-31]。Fu等[32]研究表明, 初花期茎鞘中较高的NSC含量有利于提高灌浆期籽粒的库活性, 尤其是对弱势粒作用更明显。在我们试验中, 两 EBR处理均提高了初花期营养器官的NSC含量, 为后期灌浆提供了物质基础。
EBR处理不仅提高了光合物质的合成, 还提高了其转运能力。蔗糖是高等植物光合作用的主要产物之一, 是碳水化合物运输的主要形式, 也是“库”代谢的主要基质[33]。SPS是蔗糖合成的限速酶, 是增强蔗糖生物合成的主要调控目标[34], SPS活性的提高有助于增加光合产物从营养器官向籽粒的运输[35]。我们的研究表明, 两EBR处理均提高了花后6~30 d功能叶的SPS活性, 增加了叶片中的蔗糖含量。
灌浆期叶片中的蔗糖含量是由其合成速率和转运速率共同决定的。本试验中, EBR处理使花后6~30 d功能叶中的 SPS活性显著提高, 此时蔗糖的合成速率大于转运速率, 叶片中蔗糖含量显著提高; 到花后36 d, 两EBR处理的功能叶SPS活性降低到与对照相同的水平, 此时蔗糖的合成小于转运, 因此叶片的蔗糖含量显著低于对照。
3.2 EBR处理能够增大水稻收获期的库容
以BRs合成缺陷型或BRs不敏感型水稻突变体为材料的研究表明, BRs对水稻籽粒数量、大小和粒重有正向的调控作用[36]。有研究表明, 通过转基因手段增加水稻茎鞘和根中的 BRs含量时, 转基因材料分蘖数、单株籽粒数和粒重均增大, 单株增产15%~40%[13]。在光合物质积累和转运效率不高的情况下, 籽粒数的增加往往导致粒重的降低。从我们对库容的研究结果看, T1处理显著增大了水稻的千粒重, 但单位面积穗数和穗粒数增加不显著; 而 T2处理显著增加了单位面积的穗数和穗粒数, 千粒重却没有显著增大。因此, 在水稻穗分化期喷施 EBR能够增大水稻的库容, 但不同浓度间作用方式存在差异。
Kato[37]认为限制水稻弱势粒灌浆的不是源, 而是库容。收获期籽粒充实度的提高和粒重的增加有助于产量的提高[38]; 但由于籽粒数量比籽粒重有更大的可塑性[39], 即籽粒数量比籽粒重对产量的影响更大[40]。我们对库容的研究发现, 相比可使籽粒重量显著增大的T1处理, T2处理使籽粒数量显著增加,对产量的贡献更大。因此, 在足够的源强条件下,EBR处理可能通过影响水稻的颖花发育, 促进水稻的籽粒形成, 进而增大库容, 提高产量。
花前光合同化物的增加能够减少籽粒败育, 进而提高籽粒的数量[10]。因此, 本试验中T2处理收获期穗数和穗粒数显著增加可能是其生物量和NSC含量增大带来的。
3.3 EBR处理对强、弱势粒蔗糖裂解酶活性和物质分配的影响
蔗糖向籽粒中的运输速率很大程度上取决于籽粒的库强度, 库强度的一个重要生化指标是与糖代谢相关的关键酶活性, 为了维持源、库之间蔗糖浓度梯度, 一个重要的调节方式就是蔗糖在进入籽粒后转化为其他化合物; 因此, 籽粒中的蔗糖如何被高效地分解为可被进一步利用的单糖, 往往是反映库活性的重要标志。蔗糖合酶(SS)和酸性转化酶(AI)是降解蔗糖的 2个主要酶, 其活性常与蔗糖输入库组织的速率紧密相关[41]。调节这两个蔗糖裂解酶在籽粒中的活性, 会改变蔗糖输入速率及同化物的分配情况。
Jiang等[42]报道外施EBR可通过提高黄瓜SPS、SS和 AI等糖代谢酶活性增加可溶性糖、蔗糖、己糖和淀粉含量。刘海英等[18]在小麦开花期喷施表油菜素内酯(EBR)增强了籽粒中 SS活性, 加速了籽粒中蔗糖的降解。从本实验籽粒中蔗糖裂解酶的活性看, 两 EBR处理同时提高了强势粒和弱势粒的 SS活性, 也同时提高了强、弱势粒的AI活性, 但对弱势粒影响更大。籽粒灌浆实质上就是光合产物在籽粒中合成淀粉的过程[43]。从灌浆期籽粒中NSC和淀粉积累情况看, 相较强势粒, 两 EBR处理对弱势粒的影响更大, 这可能与弱势粒较强的AI活性有关。因此, EBR处理可以提高籽粒, 尤其是弱势粒中的蔗糖裂解酶活性, 进而促进蔗糖向籽粒的运输。
弱势粒结实率不高往往是限制产量的一个主要因素[33,44]。本试验中两EBR处理后结实率升高, 尤其是弱势粒的结实率增高更为显著, 原因可能是EBR处理使蔗糖裂解酶活性提高, 促进了籽粒充实。
另外, AI也被认为参与了植物的生长和器官建成, 为植物体合成各种重要化合物提供原料。一般在植物的分生组织和快速生长的幼嫩组织和器官中AI活性较高[45-46]。灌浆初期, EBR处理在花后6 d强、弱势粒中总的NSC含量和淀粉含量有降低趋势,推测灌浆初期 AI的主要作用是为结构性物质的生成提供原料, 即 EBR处理提高了灌浆初期 AI的活性, 促使更多转运的同化物用于结构性物质的生成,从而减少了灌浆初期NSC的含量及淀粉的合成。
3.4 EBR处理在水稻源强、库容和库活性中的协调作用
库容对叶片光合产物的运转(流)有很大的调控作用。杨建昌等[47]用14C同位素示踪的方法研究表明,库源比越大, 叶片光合产物向穗粒中运输得越多。因此, 只有在库容足够大的基础上, 源强的增加才能带来产量的显著提高; 否则, 抽穗后生产的光合物质更多地积累在叶片和茎鞘中, 并不能有效地转化为经济产量。本试验中, 低浓度的T1处理对收获期的生物量影响不显著, 却显著增加了营养器官的NSC含量; 而高浓度的T2处理不仅显著提高了地上部分的生物量, 而且还显著降低了营养器官的 NSC含量。我们分析认为, T1处理虽然提高了源强和库活性, 千粒重也有所提高, 但穗数和穗粒数变化不大, 库容增加幅度较小, 限制了其对光合产物的充分利用, 未被转运的同化物又被重新贮存在营养器官中, 这往往限制籽粒灌浆和经济产量的提高[48]。而T2处理穗数和穗粒数显著增加, 相较T1处理库容进一步增大, 促使营养器官中的光合产物更高效地向籽粒转运, 促进了高效的籽粒灌浆和产量的显著提高。
3.5 EBR处理在水稻上的应用价值分析
为便于后期深入系统地研究EBR处理对水稻影响的生理生化和分子机制, 本试验选用全基因组测序已经完成的粳稻日本晴作为研究材料, 揭示了穗分化期外施EBR能增加粳稻日本晴干物质生产、增大库容、提高产量的作用及其生理机制。本研究所获得的最佳EBR处理浓度虽不能适用于所有水稻品种, 但对其他品种所用最佳浓度的筛选、作用机理解析等具有参考价值。后续工作可以此为基础逐步深入展开。
4 结论
两种浓度的EBR处理增加了灌浆前植株的生物量和非结构性碳水化合物在营养器官的累积, 并促进了灌浆期蔗糖的合成与转运, 增大了源强, 且显著增大了水稻的库容。T1处理显著增大了水稻千粒重, T2处理显著增大了水稻的籽粒数。两种浓度的EBR处理均提高了水稻强、弱势粒的蔗糖裂解酶活性, 尤其对弱势粒AI活性影响更大, 使更多的光合产物向弱势粒分配, 提高了弱势粒的充实度, 避免了库容增大带来的结实率降低等问题。在光合物质积累充足和库活性足够强的基础上, 库容将决定产量。T2处理比 T1处理库容进一步增大, 能更充分地利用光合产物并加速籽粒灌浆, 进而更显著提高水稻产量。
[1] Preiss J. The Biochemistry of Plants Vol. 3. London: Academic Press, 1980. pp 371-423
[2] Kato T, Takeda K. Associations among characters related to yield sink capacity in space-planted rice.Crop Sci, 1996, 36:1135-1139
[3] 黄升谋. 水稻强、弱势粒结实生理及其调控途径研究. 湖南农业大学博士学位论文, 湖南长沙, 2003 Huang S M. Setting Physiology and Regulation Measure of the Superior and Inferior Grains of Rice. PhD Dissertation of Hunan Agricultural University, Changsha, China, 2003 (in Chinese with English abstract)
[4] Ohsumi A, Takai T, Ida M, Yamamoto T, Arai-Sanoh Y, Yano M,Ando T, Kondo M. Evaluation of yield performance in rice near-isogenic lines with increased spikelet number.Field Crops Res, 2011, 120: 68-75
[5] Song X F, Agata W, Kawamitsu Y. Studies on dry matter and grain production of F1hybrid rice in China: II. Characteristic of grain production.Jpn J Crop Sci,1990, 59: 19-28
[6] Ho L C. Metabolism and compartmentation of imported sugars in sink organs in relation to sink strength.Annu Rev Plant Biol,2003, 39: 355-378
[7] 梁建生, 曹显祖, 徐生, 朱庆森, 宋平. 水稻籽粒库强与其淀粉积累之间关系的研究. 作物学报, 1994, 20: 685-691 Liang J S, Cao X Z, Xu S, Zhu Q S, Song P. Studies on the relationship between the grain sink strength and it’s starch accumulation in rice (O. sativa).Acta Agron Sin, 1994, 20: 685-691 (in Chinese with English abstract)
[8] 杨建昌. 水稻弱势粒灌浆机理与调控途径. 作物学报, 2010,36: 2011-2019 Yang J C. Mechanism and regulation in the filling of inferior spikelets of rice.Acta Agron Sin, 2010, 36: 2011-2019 (in Chinese with English abstract)
[9] Mccormick A J, Cramer M D, Watt D A. Sink strength regulates photosynthesis in sugarcane.New Phytol, 2006, 171: 759-770
[10] Sheehy J E, Mja D, Mitchell P L. Spikelet numbers, sink size and potential yield in rice.Field Crops Res, 2001, 71: 77-85
[11] 杨卫兵, 王振林, 尹燕枰, 李文阳, 李勇, 陈晓光, 王平, 陈二影, 郭俊祥, 蔡铁, 倪英丽. 外源ABA和GA对小麦籽粒内源激素含量及其灌浆进程的影响. 中国农业科学, 2011, 44:2673-2682 Yang W B, Wang Z L, Yin Y P, Li W Y, Li Y, Chen X G, Wang P,Chen E Y, Guo J X, Cai T, Ni Y L. Effects of spraying exogenous ABA or GA on the endogenous hormones concentration and filling of wheat grains.Sci Agric Sin, 2011, 44: 2673-2682 (in Chinese with English abstract)
[12] Zhao J, Wu C, Yuan S, Yin L, Sun W, Zhao Q, Zhao B, Li X.Kinase activity of OsBRI1 is essential for brassinosteroids to regulate rice growth and development.Plant Sci Int J Exp Plant Biol, 2013, 199-200: 113-120
[13] Wu C Y, Trieu A, Radhakrishnan P, Kwok S F, Harris S, Zhang K,Wang J, Wan J, Zhai H, Takatsuto S, Matsumoto S, Fujioka S,Feldmann K A, Pennell R I. Brassinosteroids regulate grain filling in rice.Plant Cell, 2008, 20: 2130-2145
[14] Khripach V, Zhabinskii V, Groot A D. Twenty years of brassinosteroids: steroidal plant hormones warrant better crops for the XXI century.Ann Bot-London, 2000, 86: 441-447
[15] Swamy K N, Rao S S R. Effect of 24-epibrassinolide on growth,photosynthesis, and essential oil content ofPelargonium graveolens(L.) Herit.Russ J Plant Physiol, 2009, 56: 616-620
[16] 翁晓燕, 陶月良. 表油菜素内酯对水稻产量和光合特性的影响. 浙江大学学报(农业与生命科学版), 1995, 21(1): 51-54 Weng X Y, Tao Y L. Effect of epibrassinolid on grain yield and photosynthesis of rice.J Zhejiang Agric Univ(Agric & Life Sci),1995, 21(1): 51-54 (in Chinese with English abstract)
[17] 王士银, 陈冉冉, 石庆华, 张桦, 赵明, 徐江. 开花期外施表油菜素内酯(epi-BR)对水稻的影响. 作物杂志, 2012, (4):83-86 Wang S Y, Chen R R, Shi Q H, Zhang H, Zhao M, Xu J. The effects of epi-BR treated in primary flowering stage on rice.Crops, 2012, (4): 83-86 (in Chinese with English abstract)
[18] 刘海英, 郭天财, 朱云集, 王晨阳, 康国章. 开花期喷施表油菜素内酯对豫麦 49蔗糖代谢和产量的影响. 麦类作物学报,2006, 26(1): 77-81 Liu H Y, Guo T C, Zhu Y J, Wang C Y, Kang G Z. Effect of epibraassinolide sprayed at anthesis on sucrose metabolism and yield of Yumai 49.J Triticeae Crops, 2006, 26(1): 77-81 (in Chinese with English abstract)
[19] Yoshida S, Forno D, Cock J, Gomez K. Determination of sugar and starch in plant tissue. In: Yoshida S ed. Laboratory Manual for Physiological Studies of Rice. Philippines: International Rice Research Institute, 1976. pp 46-49
[20] 张志良, 瞿伟菁. 植物生理学实验指导. 北京: 高等教育出版社, 2003. pp 128-129 Zhang Z L, Qu W J. Experimental Guidance in Plant Physiology,3rd edn. Beijing: Higher Education Press, 2003. pp 128-129 (in Chinese)
[21] Yemm E W, Willis A J. The estimation of carbohydrates in plant extracts by anthrone.Biochem J, 1954, 57: 508-514
[22] Hubbard N L, Huber S C, Pharr D M. Sucrose phosphate synthase and acid invertase as determinants of sucrose concentration in developing muskmelon (Cucumis meloL.) fruits.Plant Physiol,1989, 91: 1527-1534
[23] Miron D, Schaffer A A. Sucrose phosphate synthase, sucrose synthase, and invertase activities in developing fruit ofLycopersicon esculentumMill. and the sucrose accumulating lycopersicon hirsutum Humb. and Bonpl.Plant Physiol, 1991, 95: 623-627
[24] Zhu Y J, Komor E, Moore P H. Sucrose accumulation in the sugarcane stem is regulated by the difference between the activities of soluble acid invertase and sucrose phosphate synthase.Plant Physiol, 1997, 115: 609-616
[25] Pheloung P C, Siddique K. Contribution of stem dry-matter to grain-yield in wheat cultivars.Aust J Plant Physiol, 1991, 18: 53-64
[26] Schnyder H. The role of carbohydrate storage and redistribution in the source-sink relations of wheat and barley during grain filling—a review.New Phytol, 1993, 123: 233-245
[27] Fujii S, Hirai K, Saka H. Growth-regulating action of brassinolide in rice plants. ACS Symposium Series, 1991. pp 306-311
[28] Yu J Q, Huang L F, Hu W H, Zhou Y H, Mao W H, Ye S F, Nogue´s S. A role for brassinosteroids in the regulation of photosynthesis inCucumis sativus.J Exp Bot, 2004, 55: 1135
[29] Yang J, Zhang J. Grain filling of cereals under soil drying.New Phytol, 2006, 169: 223-236
[30] 王志琴, 杨建昌. 水稻抽穗期茎鞘中储存的可用性糖与籽粒充实的关系. 江苏农业学报, 1997, 18(4): 13-17 Wang Z Q, Yang J C. Relation of the usable carbohydrate reserver in stems and sheaths at heading stage with grain-filling in rice plants.J Jiangsu Agric Coll,1997, 18(4): 13-17 (in Chinese with English abstract)
[31] Yang J C, Zhang W H, Wang Z Q, Liu L J, Zhu Q S. Source-sink characteristics and the translocation of assimilates in new plant type and intersubspecific hybrid rice.J Integr Agric, 2002, 1:155-162
[32] Fu J, Huang Z, Wang Z, Yang J, Zhang J. Pre-anthesis non-structural carbohydrate reserve in the stem enhances the sink strength of inferior spikelets during grain filling of rice.Field Crops Res, 2011, 123: 170-182
[33] Farrar J, Pollock C, Gallagher J. Sucrose and the integration of metabolism in vascular plants.Plant Sci, 2000, 154: 1-11
[34] Huber S C, Huber J L. Role and regulation of sucrose-phosphate synthase in higher plants.Annu Rev Plant Physiol Plant Mol Biol,1996, 47: 431-444
[35] Jing F U, Yang J C, Jing F U, Yang J C. Research advances in high-yielding cultivation and physiology of super rice.Rice Sci,2012, 19: 177-184
[36] Morinaka Y, Matsuoka M. Morphological alteration caused by brassinosteroid insensitivity increases the biomass and grain production of rice.Plant Physiol, 2006, 141: 924-931
[37] Kato T. Effect of spikelet removal on the grain filling of Akenohoshi, a rice cultivar with numerous spikelets in a panicle.J Agric Sci, 2004, 142: 177-181
[38] Sheehy J E, Mja D, Mitchell P L. Spikelet numbers, sink size and potential yield in rice.Field Crops Res, 2001, 71: 77-85
[39] Sadras V O, Slafer G A. Environmental modulation of yield components in cereals: heritabilities reveal a hierarchy of phenotypic plasticities.Field Crops Res, 2012, 127: 215-224
[40] Fischer R A. Understanding the physiological basis of yield potential in wheat.J Agric Sci, 2007, 145: 99-113
[41] Perez C M, Perdon A A, Resurreccion A P, Villareal R M, Juliano B O. Enzymes of carbohydrate metabolism in the developing rice grain.Plant Physiol, 1975, 56: 579
[42] Jiang Y P, Cheng F, Zhou Y H, Xia X J, Mao W H, Shi K, Chen Z X, Yu J Q. Hydrogen peroxide functions as a secondary messenger for brassinosteroids-induced CO2assimilation and carbohydrate metabolism inCucumis sativus.J Biomed Biotechnol, 2012,13: 811-823
[43] Kato T, Takeda K. Associations among characters related to yield sink capacity in space-planted rice.Crop Sci, 1996, 36:1135-1139
[44] Yang J, Zhang J. Grain-filling problem in ‘super’ rice.J Exp Bot,2010, 61: 1-5
[45] Estruch J J, Beltrán J P. Changes in invertase activities precede ovary growth induced by gibberellic acid in.Physiol Plant, 1991,81: 319-326
[46] Xu D P, Sung S J, Black C C. Sucrose metabolism in lima bean seeds.Plant Physiol, 1989, 89: 1106-1116
[47] 杨建昌, 王志琴, 朱庆森. 水稻产量源库关系的研究. 江苏农业学报, 1993, 14(3): 47-53 Yang J C, Wang Z Q, Zhu Q S. Studies of yield source and sink relationships in rice.J Jiangsu Agric Coll, 1993, 14(3): 47-53 (in Chinese with English abstract)
[48] 王志琴, 杨建昌, 朱庆森, 张祖建, 郎有忠, 王学明. 亚种间杂交稻籽粒充实不良的原因探讨. 作物学报, 1998, 24: 782-787 Wang Z Q, Yang J C, Zhu Q S, Zhang Z J, Lang Y P, Wang X M.Reasons for poor grain plumpness in intersubspecific hybrid rice.Acta Agron Sin, 1998, 24: 782-787 (in Chinese with English abstract)

