血清糖类抗原125和铁蛋白等检测水平与肺结核病灶侵及胸膜的相关性分析
唐天弼 王建萍 武栋 高永革 范荣
继发性肺结核是成年人肺结核中最常见类型,是由于初次结核感染后,体内潜伏病灶中的结核分枝杆菌重新活动和释放而发病,少数可为外源性再感染,特别是并发HIV感染或AIDS时[1]。肺部影像学、痰涂片分枝杆菌抗酸染色镜检(简称“痰涂片”)、痰结核分枝杆菌培养(简称“痰培养”)及γ-干扰素释放试验(infterferon-γ release assays,IGRA)等检查是继发性肺结核诊断和治疗的重要临床参考依据,但这些传统方法在临床应用中存在着一些不足,寻找方便快捷及高敏感度的检测方法一直是临床追求的目标。有学者研究表明,血清糖类抗原125(CA125)和铁蛋白(serum ferritin,SF)水平在继发性肺结核患者中初诊时均有不同程度的升高[2-3],抗结核药物治疗后则较治疗前有所降低,可作为继发性肺结核诊断及治疗效果的判别指标[4-6];但临床实践中发现,并不是所有继发性肺结核患者初诊时的CA125和SF水平均升高。为明确继发性肺结核患者CA125和SF指标是否增高及增高原因,笔者收集张家口市传染病医院296例初治继发性肺结核患者,观察所有患者CA125、SF、超敏C反应蛋白(hs-CRP)和各营养指标[包括血红蛋白(Hb)、白蛋白(ALB)、血清前白蛋白(PA)]的变化情况,并探索各指标的变化情况与肺结核浸润病变侵及胸膜间的关系,进一步分析评价肺结核浸润性病变侵及范围在病情评估中的实际意义。
资料和方法
1.一般资料:收集2013年11月至2017年4月入住张家口市传染病医院的初治继发性肺结核患者296例,其中男143例(48.3%),女153例(51.7%);年龄15~81岁,平均(50.8±17.9)岁。依据肺实质浸润病变是否侵及胸膜将患者分为未侵及胸膜组(89例),其中男 37例(47.6%)、女52例(52.4%),平均(49.4±17.1)岁;侵及胸膜组(207例),其中男106例(51.2%)、女101例(48.8%),平均(52.5±18.8)岁。所有患者均经知情同意并签署《治疗药物及检查知情同意书》。两组患者性别、年龄、体质量指数(BMI)等一般资料差异均无统计学意义(P值均>0.05);营养状况(Hb、ALB、PA)差异均有统计学意义(P值均<0.05);具体见表1。肺实质病变是否侵及胸膜与BMI指标经Spearman相关性分析,无明显相关性(r=-0.11,P=0.283),但与Hb、ALB、PA指标呈负相关(分别为r=-0.33,P=0.001;r=-0.52,P=0.000;r=-0.52,P=0.000)。

表1 两组患者一般情况比较
2.纳入及排除标准:考虑到临床上CA125和SF指标的检测结果受其他疾病等因素影响较大,其应用价值和临床指导意义可能会受到局限,故在患者的选择和排除方面谨慎纳入。
纳入标准:(1)初治继发性肺结核患者;(2)患者有不同程度的发热、咳嗽、咳痰、呼吸困难、盗汗、消瘦、乏力等结核症状;(3)患者胸部CT扫描可见肺实质改变,表现为肺内有渗出性和渗出增生性病灶、干酪性肺炎、干酪灶和空洞(除净化空洞外)等活动性肺结核征象;(4)患者痰菌检查阳性,即痰涂片、痰培养、支气管镜下刷检分枝杆菌涂片及培养,以及IGRA检测,其中一项或多项指标阳性;(5)患者血尿常规、肝肾功能均正常;(6)患者无青光眼和精神异常,无癫痫,非妊娠期,无长期使用免疫抑制药物史。
排除标准:(1)复治耐药肺结核患者;(2)并发糖尿病、AIDS、矽肺等痰抗酸杆菌阳性高检出率的肺结核患者;(3)患者入院前院外接受阿莫西林、氟喹诺酮等抗生素治疗和祛痰治疗(该类患者因反复抗感染治疗无效仍伴有结核中毒症状才怀疑肺结核而转诊,会导致痰结核抗酸杆菌检测呈低阳性检出率);(4)白血病、卵巢癌及其他恶性肿瘤患者;(5)非恶性肿瘤患者,但应予以排除如下情况,如子宫内膜异位症、盆腔炎、卵巢囊肿、胰腺炎、肝炎、肝硬化、妊娠、腹膜炎、心包积液、心脏或肾脏功能不全、肾病综合征、贫血、原发性血色病、甲状腺功能亢进症等;(6)其他非结核性肺部疾病患者;(7)对任何一种抗结核药物耐药,或药物敏感性试验(简称“药敏试验”)结果提示为耐多药结核病或广泛耐药结核病患者。
3.分组标准:本研究考虑到若依据肺结核浸润病变累及肺叶分组,则侵及胸膜患者的肺结核病变会多见多叶分布及出现空洞等影像,而未侵及胸膜的患者的肺结核病变则会多见局限单侧肺尖浸润影,病灶分布范围更为局限,导致痰分枝杆菌抗酸染色阳性检出率更低,不利于统计分析;故以肺结核病变是否累及胸膜进行分组。分组标准参照《协和呼吸病学》[7]肺炎旁胸腔积液病理分期第一期和临床分型中第一类诊断标准(此阶段不发生胸腔积液)。
4.诊断标准及相关定义:(1)肺结核:符合《肺结核诊断标准》[8]。(2)继发性肺结核[1]:由于初次结核感染后,在原发病变已静止甚至痊愈一定时期后,体内潜伏病灶中的结核分枝杆菌重新活动和释放而再次发生的活动性肺结核,经痰涂片、培养或快速诊断试剂检验为阳性者,并具有相应临床特征和X线表现;或不符合细菌学确诊标准,但根据影像学、组织病理学等其他临床检查结果考虑为活动性肺结核患者。(3)侵及胸膜:为胸部CT扫描和胸腔超声检查显示肺实质结核病灶为浸润病变,并累及脏层胸膜,导致局部胸膜反应,但不伴有胸腔积液及胸膜肥厚粘连。
5.检查方法:本研究痰涂片采用抗酸杆菌Ziehl-Neelsen(萋-尼)染色法(简称“涂片法”),痰培养及药敏试验采用MGIT 960快速液体培养。痰菌检查为涂片法和MGIT 960培养至少1项阳性。IGRA检测判读标准为:当N<400 ng/L,T-N≥14 ng/L且≥N/4时为阳性(表示测试样本中含有针对结核分枝杆菌特异的效应T淋巴细胞,存在结核感染),否则为阴性;其中N为阴性对照反应水平,T为结核特异抗原刺激水平。结核分枝杆菌及利福平耐药检测为Xpert MTB/RIF基因快速分子生物学检测。
治疗前抽取空腹静脉血测定血常规、生化全项、hs-CRP、血清SF及CA125等肿瘤指标和IGRA检测;采用化学发光免疫分析检测血清CA125和SF水平。治疗后每个月复查血常规、肝肾功能、hs-CRP、SF和CA125。所用试剂均为相应配套试剂,严格按说明书操作。
胸部CT扫描检查的意义:(1)区分胸膜病变与肺实质病变。(2)评价肺实质病变严重程度。(3)观察胸腔积液有无分隔。(4)发现胸膜表面病变。(5)指导和评价治疗。
6.治疗方法:对所选患者均给予口服2H-R-E-Z/4H-R-E抗结核方案治疗(H:异烟肼, 0.3 g/次,1次/d;R:利福平, 0.45 g/次,1次/d;Z:吡嗪酰胺, 0.5 g/次,3次/d;E:乙胺丁醇, 0.75 g/次,1次/d)。给予晨起空腹口服抗结核药物治疗6个月。治疗前无肝肾功能损伤及耐药患者。

两组患者的CA125、SF、hs-CRP、IGRA指标,及痰菌检查结果与侵及胸膜采用Spearman相关性分析。采用logistic逐步回归筛选变量并建立肺实质浸润侵及胸膜预测概率值回归方程logit(P)=1/[1+EXP(0.099X1+0.009X2+1.772X3-5.471)]。新变量logit(P)联合检测变量,筛选出与疾病有关的危险因素并控制混杂因素的影响。新变量及各单项指标的相关性采用受试者工作特征曲线(receiver operating characteristic curve,ROC曲线)分析,曲线下面积(AUC)采用梯形面积之和计算,并计算约登指数(约登指数=敏感度+特异度-1)。
参照多田氏颅内血肿计算公式[9],通过胸部CT扫描估算肺实质浸润病变侵及胸膜面积,多处侵及累计相加总和;其中:胸膜面积(Y)=π×长径(L)×层数(N)×层厚(S)/4,长径(L)=肺实质浸润病变侵及胸膜最大长径,层数(N)=显示侵及层面总数,层厚(S)=侵及层面之间的厚度。将侵及胸膜面积(Y)、CA125和SF指标原始数据的自然对数(ln)进行转换变量以实现近似正态分布,建立线性回归分析和变量回归方程,分析lnCA125、lnSF与侵及胸膜的相关性(ln=logeX,为以e为底的自然对数,实现原始数据近似正态分布,从而符合回归分析)。
结 果
1.治疗前两组患者检查指标的比较:89例未侵及胸膜患者和207例侵及胸膜患者的CA125、SF、hs-CRP比较采用Mann-WhitneyU检验,差异有统计学意义(P值均<0.05),但IGRA检查差异无统计学意义(P>0.05);两组痰结核分枝杆菌检查阳性和阴性例数χ2检验,差异有统计学意义(χ2=296.00,P=0.000),见表2。两组患者的CA125、SF、hs-CRP指标与是否侵及胸膜经Spearman相关性分析存在明显相关性(r值分别为0.38、0.32、0.64,P值均=0.000),而IGRA水平与是否侵及胸膜无明显相关性(r=-0.14,P=0.386)。
未侵及胸膜组与侵及胸膜组中痰结核分枝杆菌检查阳性与CA125、SF、IGRA、hs-CRP指标,经Spearman相关性分析,均无相关性(未侵及胸膜组:rCA125=0.13,P=0.361;rSF=0.20,P=0.147;rIGRA=-0.14,P=0.386;rhs-CRP=0.08,P=0.614。侵及胸膜组:rCA125=0.00,P=0.971;rSF=0.00,P=0.976;rIGRA=0.09,P=0.937;rhs-CRP=0.05,P=0.750)。
2.两组患者各项检查指标的logistic逐步回归分析:设X1=CA125,X2=SF,X3=痰结核分枝杆菌检查,肺实质浸润侵及胸膜预测概率值回归方程为logit(P)=1/[1+EXP(0.099X1+0.009X2+1.772X3-5.471)],生成一组新变量logit(P)。CA125、SF、痰菌检查与侵及胸膜具有相关性(P值分别为0.001、0.005、0.025),而IGRA与侵及胸膜无相关性(P=0.692),见表3。
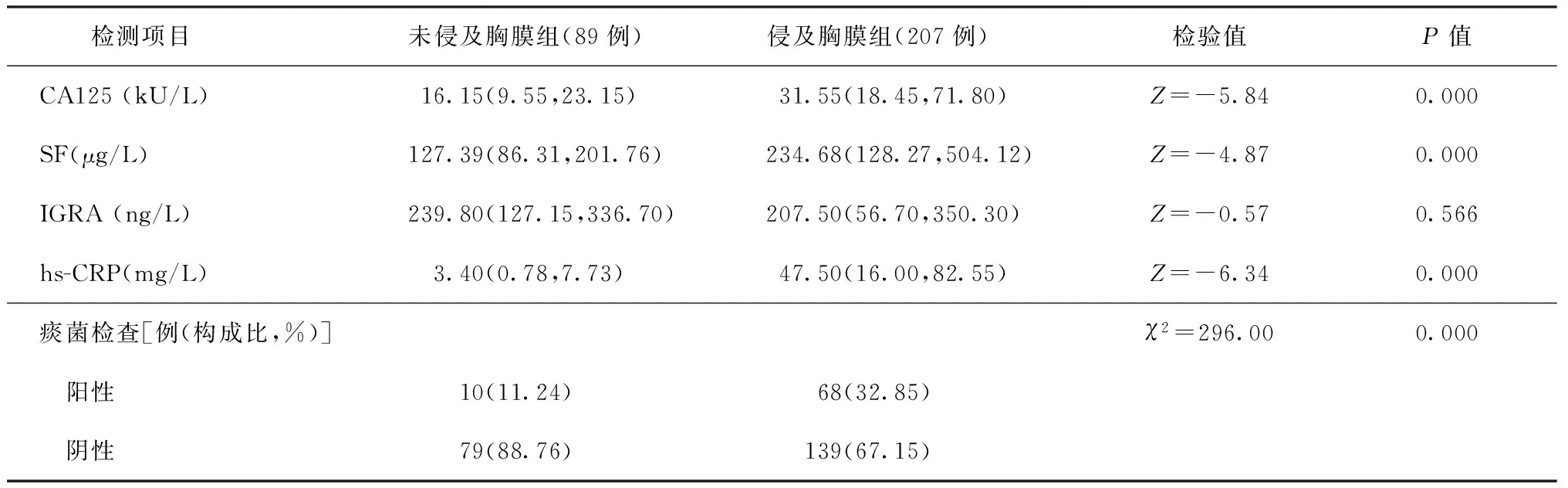
表2 各检测项目的结果在两组患者中的比较
注CA125、SF、IGRA、hs-CRP等计量资料以中位数(四分位数)[M(Q1,Q3)]表示;痰菌检查阳性为痰涂片和痰培养任一阳性结果
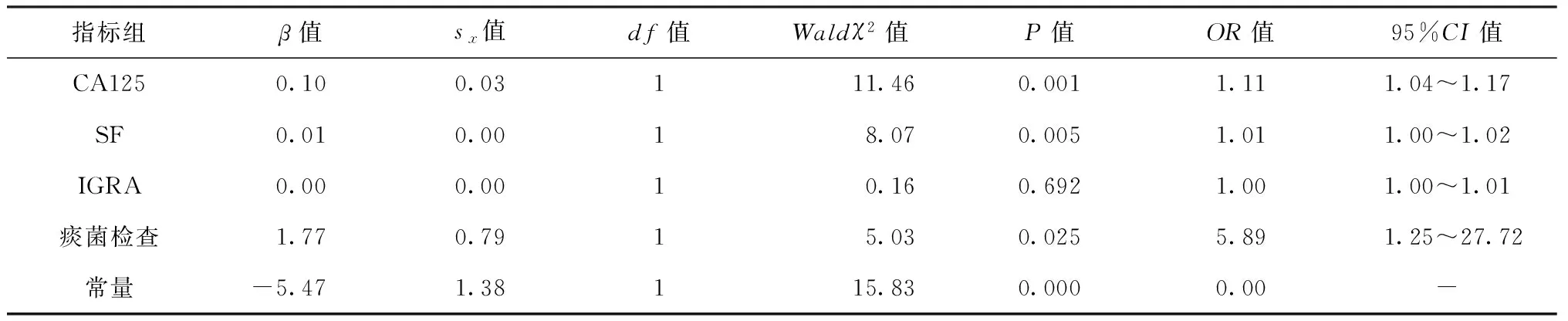
表3 两组患者各项检查指标的logistic回归分析结果
注“-”为缺失值
3.CA125、SF指标和新变量logit(P)的ROC曲线分析:新变量logit(P)的AUC(0.88)>CA125的AUC(0.78)=SF的AUC(0.78)。新变量logit(P)、CA125和SF的各项分析数据见表4。新变量logit(P) 、CA125和SF指标ROC曲线见图1。

图1 新变量logit(P) 、CA125和SF指标ROC曲线
4.通过胸部CT扫描估算肺实质浸润病变侵及胸膜面积 (cm2) 的相关分析和线性回归分析:CA125、SF指标与侵及胸膜面积(Y)经Spearman相关系数分析,存在明显相关性(r值分别为0.69、0.55,P值均=0.000);而痰菌检查与侵及胸膜面积(Y)无明显相关(r=-0.07,P=0.568)。CA125指标回归方程为lnCA125=2.758+0.324lnY,SF指标回归方程为lnSF=4.951+0.252lnY。转换变量CA125=15.768×Y0.324,SF=141.316×Y0.252。
讨 论
继发性结核病再次发病有两种可能,一为陈旧性原发病灶内结核分枝杆菌又重新活动,引起病灶复燃,称内源性复发;一为原发感染已治愈后再次由外界感染结核分枝杆菌而发病,称外源性重染。多见于12岁以上年长儿童、少年及成年人,主要病型为浸润型肺结核。有研究报道,继发性肺结核患者中CA125和SF指标水平可无升高的情况,而结核性胸膜炎的胸腔积液及其血清中CA125和SF指标明显升高[10-15],因此推测CA125和SF升高可能与肺结核肺内浸润性病变侵及胸膜有关。本研究依据继发性肺结核肺实质浸润病变是否侵及胸膜将患者分为两组,分析CA125和SF指标与肺实质浸润病变是否侵及胸膜,以及与侵及胸膜面积的相关性。
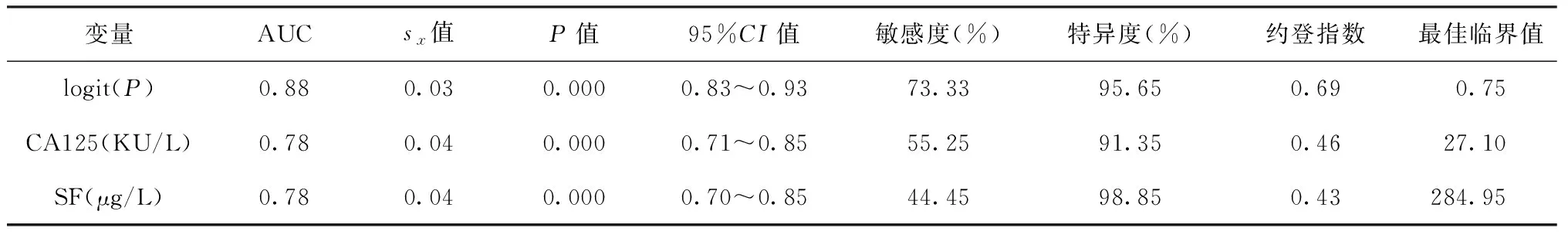
表4 CA125、SF与新变量logit(P)的预测概率情况
注表内数据按照曲线下的面积数据结果顺序列表

表5 血清CA125、SF检测结果的线性回归分析
本研究结果显示,未侵及胸膜组和侵及胸膜组的痰结核分枝杆菌检查、hs-CRP、CA125、SF指标比较,差异均有统计学意义(P值均<0.05),但IGRA比较差异无统计学意义(P>0.05)。两组患者的CA125、SF、hs-CRP指标与是否侵及胸膜经Spearman相关性分析,均呈明显相关性(P值均<0.05),与IGRA指标无明显相关性。两组患者各项指标进一步经logistic逐步回归分析,是否侵及胸膜与痰结核分枝杆菌检查、CA125及SF指标具有相关性(P值均<0.05),与IGRA无相关性(P>0.05)。Kim等[10]分析CA125的升高主要与痰抗酸杆菌涂片阳性、结核感染的活动性和严重程度有关。但由于本研究采用与之不同的分组方式,导致两组患者中痰结核分枝杆菌检查阳性与CA125、SF、IGRA、hs-CRP指标均无明显相关性(P值均>0.05)。Kalantri等[16]分析,当肺结核病灶不累及胸膜上皮时,不会引起CA125的升高释放。本研究显示,痰结核分枝杆菌检查阳性结果、CA125及SF指标升高与侵及胸膜有关,可能与胸膜受到结核分枝杆菌刺激,释放大量的CA125和SF[5,17],经胸膜吸收后进入血循环有关。另外,肺结核患者肺实质浸润病变蔓延至胸膜,结核感染范围外延扩大,较未侵及胸膜者感染更为严重,痰结核分枝杆菌更易被检出。由于IGRA检查不能区分潜伏性结核感染和活动性结核病,与肺实质结核浸润病变是否侵及胸膜及结核感染严重程度无相关性。CRP指标是评估疾病活动性和疗效监测的良好指标,CRP升高的程度能够反映炎症组织的严重程度或活动性;在急性炎性感染时,CRP与疾病活动性有良好的相关性,但无特异性,不适用于疾病诊断。有研究表明,hs-CRP指标的明显升高可作为结核病活动性和严重程度的指标,并可预测病情发展[18-20],本研究中侵及胸膜组患者的hs-CRP指标明显高于未侵及胸膜组,与之相符。
肺结核为慢性消耗性疾病,营养不良是结核病的一个关键风险因素,蛋白质-能量营养不良可导致T淋巴细胞和补体系统损伤,是结核病发生和发展的重要原因之一[22]。本研究显示,侵及胸膜组的营养状况水平(Hb、ALB、PA) 明显低于未侵及胸膜组,与肺内结核浸润病变侵及胸膜存在负相关。SF是人体重要的铁贮存蛋白,参与造血和免疫系统的调控,SF水平可反映铁贮备情况及机体营养状态。营养状况与肺内结核浸润病变严重程度相关,ALB、PA在炎性状态期间减少,未治疗的肺结核患者的ALB、PA水平降低[23],WHO结核病营养指南[24]建议抗结核药物治疗的同时应加强结核病患者的营养支持治疗。
有学者研究表明,肺结核患者治疗前CA125水平升高,治疗期间可下降到正常值,提示痰菌阴性的患者可采用CA125测定[2,25]。本研究经logistic逐步回归和ROC曲线综合分析显示,拟合的新变量Y的ROC曲线下面积大于任何单一指标的曲线下面积,CA125最佳临界值27.10 kU/L,SF最佳临界值284.95 μg/L;未侵及胸膜组的CA125和SF指标无明显升高,且痰结核分枝杆菌检查多数为阴性,而侵及胸膜组痰结核分枝杆菌检查阴性患者可利用CA125和SF指标判断治疗效果。
本研究参照多田氏颅内血肿计算公式,通过胸部CT扫描建立估算肺实质浸润病变侵及胸膜面积公式(Y)。因侵及胸膜长短径不等且形状不规则而采用椭圆面积公式,侵及胸膜面积估算(Y)=π×长径(L)×层数(N)×层厚(S)/4。侵及胸膜面积(Y)与CA125、SF指标水平均呈明显相关性(r分别为0.69、0.55,P值均<0.01)。Azza等[26]分析将CA125作为评估结核病严重程度的参数之一,CA125和影像学病变范围呈正相关。本研究中CA125、SF指标升高与肺浸润病变侵及胸膜面积呈正相关,表明侵及胸膜面积越大结核感染越严重。侵及胸膜面积估算(Y)、CA125指标和SF指标原始数据自然对数(ln)转换变量后符合线性正态分布并进行线性回归模型Anova分析,侵及胸膜面积估算(Y)与CA125指标和SF指标有线性依存关系(lnCA125:F=68.65,P<0.01;lnSF:F=29.45,P<0.01)。结核分枝杆菌刺激胸膜使CA125和SF升高并通过回吸收进入血循环导致血清指标升高,抗结核药物治疗有效可使肺实质浸润病变侵及胸膜面积减少,CA125和SF也随之逐渐降低,肺实质浸润病变可消失,以及无胸膜侵及、胸膜肥厚遗留粘连或胸膜钙化,CA125和SF指标表现为治疗后较治疗前降低[4-6]或下降到正常值[24]。侵及胸膜面积(Y)与痰结核分枝杆菌检查无明显相关性(r=-0.07,P=0.568)。本研究显示,痰结核分枝杆菌阳性与肺浸润病变侵及胸膜面积大小无相关性,但与是否侵及胸膜相关。
综上所述,肺结核患者痰结核分枝杆菌检查阳性、hs-CRP、CA125和SF指标升高与肺实质浸润病变侵及胸膜呈正相关,IGRA与肺实质浸润病变侵及胸膜无相关性,提示IGRA指标不宜作为肺结核活动性、严重性参考指标。营养状况(Hb、ALB、PA)与肺结核浸润病变侵及胸膜呈负相关。肺结核CA125、SF指标升高与肺浸润病变侵及胸膜面积呈正相关。本研究依据胸膜为参照分组方式为进一步相关研究提供新的可参考的方法和思路。CA125和SF指标检测具有操作简单、无创伤、可重复性强等特点。临床中明确肺结核患者CA125和SF肿瘤指标增高原因,可以减少患者不必要顾虑,同时避免过度检查,如肺结核患者的其他血清肿瘤指标明显升高则需要警惕并发肺癌可能。合理观察CA125、SF、hs-CRP和营养指标变化与肺结核浸润病变侵及胸膜关系可作为肺结核活动性、严重性、病变累及范围良好辅助判断指标,对指导临床合理用药、针对性营养支持治疗和病情评估有一定的实际意义。
本研究不足之处是研究对象分组数据中排除了结核性胸膜炎、肺外结核、复治耐药及并发症等痰结核分枝杆菌阳性检出率高的肺结核患者,今后需增加纳入患者种类进一步分析说明。侵及胸膜面积为估算值,变量回归方程只作为临床参考;数据不符合正态分布及方差齐性标准,因此选择非参数检验,降低了检验效率。
志谢本研究的统计学处理结果由东北大学王雷震教授审核
[1] 王辰,王建安.内科学(上册).北京:人民卫生出版社,2016:743-753.
[2] Mohammad OI, Okab AA, Behisy MME, et al. Value of CA-125 in diagnosis and assessment of severity of active pulmonary tuberculosis. Egypt J Chest Dis Tubercul,2016, 65(1):205-209.
[3] Ma J, Xia D, Hu J, et al. Predictive Role of Serum Tumor Markers in Diagnosis of Pulmonary Tuberculosis.Iran J Public Health, 2016,45 (4):435-440.
[4] Tasci C, Ozkaya S, Ozkara B, et al. The utility of tumor markers CA 125, CA 15-3, and CA 19-9 in assessing the response to therapy in pulmonary and pleural tuberculosis. Onco Targets Ther, 2012,5:385-390.
[5] 全斌,喻艳林. 肿瘤相关抗原在肺结核诊断及病情评估中的应用. 皖南医学院学报, 2015, 34(1): 39-42.
[6] Miranda P, Gil-Santana L, Oliveira MG, et al. Sustained elevated levels of C-reactive protein and ferritin in pulmonary tuberculosis patients remaining culture positive upon treatment initiation. PLoS One, 2017,12(4): e0175278.
[7] 蔡柏蔷,李龙芸.协和呼吸病学.北京:中国协和医科大学出版社,2005:743-753.
[8] 中华人民共和国国家卫生和计划生育委员会.WS 288—2008 肺结核诊断标准.北京:人民卫生出版社,2008:1-3.
[9] 中华人民共和国国家卫生和计划生育委员会脑卒中防治工程委员会,脑卒中防治系列规范指导编审委员会.中国脑出血诊疗指导规范.北京:2015中国脑卒中大会资料汇编,2015.
[10] Kim ES, Park KU, Song J, et al. The clinical significance of CA-125 in pulmonary tuberculosis. Tuberculosis (Edinb),2013,93(2):222-226.
[11] Isanaka S, Aboud S, Mugusi F, et al. Iron status predicts treatment failure and mortality in tuberculosis patients: a prospective cohort study from Dar es Salaam, Tanzania. PLoS One, 2012,7(5): e37350.
[12] Minchella PA, Donkor S, McDermid JM, et al. Iron homeostasis and progression to pulmonary tuberculosis disease among household contacts. Tuberculosis (Edinb), 2015,95 (3): 288-293.
[13] Rizk E, Rakha EB, El-Rahman AA, et al. Pulmonary tuberculosis: could tumor markers CA 15-3 and CA 125 be useful for diagnosis and evaluation of response to therapy.Comp Clin Pathol, 2018,27(1):107-114.
[14] Sahin F, Yildiz P. Serum CA-125: biomarker of pulmonary tuberculosis activity and evaluation of response to treatment. Clin Invest Med,2012,35(4):E223-228.
[15] Jacobs R, Tshehla E, Malherbe S, et al. Host biomarkers detected in saliva show promise as markers for the diagnosis of pulmonary tuberculosis disease and monitoring of the response to tuberculosis treatment. Cytokine, 2016,81:50-56.
[16] Kalantri Y, Naik G, Joshi SP, et al. Role of cancer antigen-125 from pleural & ascitic fluid samples in non malignant conditions. Indian J Med Res, 2007,125 (1):25-30.
[17] 梁曼曼,耿彪,林敏,等. 结核病患者治疗过程中血清多种肿瘤标志物水平的变化.中华传染病杂志,2014,32(8):479-483.
[18] Kwas H, Guermazi E, Zendah I, et al. C-reactive protein and pulmonary tuberculosis: What correlation with disease severity.Eur Res pir J, 2015,46:PA2751.
[19] Rao S, Bernhardt V.Serum C-Reactive Protein in Pulmonary Tuberculosis: Correlation With Bacteriological Load and Extent of Disease. Infect Dis Clin Pract,2009,17 (5):314-316.
[20] Almani SA, Shaikh TZ, Khoharo HK, et al. Serum enolase-2, high-sensitivity C-reactive protein, and serum cholesterol in smear-positive drug-naive pulmonary tuberculosis. J Res Med Sci,2017,22: 49.
[21] Shameem M, Fatima N, Ahmad A, et al. Correlation of Serum C-Reactive Protein with Disease Severity in Tuberculosis Patients. Open J Res Dis,2012,2:95-100.
[22] Hayashi S, Takeuchi M, Hatsuda K, et al. The impact of nutrition and glucose intolerance on the development of tuberculosis in Japan.Int J Tuberc Lung Dis,2014,18(1):84-88.
[23] Wang C,Wei LL,Shi LY, et al. Screening and identification of five serum proteins as novel potential biomarkers for cured pulmonary tuberculosis. Sci Rep,2015,5:15615.
[24] WHO Guidelines Approved by the Guidelines Review Committee. Guideline: Nutritional Care and Support for Patients with Tuberculosis.Geneva: World Health Organization,2013:1-54.
[25] Mikacˇic' M, Vasilj I, Vasilj M,et al. Tumor Marker CA 125 in the Diagnosis of Active Pulmonary Tuberculosis-A Study of Adults in Mostar, B&H. Psychiatr Danub, 2017,29(Suppl 4):841-844.
[26] Azza FS, Bahaa IM, Esmat ES, et al. Role of cancer antigen 125 in active pulmonary tuberculosis. Egypt J Chest Dis Tubercul,2013,62(3):419-424.

