蓝光和黑暗培养淡紫拟青霉形态及产孢量差异
李贵正 张营 郑树林 刘永庆

摘要:实验室完全黑暗和持续蓝光培养淡紫拟青霉(Paecilomyces lilacinus),观察营养生长及无性生殖形态差异。结果表明,蓝光对拟青霉营养生长影响较小,蓝光感光期为培养36~96 h,蓝光使产孢期提前20 h,使分生孢子产量增加145.9%;中试对实验室结论进行了初步验证,蓝光使分生孢子产量增加36.8%,蓝光和黑暗发酵产品分生孢子成活率无差异。
关键词:蓝光;淡紫拟青霉(Paecilomyces lilacinus);形态差异;分生孢子产量
中图分类号:S432.4+4 文献标识码:A 文章编号:0439-8114(2018)04-0036-03
DOI:10.14088/j.cnki.issn0439-8114.2018.04.009
The Form and Spore Yield Differentia of Paecilomyces lilacinus
under Blue Light and Darkness
LI Gui-zheng, ZHANG Ying, ZHENG Shu-lin, LIU Yong-qing
(Kingenta Ecological Engineering Group Co.,Ltd., Linyi 276700,Shandong,China)
Abstract: The form and spore yield differentia under total darkness and continuous blue light were observed in laboratory. The results showed that the continuous blue light had little affection on the growth period,while the blue photophase was between 36~96 h,and it was 20 h earlier to produce spore than darkness and the yield of spore increased 145.9% under blue light; Pilot tests were experimented to prove the conclusion,and the yield of spore increased 36.8% under blue light. The spore rate of survival under total darkness and continuous blue light was no difference.
Key words: blue light; Paecilomyces lilacinus; form differentia; spore yield
淡紫擬青霉(Paecilomyces lilacinus)是土壤中植物线虫的一种兼性寄生真菌,它主要通过分生孢子寄生于线虫卵使其不能孵化出幼虫而达到杀虫目的,因此其有效成分是活性分生孢子[1]。蓝光是一种很重要的环境信号,它能调节大多数微生物尤其是真菌的生长和代谢。研究发现蓝光主要影响真菌的新陈代谢、生长、有性和无性生殖过程、色素形成和向性运动等[2]。蓝光能显著提高真菌分生孢子产量,玫烟色拟青霉持续蓝光培养产生的分生孢子量较完全黑暗培养提高109倍[3]。淡紫拟青霉作为生物肥药已在世界范围内用于线虫防治,但行业普遍存在发酵产孢量不高的问题,用传统手段大幅度提高产孢量较困难,如何大幅度提高产孢量仍是一个迫切需要解决的难题。本试验尝试将蓝光应用于拟青霉发酵,既为拟青霉发酵引入光调控提供依据,又为采用科学合理工艺条件提高真菌分生孢子产量找到新的技术突破口。
1 材料与方法
1.1 材料
1.1.1 菌种 淡紫拟青霉购于中国农业微生物菌种保藏中心。
1.1.2 培养基及培养条件 PDA培养基(单孢子培养观察时原配方用无菌水稀释3倍,目的是调整培养基硬度和降低营养物浓度):马铃薯200 g,葡萄糖20 g,琼脂20 g,水1 000 mL,pH 7.0,26 ℃培养。
中试摇瓶培养基:马铃薯200 g,葡萄糖20 g,水1 000 mL,pH 7.0,160 r/min,28 ℃培养36 h。
中试液体培养基:3%玉米粉(质量分数,下同),0.5%葡糖糖,0.4%硝酸钠,0.1%磷酸二氢钾,0.3%七水硫酸镁,0.05%氯化钙;pH 6.5;接种量0.5%(V/V);通气比:0~15 h,0.6 m3/(m3·min),16~30 h,1 m3/(m3·min),31~48 h,0.8 m3/(m3·min);28 ℃培养72 h,使液体菌丝体产孢[4]。
中试固体培养基:玉米秸秆、玉米粉和麸皮质量比1∶1∶1,1%蔗糖(质量分数,下同),1.5%硫酸铵,0.15%硫酸镁,0.1%碳酸钙;物料121 ℃灭菌40 min;接种量48%(V/m);调整含水量60%~64%;通气比:0~24 h不通气,25~72 h 0.6 m3/(m3·min),73~144 h 0.3 m3/(m3·min);26 ℃培养144 h。
1.1.3 光源 20 W蓝色荧光灯,由广州灯泡厂生产,将蓝色光源通过蓝色滤膜(#73)(日本株式会社生产的截止型滤膜)获得较纯净的蓝光,蓝光最强波长450 nm,放于琼脂表面20 cm处或固体培养基表面30 cm处,光密度约10~12 μmol/(m2·s);实验室黑暗培养时培养皿用铝箔包扎,固态发酵黑暗培养过程培养箱用黑布完全遮盖,培养温度为(26±1)℃[5]。
1.1.4 主要试剂、仪器和设备 Whatman滤纸(孔径10 μm,England),凹玻片,玻璃点样毛细管(长度100 mm,内径0.3 mm,四川大学华西医学中心),直径9 cm的布氏漏斗,U形玻璃棒,乳酸石碳酸棉兰染色液,20%甘油,0.03%Tween-80,Nikon-ECLIPSE-50i光学显微镜(日本),Nikon数码相机(日本),哈东联DLHR-X250摇床,液体发酵罐(200 L,江苏科海生物工程设备有限公司),固体灭菌罐(2 000 L,江苏科海生物工程设备有限公司),固体培养箱(自制;长、宽、高分别为450、220、200 cm;内装8辆物料车;每车装24个盘;培养箱内每面装蓝光灯管2根),浅盘(自制,长、宽、高分别为64、46、3 cm)。
1.2 方法
1.2.1 菌落形态观察法 淡紫拟青霉培养7 d,红光灯下培养皿内加入灭菌的0.03% Tween-80溶液,玻璃涂布器刮下菌落,用10 μm孔径的Whatman滤纸过滤,血球板计数得到106个孢子/μL的孢子悬液;每皿接种5 μL孢子悬液;蓝光培养时,培养皿放于培养箱蓝光管下20 cm处,调整培养箱温度使琼脂表面温度为26 ℃。黑暗培养时,铝箔包扎好后置于培养箱中26 ℃培养;培养6 d后拿出用Nikon数码相机拍照。
1.2.2 单孢子生长观察法 采用凹玻片法[6]获得单孢子,完全黑暗和蓝光分别培养,菌落用乳酸石碳酸棉兰染色,光学显微镜下观察拍照。
1.2.3 分生孢子计数法 采用显微镜直接计数法[7],培养皿中加入灭菌的0.03% Tween-80溶液,用玻璃涂布器刮下菌落,稀释50~100倍显微计数;称取5 g固态发酵物料,加灭菌的0.03% Tween-80溶液,稀释500~2 500倍显微计数。
1.2.4 蓝光光敏期确定法 按照“1.2.1”方法接种36个培养皿;接种后3个培养皿进行12 h蓝光照射,其余33个培养皿用铝箔纸包扎好使完全黑暗培养,蓝光照射后3个培养皿用铝箔包扎使完全黑暗培养;每隔12 h依次给予3个培养皿蓝光照射,这3个培养皿其余时间完全黑暗培养;培养6 d后拿出培养皿,刮下菌落进行显微镜直接计数,参考完全黑暗和蓝光培养的分生孢子数确定光敏期。
1.2.5 验证黑暗和蓝光产品成活率差异法 采用萌发率来衡量,萌发率=涂布平板计数结果/显微镜直接计数结果。涂布平板计数法按GB 20287-2006农用微生物菌剂执行。固态发酵物料常温保存,取2~6个月的保存物料,采取多点取样法称取物料5 g,分别用显微镜直接计数和涂布平板计数。
2 结果与分析
2.1 菌落形态
蓝光对菌落生长影响不大,蓝光和黑暗培养的菌落直径无明显差别(表1)。两种条件培养的菌落形态差别明显,蓝光培养的菌落中央有明顯突起,突起部分菌丝直立向上生长,呈花蕊状,菌落表面绒毛状气生菌丝体较多(图1A),这与Miyake等[2]对红曲霉(Monascus)的观察结果基本一致;黑暗培养的菌落中央圆形突起呈扁平状,表面绒毛状菌丝体较少(图1B)。
2.2 单孢子生长观察结果
蓝光对分生孢子萌发无影响,蓝光、黑暗两种条件培养的分生孢子均在8~12 h萌发(图2A、图2B);蓝光培养菌丝较粗,且致密,48 h菌落产生大量分生孢子(图3A);黑暗培养菌丝较细,且较疏松,68 h才有分生孢子产生(图3B)。
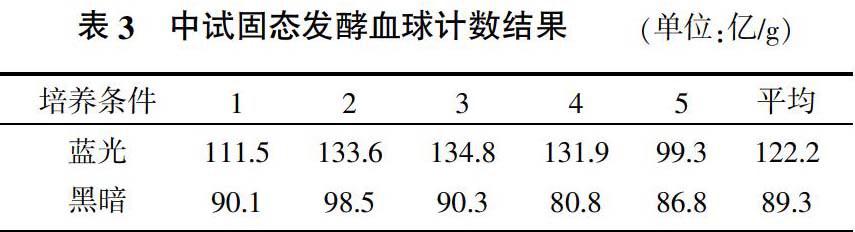
2.3 分生孢子计数结果
蓝光能明显促进产孢,实验室培养皿培养计数蓝光比黑暗增产145.9%(表2),中试固态发酵培养蓝光比黑暗增产36.8%(表3)。
2.4 蓝光光敏期结果
由图4可知,完全黑暗培养产孢量3.51亿/g,持续蓝光培养产孢量8.63亿/g,与各阶段蓝光照射后产孢量对比得出淡紫拟青霉感光期。表明淡紫拟青霉光敏期在36~96 h。
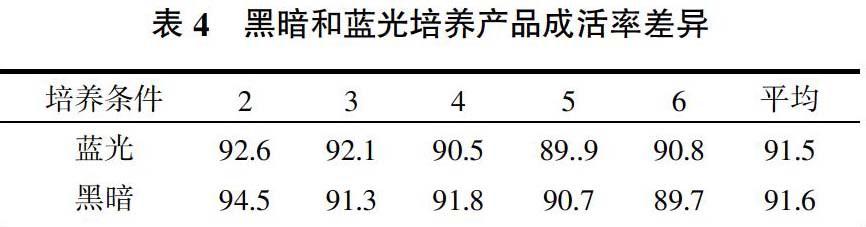
2.5 黑暗与蓝光发酵产品成活率差异
黑暗与蓝光发酵产品经6个月室温保存后萌发率无明显差异,表明通过蓝光提高分生孢子产量的方法是可行的(表4)。黄永兵等[8]用玉米秸秆生产淡紫拟青霉,发酵产品室温贮存2~11个月,孢子萌发率达90%左右,与本试验结果一致。
3 小结与讨论
实验室蓝光促进产孢效果明显好于中试,推测蓝光穿透力差导致培养箱内物料接受蓝光照射不均匀和光照强度小。持续蓝光和完全黑暗发酵产品成活率无明显差异,表明通过蓝光培养提高产孢量的方法是可行的。微生物农药使用时分生孢子数量仅是一个方面,分生孢子寄生活性相当关键,发酵产品进行线虫寄生试验还需进一步验证。
生物肥药拟青霉与化学杀虫剂相比,具有对人畜安全无毒和不污染环境等优点,对植物生长有一定促进作用,因此有着广阔的应用前景,是很具有发展前途的产业[9]。蓝光对淡紫拟青霉营养生长影响不大,能明显增加产孢量,并能促使产孢期明显提前,推测蓝光可能创造一个单纯而均一的胁迫环境,促使菌丝体营养生长转向生殖生长。本试验将蓝光作为一种有效的手段应用于淡紫拟青霉发酵生产,可为真菌提高分生孢子产量找到一种新的技术突破口。
参考文献:
[1] 姜培增,李宏园,陈铁保.淡紫拟青霉防治植物线虫研究进展[J].中国农业科技导报,2006,8(6):38-41.
[2] MIYAKE T,MORI A,KII T,et al. Light effects on cell development and secondary metabolism in Monascus[J].Journal of Industrial Microbiology and Biotechnology,2005,32(3):103-108.
[3] S?魣NCHEZ-MURILLO R I,TORRE-MART?魱NEZ M DE L,AGUIRRE J,et al. Light-regulated asexual reproduction in Paecilomyces fumosoroseus[J].Microbiology,2004,150:311-319.
[4] 刘杏忠,刘文敏,张东升.定殖于大豆胞囊线虫的淡紫拟青霉生物学特性研究[J].中国生物防治,1995,11(2):70-74.
[5] 朱俊晨,王小菁.蓝光促进黑曲霉分生孢子发育和产糖化酶的研究[J].微生物学报,2005,45(2):275-278.
[6] 李贵正,刘纪臣,李新柱,等.1种创新单孢子分离及霉菌生长形态观察方法[J].江苏农业科学,2016,44(2):390-391.
[7] 沈 萍,范秀荣,李广武.微生物学实验[M].北京:高等教育出版社,1996.
[8] 黄永兵,肖炎农,黄 蓉,等.应用玉米秸秆生产淡紫拟青霉36-1菌株孢子[J].中国生物防治,2007,23(4):338-342.
[9] 林茂松,沈纪冬,文 玲,等.淡紫拟青霉代谢产物生理活性物质分析和生物测定[J].云南农业大学学报1999,14(S1):70-74.

