酵母葡聚糖抑菌活性初探
,,,
(河南牧业经济学院,河南 郑州 450011)
酵母葡聚糖是一种具有很强的免疫活性类多糖,其免疫活性可增强机体对细菌、真菌、病毒及寄生虫的抵抗感染能力,同时在促进机体伤口愈合和加强机体抗辐射等方面都具有显著的作用, 是一种优良的生物调节剂( BRMs) 。目前国内外学者通过生物酶处理和化学修饰的方法增溶酵母葡聚糖,但对酵母葡聚糖的抑菌性研究则偏少, 本试验就酵母多糖对细菌的抑菌效果进行初步探讨,为其后期的研究及实践应用推广提供一定的理论参考。
1 材料
1.1 菌种
啤酒酵母、大肠杆菌、沙门氏菌、葡萄球菌、黑曲霉、枯草芽孢杆菌等,由西北农林科技大学微生物实验室馈赠。
1.2 各种培养基的制备
酵母菌培养基: 酵母粉30g、琼脂45g、葡萄糖40g、蛋白胨45g、蒸馏水1500 mL、pH6.3、121℃高压灭菌30min;霉菌培养基:马铃薯200g、琼脂20g、葡萄糖30g、水1000mL,煮沸30min,pH6.7,121℃高压灭菌30min。细菌培养基: 蛋白胨20g、琼脂40g、牛肉膏10g、NaCl 10g、蒸馏水1000 mL、pH7.3,121℃高压灭菌30min。
1.3 酵母葡聚糖的制备
称取酵母粉1000g溶于1000mL、6%的NaOH溶液中,加热搅拌4h,冷却至室温,离心(4000 r/min,30min);吸弃上清液,将溶解的酵母用1000mL、3%的NaOH溶液进行悬浮, 然后将其加热至90℃剧烈搅拌1.5h, 待冷却至室温后离心(4000r/min,30min);吸弃上清液,然后加入11%的HCl充分混匀,室温静置2h,离心(4000 r/min,30min);吸弃上清液,首先用H2O2洗涤3次,95%乙醇浸洗1.5h, 再用无水乙醇脱水3次, 37℃干燥12h, 所得酵母葡聚糖。
1.4 酵母葡聚糖水溶液的制备
在所制得的酵母葡聚糖中添加一定比例的甲酸, 然后80℃降解1.5h后继续加热去除甲酸,待冷却至室温,对所得溶液通过超滤膜进行过滤,调节过滤浓缩液的pH值至7;65℃处理浓缩液20min后,将其冷冻干燥即可获得易溶于水的酵母葡聚糖, 配制浓度45mg/mL酵母葡聚糖溶液以备用。
2 方法
2.1 菌悬液的制备
将菌种接种于培养基上,并在培养皿上作以标记。细菌、霉菌和酵母菌分别置于37℃培养箱内进行培养24h。分别挑取已经活化的菌种置入无菌生理盐水中,摇匀,制成菌悬液,调整其浓度为106-107cfu/mL,以备用。
2.2 酵母葡聚糖最低抑菌浓度的测定
将酵母葡聚糖水溶液分别稀释成浓度为 20、10、5、2.5、1.25 和0.625 mg/mL的稀释液, 分别吸取各稀释液0.5 mL和菌悬液0.1 mL, 加在固体培养基上,混合后加热至60℃,充分混匀,待其冷却后,置于37℃恒温培养箱中进行观察、培养,以不生长细菌的酵母葡聚糖溶液最低浓度为最小抑菌浓度(见表1)。

表1 酵母葡聚糖溶液最低浓度为最小抑菌浓度(MIC)
注:“-”表示无菌生长;“**”表示有少量菌落生长;“***”表示有不超过1/3平皿面积的菌落生长;“****”表示有不超过1/2平皿面积的菌落生长;“*****”表示有超过1/2平皿面积的菌落生长。
2.3 pH值对酵母葡聚糖抑菌效果的影响
取5mL其浓度为106-107cfu/mL的酵母葡聚糖溶液于烧杯中,用0.1mol/mL的NaOH和 0.1mol/mL的HCl,调制成不同pH值的酵母葡聚糖溶液:pH分别为 3、4、5、6、7、8。将滤纸片(121℃高压灭菌、30 min)放入其中均浸泡30min,水作为空白对照。得出不同pH 值对酵母葡聚糖抑菌效果的影响(见表2)。
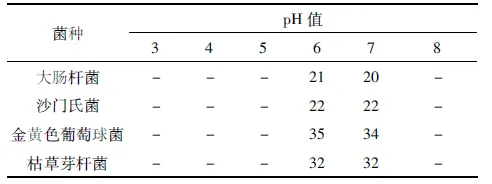
表2 pH值对酵母葡聚糖抑菌效果的影响(n=6)
2.4 温度对酵母葡聚糖抑菌效果的影响
分别吸取5mL其浓度为106-107cfu/mL的酵母葡聚糖溶液入4个烧杯中, 将滤纸片(121℃高压灭菌、30 min)放入其中,分别在25、50、75和100℃水中浸泡60min, 检测不同温度情况下滤纸片抑菌圈的大小(见表3)。
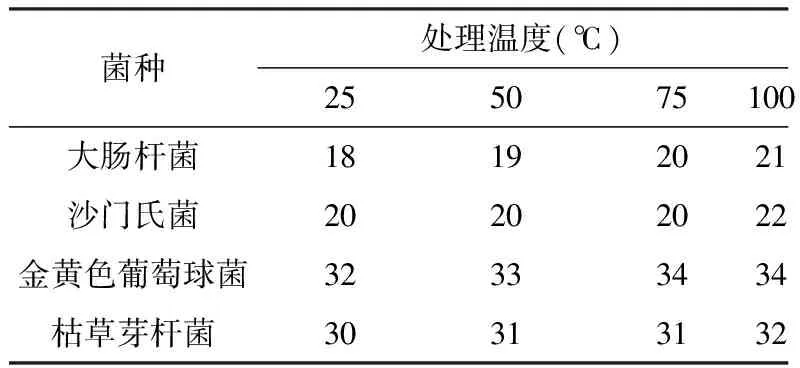
表3 不同温度对酵母葡聚糖抑菌效果的影响(n=6)
3 结果与分析
由表2可看出,酵母葡聚糖对枯草芽孢杆菌、葡萄球菌、沙门氏菌和大肠杆菌的最低抑菌浓度分别为10、10、20和20mg/mL,随着溶液浓度的不断增加,其抑菌效果也随之增强。酵母葡聚糖对细菌的抑制作用依次为:大肠杆菌<沙门氏菌<枯草芽孢杆菌<金黄色葡萄球菌;由表3可看出, 温度对酵母葡聚糖的抑菌作用有一定的影响, 随着温度的升高,酵母葡聚糖的抑菌效果也增加。由表4可看出, pH值在6.0-7.0范围内时,酵母葡聚糖抑菌效果最为明显,同时被视为酵母葡聚糖抑菌的最适pH值。实验结果显示:酵母葡聚糖对黑曲霉和啤酒酵母没有明显的抑制作用,而对大肠杆菌则具有明显的抑制作用;温度对酵母葡聚糖的抑菌效果呈正相关;pH值也影响酵母葡聚糖的抑菌效果,在pH6.7时,酵母葡聚糖的抑菌效果最好。
参考文献:
[1]Benkova M, roskova Z, ltys J, et al. Effect of glucan preparation on immunocompetent cells and phagocytic ability of bloodleucocytes in experimental ascariosis of pigs[J]. Vet Parasitol,2002(42): 157-166.
[2]T.H.Nguyen G.H.Fleet P.L.Rogers. Composition of the cellwalls of several yeast species[J].Appl Microbiol Biotechnol,2008(5): 206- 212.
[3]P.Thanardkit et al.Glucan from spent brewer's yeast: preparation, analysis and use as a potential immunostimulant in shrimpfeed[J].World Journal of Microbiology & Biotechnology,2010(2): 527- 539.
[4]王淼,丁霄霖.葡聚糖生物活性与结构的关系[J].无锡轻工大学学报,2005,16(2): 90- 94.
[2]KERY V, KOGAN G, ZAJACOVA K, et al. Hydrolysis ofyeast cell wallglucan by extracellular β-(1,3)-glucanase fromAspergillus niger [J].Enzyme Microbiology Technology,2001(1): 87- 90.
[6]杜连祥,等.工业微生物学实验技术[M].天津: 天津科学技术出版社,2002.
[7]张庭廷, 潘继红, 聂刘旺,等.金樱子多糖的抑菌和抗炎作用研究[J].生物学杂志, 2008(2): 41-42.
[8]王忠民, 王跃进, 周鹏. 葡萄多糖抑菌特性的研究[J].食品发酵与工业,2007,31(1): 77- 79.
[9]Lipke PN, Ovall R. Cell wall architecture in yeast: New structure and new challenges[J]. Journal of Bacteriology, 2004(15): 3735-3740.
[10]Manners D J, Masson A J, Patterson J C.Structure of β-(1,3)-D-glucan from yeast cell walls[J]. Biochemical Journal, 2007(1): 19-30.
[11]Fleet G H, Manners D J. Isolation and composition of an alkali-soluble glucan from the cell walls ofSaccharomyces cerevisiae[J]. J Gen Microbiol,2006(3): 180-192.
[12]柳田直彦, 等. 酵母解剖[M]. 北京:北京科学出版社,1990.
[13]Bao X Liu C, Fang J. Structural and immunological studies of a major polysaccharide from spores of Ganoderma lucidum(Fr.)Karst[J].CarbohydrRes, 2006(1): 67-74.

