降低水分活度延长荞麦半干面保质期的研究
白艺朋 郭晓娜 朱科学 周惠明
(江南大学食品学院,无锡 214122)
荞麦作为一种杂粮作物,具有降血压血脂、防止心血管疾病和治疗便秘的功效[1]。以荞麦为原料,部分替代小麦粉制作的荞麦半干面,是一种新型方便面制品,煮食方便、荞麦风味浓郁[2],可以满足当前消费者对面条制品营养、功能化的消费需求。然而,荞麦半干面含水量一般在20%~28%,属于中等水分面制品,水分活度大、常温储藏过程中微生物易生长繁殖、货架期较短[3]。目前,常采用添加酒精、化学防腐剂和加酸酸化等方法,来延长半干面条制品货架期。但是,面条开袋时强烈的酒精味以及防腐剂的添加,造成消费者的购买欲望不高[4]。
水分是影响食品货架期的关键因素,人们常采用干燥或添加水分活度降低剂的方法增加食品稳定性和安全性,以达到长期保藏食品的目的,如挂面、酱料、腌制品[5]。降低水分含量有利于食品的长期保藏,但是过度的脱水会导致食品色香味、营养价值和感官品质的损失。近年来,大量研究认为水分活度比水分含量更能反映食品的储藏稳定性,卞科等[6]认为食品中微生物的生长代谢,以及生化反应都与水分活度密切相关。Baker等[7]公布了一种意大利半干面加工及保鲜方法的专利,通过适度脱水方法将含水量控制在15%~28%,并结合其他保鲜手段将面条保质期延长至1年。吴克刚等[8]通过添加6%的海藻糖和山梨糖醇复配液,有效降低了面条的水分活度,抑制了面条储藏过程中微生物的生长。屠振华等[9]研究了丙二醇对面制品货架期内水分含量的影响,结果表明丙二醇能显著减缓水分的迁移速率、降低水分的流动性,从而维持面制品良好的货架期品质。荞麦半干面属于新型杂粮面制品,微生物菌落构成更为复杂、营养物质更加丰富,关于降低水分活度对荞麦半干面保质期的影响鲜见报道。因此,本实验研究了水分活度对荞麦半干面中微生物的影响,多元醇和盐类降低荞麦半干面水分活度的效果,探讨了使用复合水分活度降低剂对延长荞麦半干面保质期的影响。
1 材料与方法
1.1 主要材料
荞麦粉:蛋白质质量分数12.87%,含水量13.54%,荞麦籽粒经磨碎过80目筛,产地为内蒙古赤峰。高筋小麦粉:蛋白质质量分数11.83%,含水量13.92%:益海嘉里粮油有限公司。丙二醇、山梨糖醇、乳酸钠:郑州博研生物科技有限公司;焦磷酸钠、三聚磷酸钠、六偏磷酸钠:国药集团化学试剂有限公司;食盐:市售。脱氧剂(吸氧量为200 mL):东莞市欣荣天丽科技实业有限公司。
1.2 主要设备与仪器
谷物杂粮磨粉机:CLF-150,浙江省温岭市创立药材器械厂;5K5SS型和面机:美国Kitchen Aid公司;JMTD-168/140型实验面条机:北京东孚久恒仪器技术有限公司;GZX-9246 MEB型数显电热干燥箱:上海博迅实业有限公司医疗设备厂;DZ-300/5SA微电脑自动真空包装机:东莞市益健包装机械有限公司;PE/TIE/PVDC/TIE/PE(100 μm;23 cm×25 cm)五层共挤收缩袋,透氧量与透湿量分别为(6.89±0.03) cm3/m2·24 h·0.1 MPa和(7.71±0.01)g/m2·24 h:郑州博利达塑料包装有限公司;LabSwift-aw型水分活度仪:瑞士NOVASINA公司;MesoMR23-060V-I型低场核磁共振分析仪:苏州纽迈分析仪器股份有限公司;TA-XT2i型物性测试仪:英国Stable Microsystems公司。
1.3 方法
1.3.1荞麦半干面的制作与储藏
荞麦粉、小麦粉(3∶7)→混粉(15 min)→加水(32%)和面→面团→静置(25 ℃、20 min)→延压→切条→适度脱水(25 ℃自然脱水不同时间或105 ℃脱水处理3.5 min)→缓苏(25 ℃、3 h)→包装(400 g/袋;内置200 mL的脱氧剂)→25 ℃储藏。
1.3.2荞麦半干面水分活度的测定
参考Schebor等[10]的方法,取一定量的荞麦半干面条于研磨杯中粉碎,迅速将面条粉装入自封袋封口,防止水分蒸发,室温下静置10 min以保证测定水分活度时样品温度为室温。每次测试取3.0 g左右的样品于水分活度测试盒中,置于水分活度仪测试腔体中进行测定。
1.3.3荞麦半干面吸湿等温曲线的制作
按照Li等[11]的方法,剪开荞麦半干面包装,将样品于研磨杯中粉碎,平均分装于多个铝盒中,置于烘箱中,每隔一定时间取出一个铝盒,将面条转移至自封袋中于25 ℃环境下均湿后,同时测定其水分含量及水分活度,得到一系列不同水分含量的荞麦半干面所对应的水分活度,以荞麦半干面的水分活度为横坐,水分含量为纵坐标,利用Excel绘制其吸湿等温线。
1.3.4荞麦半干面T2测试
称取(1.00±0.01) g荞麦半干面条,放入10 mL气相测试瓶中,用生料带封好瓶口,以防止测试过程中水分挥发,再将装有样品的气相瓶轻轻置于直径为25 mm的测试管中,最后一起置于低场核磁共振测试腔体中进行测试。测试程序为多层-回波(CPMG)序列参数设置如下:采样点数(TD)为40 004,回波时间Echo Time=0.100 ms,采样间隔时间TW=3 000 ms,频率SF=100 kHz,回波个数Echo Count=4 000,累加次数NS=12,利用仪器自带的程序T2-InvfitGeneral进行数据拟合反演得到T2弛豫图谱。
1.3.5荞麦半干面中菌落总数的测定
菌落总数参照GB 4789.2—2010测定。
1.3.6荞麦半干面酸度值测定
参考Ren等[12]的方法称取适量荞麦半干面样品,用粉碎机粉碎过100目筛备用。取面条粉15 g,放入250 mL具塞锥形瓶,加水150 mL浸提,立刻加入5滴三氯甲烷,加塞并摇匀,置于摇床上(100r/min)室温下提取80 min。提取结束后用滤纸将其过滤,收集滤液10 mL于100 mL锥形瓶中,分别加水20 mL和酚酞指示剂3滴,用氢氧化钠标准液滴定至红色,30 s内不褪色为止,记录所消耗标准液的体积,并做空白实验,记录消耗标准液体积,荞麦半干面中酸度值的计算公式:
式中:AV为荞麦半干面酸度值/mL/10 g;V1为浸提样品加水体积/mL;V2为用于滴定的样品滤液体积/mL;V3为样品消耗氢氧化钠标准溶液体积/mL;V4为空白消耗氢氧化钠标准溶液体积/mL;c为氢氧化钠标准溶液浓度/mol/L;M为荞麦半干面质量/g。
1.3.7荞麦半干面感官评价
感官评价小组成员由8名女性与4名男性组成,均已进行感官评价培训,对储藏期间荞麦半干面生面条的总体可接受度(依据色泽、气味和表面状态综合评价)指标进行评价。采用9点数字标度为评分标尺,1代表极不喜欢,9代表极喜欢,5为可接受的最低限值。
1.3.8荞麦半干面质构特性测定
取长度为22 cm的荞麦半干面25根,放入450 mL的沸水中煮至最佳蒸煮时间(330 s)后用漏网捞出,沥水15 s后迅速用5片滤纸吸干面条表面残余的水分,将面条用保鲜膜双层覆盖,15 min内完成同批次样品的测试。测试探头选HDP/PFS,测前速度设为2 mm/s,测试中、后速度均设为0.8 mm/s,形变量为75%,感应力为5 g,两次压缩的时间间隔为1 s。拉断力的测试探头选择A/SPR型,初始距离和感应力分别设为50.0 mm、5 g,测前和测中速度均设置为2 mm/s,测后速度为10 mm/s,拉伸距离为90.0 mm。每个样品做5次平行,取其平均值。
1.3.9荞麦半干面T2-加权成像测试
将样品置于内径为15 mm测试管中,用生料胶带封口。测试程序为多层-自旋-回波(MSME)脉冲序列,测试条件为:回波时间为15.0 ms,单层扫描厚度为5.0 mm,重复采样间隔时间为3 000 ms,单次实验扫描次数为32,视野为FOV X=FOV Y=100 mm,测试温度为32 ℃,图像矩阵为128×64,得到荞麦半干面的T2-加权灰度图。
1.3.10数据统计与分析
每批次荞麦半干面重复制作5个平行样品,每项指标均采取随机测试3个平行样品,取3次测试结果的平均值做统计分析;采用SPSS 17.0对所得数据进行方差分析和显著性分析;采用Excel和Origin 8.5制图。
2 结果与分析
2.1 水分活度对荞麦半干面中微生物生长速率的影响
用紫外灯杀菌的方式控制无菌室的环境,按1.3.1中的配方,刚制作的荞麦面条悬挂于无菌室环境中自然脱水(T=25 ℃,H=65%),得到不同水分活度的荞麦半干面(水分活度分别为0.899、0.912、0.928、0.940、0.946、0.952、0.968、0.983、0.987、0.989、0.994),初始菌落总数为3.2 lgCFU/g,储藏24 h后分别为3.8、3.9、4.4、5.0、5.9、6.7、7.6、7.8、7.9、8.0、8.1 lgCFU/g,以24 h内荞麦半干面中菌落总数的增加量表示微生物的生长速率,结果如图1所示。随着水分活度的增大,荞麦半干面中微生物的生长速率呈现整体增加的变化趋势。其中,水分活度在0.912~0.968之间变化时,微生物生长速率呈线性增加(R2=0.953 2),当水分活度超过0.983时微生物速率增加的趋势变得缓慢。Beauchat等[13]研究认为水分活度是决定微生物生长所需要水的下限值,大部分腐败细菌在水分活度0.91以下时停止生长,霉菌生长所需要的水分活度较低(>0.80),当水分活度降到0.70以下时绝大多数微生物已不能生长。含水量为22.50%左右的荞麦半干面的水分活度仍高达0.940左右,微生物增殖迅速,货架期较短。为了抑制微生物的生长繁殖,可采取添加水分保持剂的方法,降低荞麦半干面的水分活度,以达到延长荞麦半干面货架期的目的。

图1 水分活度对荞麦半干面中微生物生长速率的影响
2.2 多元醇和盐类对荞麦半干面水分活度的影响
参考GB 2760—2014的规定,选取丙二醇、山梨糖醇、乳酸钠、食盐和复合磷酸盐(焦磷酸钠∶三聚磷酸钠∶六偏磷酸钠=27∶45∶28)水分活度降低剂添加到荞麦半干面中,其水分活度的变化如图2所示。所有样品的含水量均在22.50%~22.80%之间,由图2可知,不添加任何水分活度降低剂的荞麦半干面水分活度为0.938,其含水量为22.50%,多元醇和盐类均具有显著降低荞麦半干面水分活度的作用。盐类具有极佳的亲水性,能牢牢的锁住水分,降低食品表面的水分蒸汽压,而常常被用于酱料、肉制品的保藏[14],但是由于盐类的种类不一样,其保水的作用效果也有所差别。对比图2可知,食盐的作用效果最好,可以将其从0.941降至0.900。多元醇属于多羟基物质,大分子类亲水物质,亦能结合水分子,使其移动性变差。Cui等[15]研究也发现复合磷酸盐、甘油和山梨糖醇具有协同降低水分活度的作用。然而,单独添加一种水分活度降低剂不能将水分活度控制在安全范围内,因此实验选择0.15%丙二醇、3%山梨糖醇、0.24%乳酸钠、0.7%复合磷酸盐和2.4%食盐进行复合添加(添加量为占面粉总质量的百分比),考察其协同效果。

图2 不同水分活度降低剂对荞麦半干面水分活度的影响
2.3 复合水分活度降低剂对荞麦半干面中水分活度及状态的影响
复合水分活度降低剂由丙二醇、山梨糖醇、乳酸钠、复合磷酸盐和食盐按照上述百分比含量组合而成,各水分活度降低剂的添加量均不超过GB 2760—2014中所允许的最大添加量,并符合食品安全法规的要求。食品的储藏稳定性取决于食品中水分的结合状态和水分活度的大小,水分与非水分组分的结合越紧密,水分活度越低,食品就越容易保藏;反之,食品就容易腐败变质。吸湿等温线是描述食品中水分含量与水分活度关系的曲线,通过绘制空白组和实验组荞麦半干面各自的吸湿等温线,可以反映水分活度降低剂对荞麦半干面水分活度的影响[16]。
荞麦半干面中吸湿等温线的变化如图3所示,其中空白组未添加任何水分活度降低剂的荞麦半干面,实验组为添加了复合水分活度降低剂的荞麦半干面。由图3a可知,与空白组相比,实验组样品的吸湿等温线向上移动,即当实验组样品和空白组样品中含水量均为22.50%时(如图3a中虚线所示),前者水分活度为0.849,而后者水分活度为0.945,说明添加了复合水分活度降低剂的荞麦半干面中水分的结合状态发生了改变,与非水组分结合的更加牢固,水分蒸汽压减小。Lilia等[17]研究发现食盐和山梨糖醇具有降低食品中水分活度的效果,使水分子与大分子物质结合程度增强,水分流动性变差。

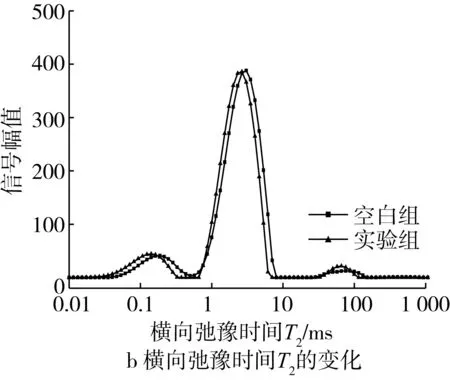
注:空白组为未添加水分活度降低剂的荞麦半干面;实验组为添加了0.15%丙二醇、3%山梨糖醇、0.24%乳酸钠、0.7%复合磷酸盐和2.4%食盐复合水分活度降低剂的荞麦半干面,余同。图3 复合水分活度降低剂对荞麦半干面水分活度和状态的影响
吸湿等温线从宏观层面表征了复合水分活度剂对荞麦半干面中水分活度的影响,利用低场核磁共振技术监测水分子横向弛豫时间的变化可以从分子层面表征荞麦半干面中水分结合状态的变化,进一步阐述水分活度降低剂的作用机制。横向弛豫时间T2越大,说明食品中所含水分子的自由度越大,水分易于流动;T2越短,则说明水分与非水组分结合强度越大,不易流动。荞麦半干面含水量为22.50%中水分的T2图谱如图3b所示,2个样品均出现3个峰,说明水分活度降低剂的加入并没有改变荞麦半干面中水分的3种分布状态。然而,与空白组相比,实验组样品的水分弛豫图谱整体向左移动,说明荞麦半干面中水分的自由度降低,流动水向结合水转化,多元糖醇的羟基基团与水分子之间能形成氢键,降低水分子的移动能力[16]。Umbach等[18]研究认为面团中蛋白对水分的结合能力要强于淀粉,对水分子的移动性影响较大,而复合磷酸盐和食盐溶于水后均可以电离出Na+,一定浓度的Na+能消除蛋白的疏水性,使水分更好的与蛋白结合,水分子自由度减小[19],使荞麦半干面宏观表现为水分活度的降低。
2.4 降低水分活度对荞麦半干面菌落总数的影响
据文献报道将水分活度降低到0.90以下时,能够有效抑制食品中腐败细菌的生长繁殖[20]。为了验证降低水分活度延长荞麦半干面货架期的效果,将未添加任何水分活度降低剂的荞麦半干面(空白组)和添加复合水分活度降低剂的荞麦半干面(实验组)均采用脱氧包装,常温储藏期间检测其菌落总数的变化。结果如图4所示,与空白组(含水量、水分活度和初始含菌量分别为22.45%、0.940、3.2 lgCFU/g)相比,实验组荞麦半干面(含水量、水分活度和初始含菌量分别为22.51%、0.849、3.1 lgCFU/g)在储藏36 d后菌落总数才超过检测阈值,说明水分活度降低剂将荞麦半干面水分活度降低至0.850以下时,能有效抑制腐败微生物的生长,延长其保质期。

图4 储藏期间荞麦半干面菌落总数的变化
2.5 降低水分活度对荞麦半干面酸度值的影响
面条在储藏过程中,由于微生物的生长代谢、碳水化合物的降解以及酶促反应的共同作用,水溶性的磷酸、酸式磷酸盐、乙酸和乳酸会逐渐积累,引起面条酸化,食味变差。酸度值是表征面条酸化程度的一项重要指标,DB 31/42-2009中以酸度值为指标对半干面制品的货架期进行了限定,酸度值超过4 mL/10 g时,即认为半干面已不能流通售卖。荞麦半干面储藏期间酸度值的变化如图5所示。空白组(含水量、水分活度和初始酸度值分别为22.42%、0.939、1.27 mL/10 g)在储藏18 d时超过检测阈值,而实验组(含水量、水分活度和初始酸度值分别为22.50%、0.849、1.40 mL/10 g)具有更长的货架期(48 d)。荞麦半干面中水溶性酸的积累与微生物代谢产酸,蛋白质、碳水化合物的降解有关,大分子物质的降解需要水解酶的参与,而较低的水分活度会抑制相关水解酶的活性,抑制荞麦半干面的酸化速率。
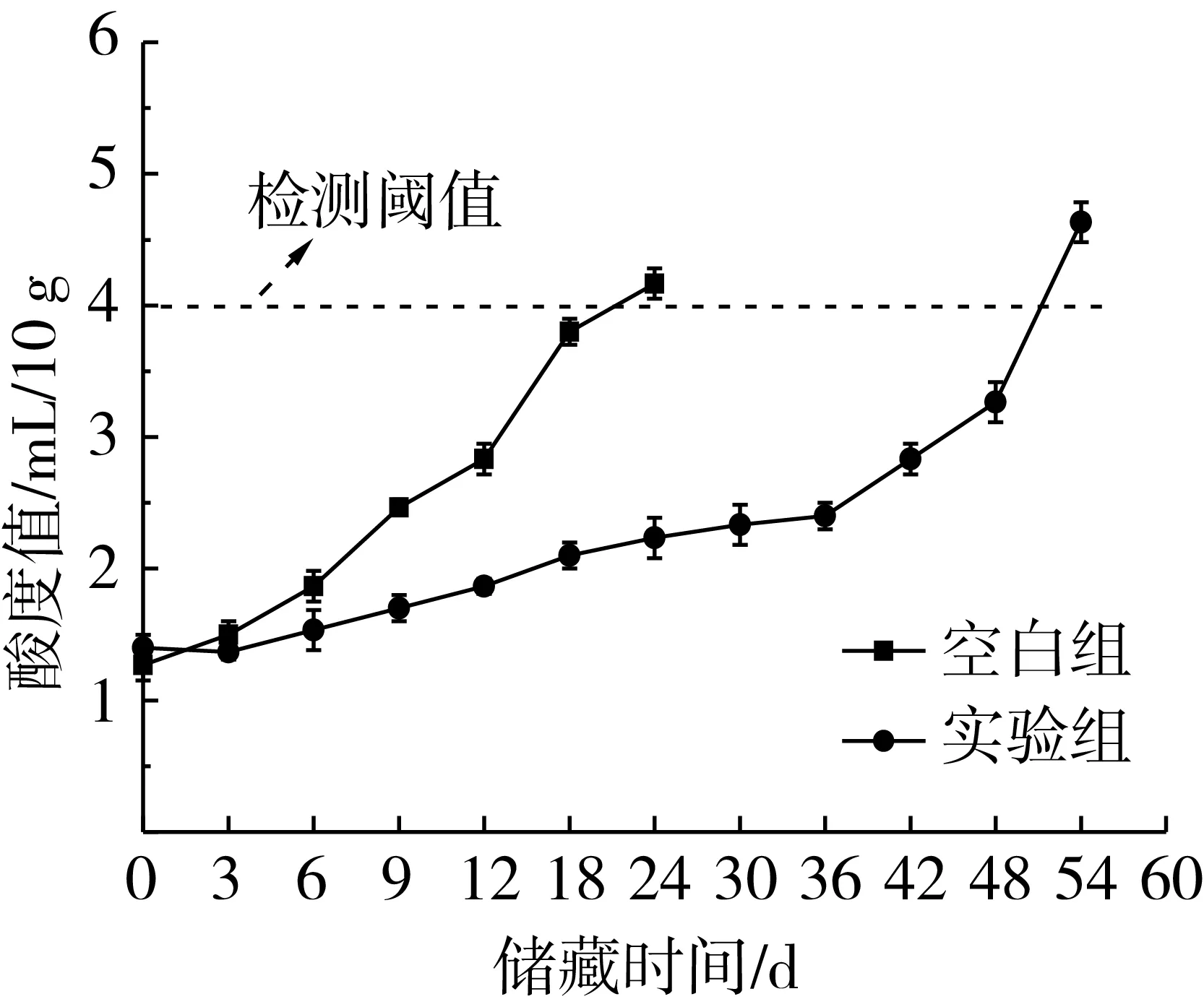
图5 储藏期间荞麦半干面酸度值的变化
2.6 降低水分活度对荞麦半干面总体可接受度的影响
感官评价能反映一种食品的使用价值与受欢迎程度。荞麦半干面储藏期间,微生物的生长繁殖和生化理化反应的进行,均引起荞麦半干面表观颜色、气味、状态的劣变,储藏期间的总体可接受度得分变化如图6所示。空白组的含水量、水分活度和初始感官得分别为22.47%、0.938、8.65,实验组含水量、水分活度和初始感官得分别为22.47%、0.938、8.77。刚制作的荞麦半干面总体接受度较高,得分为8.7分左右,具有荞麦特有的色香味,说明多元醇和盐类对荞麦半干面的感官品质无显著影响。随着储藏时间的延长,实验组感官得分下降的较慢,说明降低水分活度能抑制微生物繁殖和生化理化反应所引起的荞麦半干面感官品质的劣变。当荞麦半干面的总体可接受度得分低于5时,不被评价者接受,实验组荞麦半干面储藏54 d时失去商品价值,感官货架期延长了42 d(与空白组相比)。
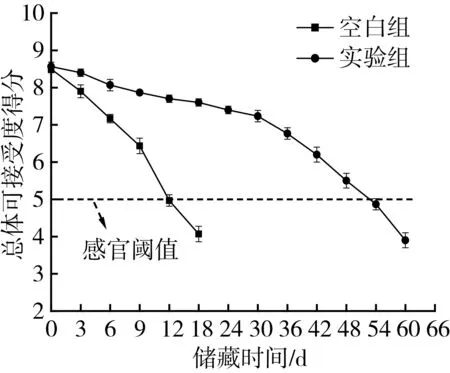
图6 储藏期间荞麦半干面总体可接受度的变化
2.7 降低水分活度对荞麦半干面质构特性的影响
面条的质构特性能客观地反映面条的食用品质,储藏期间荞麦半干面质构品质的变化如图7所示,硬度与拉断力均逐渐降低,但实验组(含水量、水分活度、初始硬度值和拉断力分别为22.46%、0.846、4 872.811 g和17.43 g)较空白组(含水量、水分活度、初始硬度值和拉断力分别为22.53%、0.941、4817.704 g和17.00 g)变化缓慢,且储藏后期与前期相比,荞麦半干面的硬度与拉断力只降低了10.4%和7.4%,隋苗苗等[21]研究认为面条在储藏期间硬度值下降30.0%时,面条可能已经变质。由此可见,较低的水分活度维持了荞麦半干面良好的货架期品质。
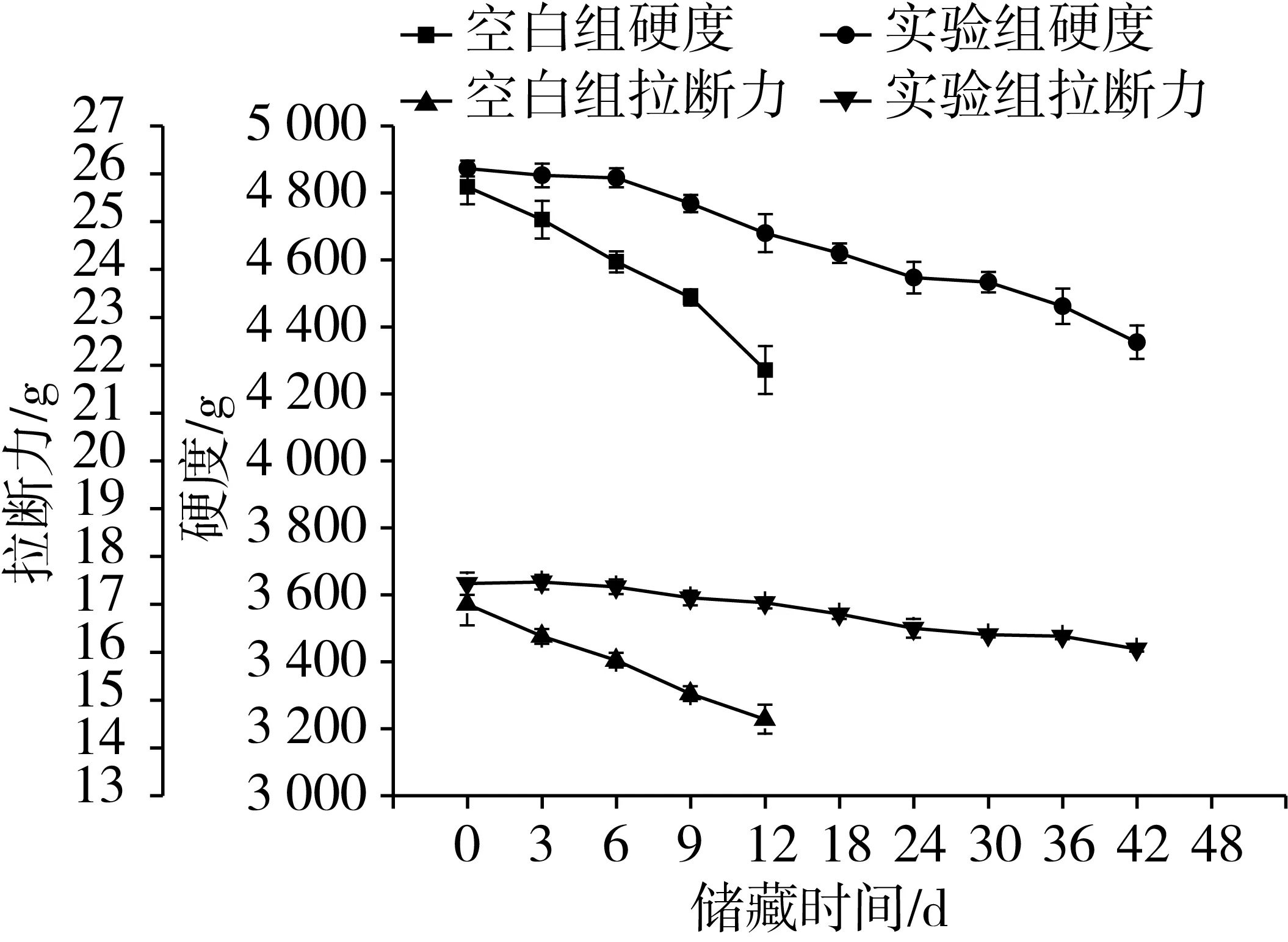
图7 储藏期间荞麦半干面质构特性的变化
2.8 降低水分活度对荞麦半干面中水分分布的影响
低场核磁共振成像是一项快速无损的检测技术,可以检测食品中水的流动性、内部结构和水分分布等,近年来被广泛应用于食品的加工和保藏研究。T2-加权灰度图突出显示食品中水分分布的具体情形。其中,亮度越大表示质子密度越大,该部分水分较多。由图8a可知,储藏期间,空白组荞麦半干面中水分不断迁移,水分分布变得不均,荞麦半干面结构逐渐被破坏。储藏6 d时内部结构开始出现黑色区域,水分发生了重新分配,微生物的生长代谢,蛋白与淀粉的降解,均会引起水分的重新分配。储藏时间的进一步增加,黑色区域逐渐增大、数量变多,这与微生物的发酵产气有关,而荞麦半干面相对致密的结构对气体具有良好的截留效果。而由图8b可知,储藏前20 d,实验组荞麦半干面中水分分布均匀,面条中无明显水分迁移现象。直到40 d时内部才出现明显黑色区域,此时荞麦半干面中微生物才开始大量繁殖,产酸产气进而引起荞麦半干面内部出现无水区域。结合储藏期间微生物的变化可知,水分活度降低剂的添加,不仅降低了水分活度,抑制微生物的生长,还阻碍了荞麦半干面储藏期间水分的迁移,这与Baik等[22]的研究相一致。

图8 储藏期间荞麦半干面水分分布的变化
3 结论
水分活度是影响荞麦半干面保质期的重要因素,其值在0.912~0.968之间时,微生物生长速率呈线性增长(R2=0.953 2)。水分活度降低剂能促进荞麦半干面中自由水与非水组分的结合,促进游离水分结构化,有效降低荞麦半干面的水分活度,其中食盐效果最优。添加复合水分活度降低剂可将荞麦半干面水分活度降低至0.850,显著抑制微生物的生长代谢,延缓酸化速率,阻碍水分迁移,延长荞麦半干面保质期至36 d,且维持了其良好的货架期品质。
[1]CAI Y Z,CORKE H,WANG D,et al. Buckwheat: Overview[J]. Encyclopedia of Food Grains, 2016, 1(1): 307-315
[2]BAI Y P, GUO X N, ZHU K X, et al. Shelf-life extension of semi-dried buckwheat noodles by the combination of aqueous ozone treatment and modified atmosphere packaging[J]. Food Chemistry, 2017, 237(15): 553-560
[3]LI M,ZHU K X,SUN Q J,et al. Quality characteristics,structural changes,and storage stability of semi-dried noodles induced by moderate dehydration: Understanding the quality changes in semi-dried noodles[J]. Food Chemistry,2016,194(194): 797-804
[4]NOBILE M D,BENEDETTO N D,SURIANO N,et al. Use of natural compounds to improve the microbial stability of Amaranth-based homemade fresh pasta[J]. Food Microbiology,2009,26(2): 151-156
[5]MA L,ZHANG M,BHANDARI B,et al. Recent developments in novel shelf life extension technologies of fresh-cut fruits and vegetables[J]. Trends in Food Science & Technology,2017,34(1): 1-8
[6]卞科. 水分活度与食品储藏稳定的关系[J]. 郑州粮食学院学报,1997,18(4): 41-48
BIAN K. The relationship between stability of food storage and water activity[J]. Journal of Zhengzhou Grain College,1997,18(4): 41-48
[7]BAKER J M. Process for preparing intermediate moisture pasta product[P]. US,6017573. 2000-06-25
[8]吴克刚,谢佩文,罗辑,等. 控制生鲜面水分活度及微生物生长的研究[J]. 粮食与饲料工业,2012,11(9): 29-31
WU K G,XIE P W,LUO J,et al. Research on controlling methods of water activity and microoranism of wet noodles[J]. Cereal and Feed Industry,2012,11(9): 29-31
[9]屠振华,徐涛,肖丽霞,等. 生湿面制品中丙二醇添加量对其货架期水分含量变化规律研究[J]. 食品工业科技,2013,34(11): 287-289
TU Z H,XU T,XIAO L X,et al. Study on water contents variation of fresh dough products with propanediol during shelf-life[J]. Science and Technology of Food Industry,2013,34(11): 287-289
[10]SCHEBOR C,CHIRIFE J. A survey of water activity and pH values in fresh pasta packed under modified atmosphere manufactured in Argentina and Uruguay[J]. Journal of Food Protection,2000,63(63): 965-969
[11]LI M,LUO L J,ZHU K X,et al. Effect of vacuum mixing on the quality characteristics of fresh noodles[J]. Journal of Food Engineering,2012,110(4): 525-531
[12]REN S,MA R,WANG N. Microbial Changes and Fresh-Keeping of Fresh Noodles under Refrigerated Condition[J]. Information Technology and Agricultural Engineering,2012,8(2): 973-980
[13]BEUCHAT L R. Microbial stability as affected by water activity[J]. Cereal Foods World,1981,26(7): 345-349
[14]SYAMALADEVI R,TADAPANENI R K,XU J, et al. Water activity change at elevated temperatures and thermal resistance of Salmonella in all purpose flour and peanut butter[J]. Food Research International,2016,81(3):163-170
[15]CUI H,XUE C,XUE Y,et al. Development of shelf-stable,ready-to-eat (RTE) shrimps ( Litopenaeus vannamei ) using water activity lowering agent by response surface methodology[J]. Journal of food science and technology,2013,50(6): 1137-1143
[16]ASGAR F,SARA A,MAHSA M. Effect of glycerol on the moisture sorption isotherms of figs[J]. Journal of Food Engineering,2009,93(4): 468-473
[17]NERI L,PITTIA P,BERTOLO G,et al. Influence of water activity and molecular mobility on peroxidase activity in salt and sorbitol-maltodextrin systems[J]. Journal of Food Engineering,2010,101(3): 289-295
[18]UMBACH S L,DAVIS E A,GORDON J,et al. Water self-diffusion coefficients and dielectric properties determined for starch-gluten-water mixtures heated by microwave and by conventional methods[J]. Cereal Chemistry,1992,45(10): 43-47
[19]TUHUMURY H C D,SMALL D M,DAY L. The effect of sodium chloride on gluten network formation and rheology[J]. Journal of Cereal Science,2014,60(1): 229-237
[20]LEDWARD D. Intermediate moisture meats[J]. Developments in meat science,1981,2(9): 159-194
[21]隋苗苗,姜秀学,金铁. 乙醇处理湿面在储藏期间TPA质构特性变化[J]. 延边大学农学学报,2013,35(3): 238-242
SUI M M,JIANG X X,JIN T. TPA textural properties change of wet dough with ethanol during storage[J]. Journal of Agricultural Science Yanbian University,2013,35(3): 238-242
[22]BAIK M Y,CHINACHOTI P. Water Self-Diffusion Coefficient and Staling of White Bread as Affected by Glycerol[J]. Cereal Chemistry,2003,80(6): 740-744.

