大脑中动脉分布区缺血性卒中患者的临床和影像学特征及复发危险因素
张长青,王伊龙,王春雪,4,刘丽萍,5,赵性泉,王拥军
我国颅内大动脉粥样硬化所致缺血性脑血管病的比例远高于西方白人[1-2]。国人高血压的患病率较高而控制达标率较低可能是导致上述差异的主要原因,另外人种遗传学差异也是可能的原因[3-5]。大脑中动脉(middle cerebral artery,MCA)是国人颅内动脉狭窄最常见的部位,因此MCA分布区脑梗死也是颅内动脉狭窄所致脑梗死最常见的类型[1,6]。目前关于国人大样本量MCA分布区脑梗死患者的临床和影像学特征及复发危险因素的研究较少,而且多数关于缺血性卒中复发危险因素的研究未将新发脑梗死灶的影像学分布特征和责任脑动脉狭窄程度考虑在内[7-9]。本研究的目的是分析MCA分布区非心源性缺血性卒中患者的临床和影像学特征及复发的危险因素。
1 对象与方法
1.1研究对象 研究人群来自2007年10月-2009年6月多中心、前瞻性的中国颅内动脉粥样硬化研究(Chinese IntraCranial AtheroSclerosis Study,CICAS)[1],该研究共连续纳入2864例在22家医院就诊的发病7 d内的非心源性缺血性卒中或短暂性脑缺血发作(transient ischemic attack,TIA)患者。本研究从中入选新发梗死灶的责任脑动脉为MCA的缺血性卒中患者。MCA分布区缺血性卒中患者的定义为新发梗死灶均位于一侧MCA分布区,同侧颈内动脉无明显狭窄或狭窄程度不超过50%,且无心源性栓塞的危险因素[10-11]。排除病情不稳定而需要监护的患者、入院前改良Rankin量表(modified Rankin Scale,mRS)评分>2分的患者、因为主观或客观原因无法行磁共振成像(magnetic resonance imaging,MRI)检查者、有心源性栓塞危险因素(包括心房颤动、瓣膜性心脏病、心脏瓣膜置换术后等)的卒中患者、病因不明或其他病因的卒中患者。同时本研究还排除了CICAS研究中发病后确诊为TIA的患者、发病后行静脉或动脉溶栓或血管内介入治疗的患者、后循环脑梗死患者、新发脑梗死责任动脉非MCA的患者。
1.2研究方法 收集患者脑血管病的危险因素以及发病时的主要症状及体征,评价患者的头颅MRI确定急性脑梗死灶的影像学分布特征(单发或多发急性梗死灶、分水岭梗死、小的皮层梗死灶、流域性梗死、穿支动脉梗死)、责任MCA有无狭窄、缺血性卒中的停止卒中研究(stop stroke study,SSS)低分子肝素治疗急性卒中试验(trial of org 10 172 in acute stroke treatment,TOAST)病因分型[12]。
入组患者均完成头颅MRI的轴位T1加权像、T2加权像、液体衰减反转恢复序列、三维时间飞跃法磁共振血管成像(magnetic resonance ang iog raphy,MR A)以及弥散加权成像(diffusion weighted imaging,DWI)序列。通过MRA评价颅内动脉是否存在狭窄及狭窄程度,使用对比增强MRA或彩色多普勒超声评价颅外动脉是否存在狭窄以及狭窄程度。
DWI序列上见到≥2个互不相邻的高信号病灶定义为多发性急性梗死灶。分水岭梗死分为内分水岭梗死和皮层分水岭梗死。内分水岭梗死是指位于半卵圆中心或放射冠并平行于侧脑室的串珠样分布的新发梗死灶。皮层分水岭梗死可分为前皮层分水岭梗死和后皮层分水岭梗死[13]。小的皮层梗死是指位于MCA皮质支分布区但不位于分水岭区的最大直径<2 cm的皮层小梗死灶。穿支动脉梗死是指位于MCA中央支分布区(纹状体和内囊)的梗死灶[11]。流域性梗死是指最大直径≥2 cm的梗死灶,累及皮层和皮层下结构,并位于1个或1个以上的脑动脉分布区[14]。
1.3随访和临床预后评估 主要的预后指标是1年内缺血性卒中或TIA的复发情况。在脑梗死患者发病3个月、6个月和1年时对患者进行电话随访。TIA复发的定义是新发的脑或视网膜缺血所致的持续不超过24 h的局灶性神经功能缺损。缺血性卒中复发的定义是突发神经功能缺损恶化导致美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)评分较前增加4分或以上,或是新发的脑血管病所致的持续超过24 h的局灶性神经功能缺损,并且在头颅计算机断层扫描(computed tomography,CT)或MRI上无出血灶。
对于未住院的可疑的缺血性脑血管病复发的患者,由研究协调人和主要研究者共同来确定患者是否为缺血性脑血管病复发。所有再住院的复发的缺血性卒中或TIA患者根据病历记录的NIHSS评分或是否存在新发的神经功能缺损结合患者的头颅CT或MRI影像来确定。
1.4统计学分析 计数资料采用频数、百分数表示,两组数据比较时使用χ2检验;非正态分布的计量资料采用中位数、四分位数间距表示,两组数据比较时使用曼-惠特尼秩和检验。使用SAS V9.1软件进行分析。采用双侧检验,P<0.05认为差异有统计学意义。所有单因素分析有意义的变量及前人研究有重要意义的变量纳入多因素Logistic回归分析。
2 结果
2.1基线特征 研究共入组926例MCA分布区缺血性卒中患者,占缺血性卒中患者的比例为46.8%(926/1978)。患者平均年龄(61.1±11.6)岁。926例患者中最常见的首发临床表现是中枢性面瘫(70.5%)和偏侧肢体无力(59.1%)(表1)。723例(78.1%)有高血压,298例(32.2%)有糖尿病,695例(75.1%)有高脂血症。分别有447例(48.3%)、372例(40.2%)和341例(36.8%)有70%以上程度的责任MCA狭窄、多发急性梗死灶和分水岭梗死。536例(57.9%)缺血性卒中的病因分型为大动脉粥样硬化性(表2)。责任MCA狭窄≥70%的患者有多发急性梗死灶、分水岭梗死、内分水岭梗死的比例分别达到了75.6%、70.9%和64.2%,而责任MCA无狭窄或狭窄程度<70%的患者有单发急性梗死灶、MCA穿支分布区梗死灶的比例分别达到了92.9%和96.2%(表3)。
2.21年内缺血性卒中或TIA复发的危险因素35例患者(3.8%)一年内缺血性卒中或TIA复发。单因素分析发现:冠状动脉粥样硬化性心脏病病史、缺血性卒中病史或卒中病史、缺血性卒中发病前3个月内反复TIA为患者1年内复发的危险因素(表2)。
多因素Logistic回归分析发现:冠状动脉粥样硬化性心脏病[比值比(odds ratio,OR)7.55,95%可信区间(confidence interval,CI)2.85~20.0,P<0.001]或缺血性卒中病史(OR3.49,95%CI1.52~8.01,P=0.003)、缺血性卒中发病前3个月内反复短暂性脑缺血发作史(OR22.7,95%CI8.35~61.6,P<0.001)、新发梗死灶为多发(OR5.26,95%CI1.33~20.8,P=0.018)是患者1年内复发的危险因素(表4)。

表1 大脑中动脉分布区缺血性卒中患者入院时的症状和体征
3 讨论
中国人颅内动脉粥样硬化性狭窄所致缺血性卒中的发病率较西方白人高[2,6],国人颅内动脉粥样硬化性狭窄又以MCA狭窄最为常见[1,6]。本研究发现责任MCA狭窄程度≥70%的患者新发脑梗死灶最常见的分布特征是多发梗死灶、内分水岭梗死以及皮层小的栓塞灶,而责任MCA无狭窄或狭窄程度<70%的患者最常见的是MCA穿支分布区单个梗死灶。Dae K. Lee等[11]的研究也发现皮层梗死灶多见于MCA严重狭窄或闭塞的患者,而MCA穿支分布区单个梗死灶更多见于MCA轻度狭窄而非严重狭窄或闭塞的患者。
本研究和H Ay等[15]的研究均发现新发多个梗死灶是缺血性脑血管病复发的危险因素。新发多个梗死灶常常提示栓子来源于大动脉粥样硬化所致的不稳定斑块或血栓的破裂,经颅多普勒常常可监测到多发微栓子信号[15-16];而皮层下或穿支动脉分布区单个梗死灶常常是由小动脉病变或载体动脉阻塞穿支所致[17]。前者的斑块或血栓常常处于不稳定状态,而后者责任动脉无明显的斑块或斑块相对稳定,因此不难理解有新发多个梗死灶的缺血性卒中患者的复发风险较高。
有研究发现卒中前TIA发作是卒中发生或复发的重要危险因素,本研究也发现:卒中前3个月内反复TIA发作是缺血性脑血管病复发的危险因素[9,15]。责任脑动脉严重狭窄导致的反复的栓子脱落或供血动脉远端脑组织的低灌注,既可以是反复TIA发作的原因,也可以是缺血性卒中发生或复发的原因[18-19]。因此,有必要对反复TIA发作的患者进行脑组织和脑血管方面的评估并给予有针对性的治疗,这有助于降低缺血性卒中的风险[20]。
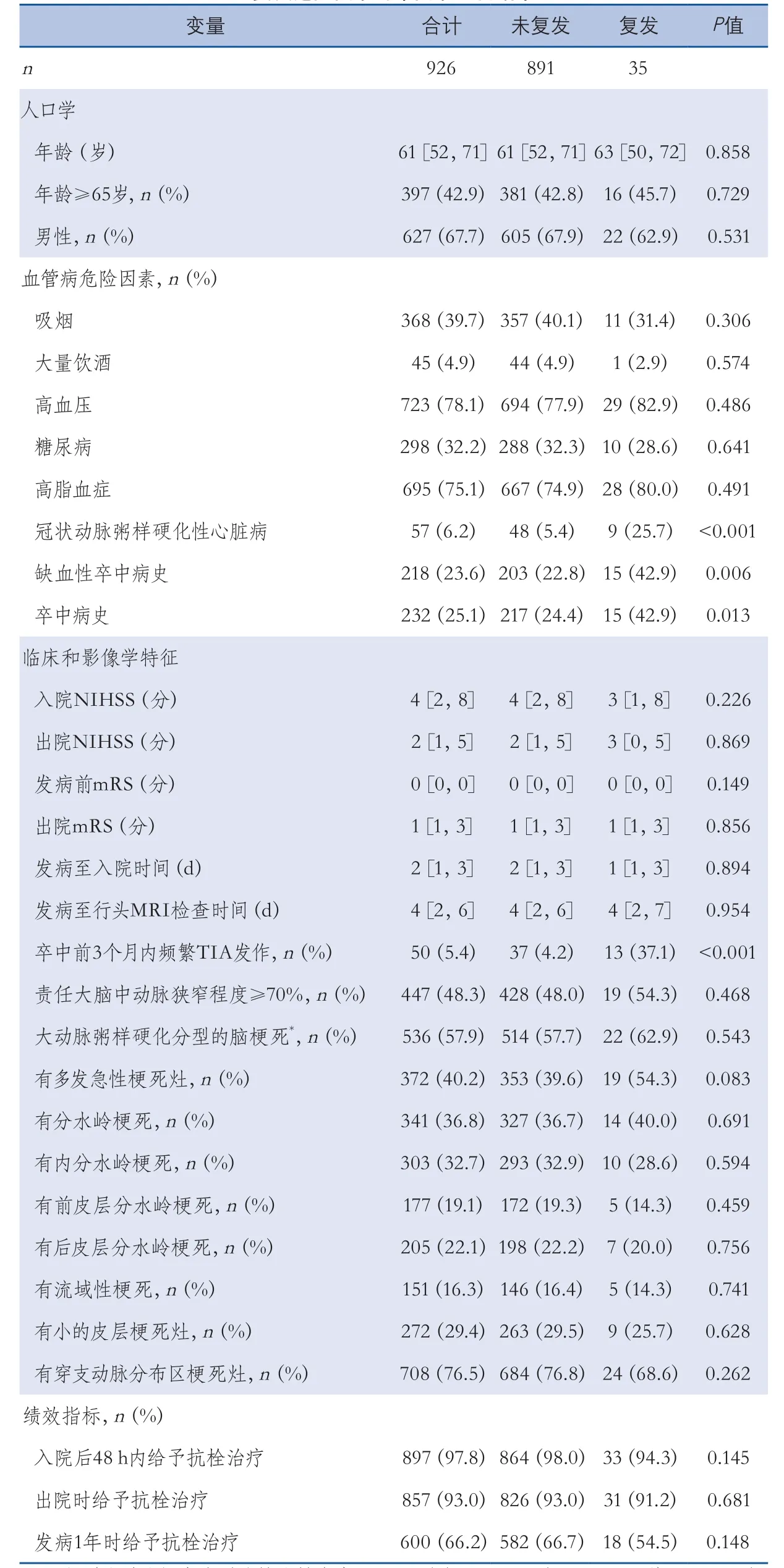
表2 大脑中动脉分布区缺血性卒中患者1年内缺血性脑血管病复发危险因素的单因素分析结果
颈动脉粥样硬化或颈动脉分布区缺血性卒中是冠状动脉粥样硬化性心脏病的等危症。前人研究发现冠状动脉粥样硬化性心脏病或无症状性的冠状动脉狭窄是卒中的独立预测因素[21]。因此,冠状动脉粥样硬化性心脏病和缺血性脑血管病是密切相关的。本研究也发现:在校正其他因素后,冠状动脉粥样硬化性心脏病仍与缺血性脑血管病的复发密切相关。因此,有必要密切关注有冠状动脉粥样硬化性心脏病病史的MCA分布区缺血性卒中患者,上述患者缺血性脑血管病复发的风险较高。
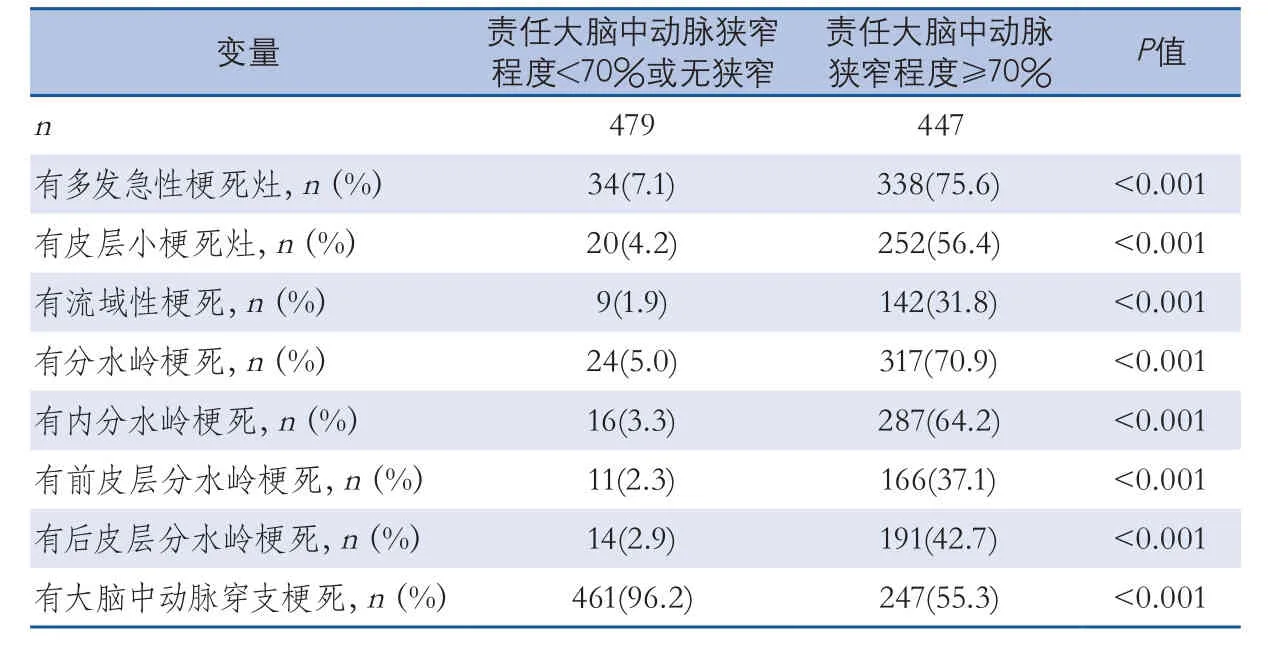
表3 大脑中动脉分布区缺血性卒中患者梗死灶的分布特征与责任大脑中动脉狭窄程度的关系
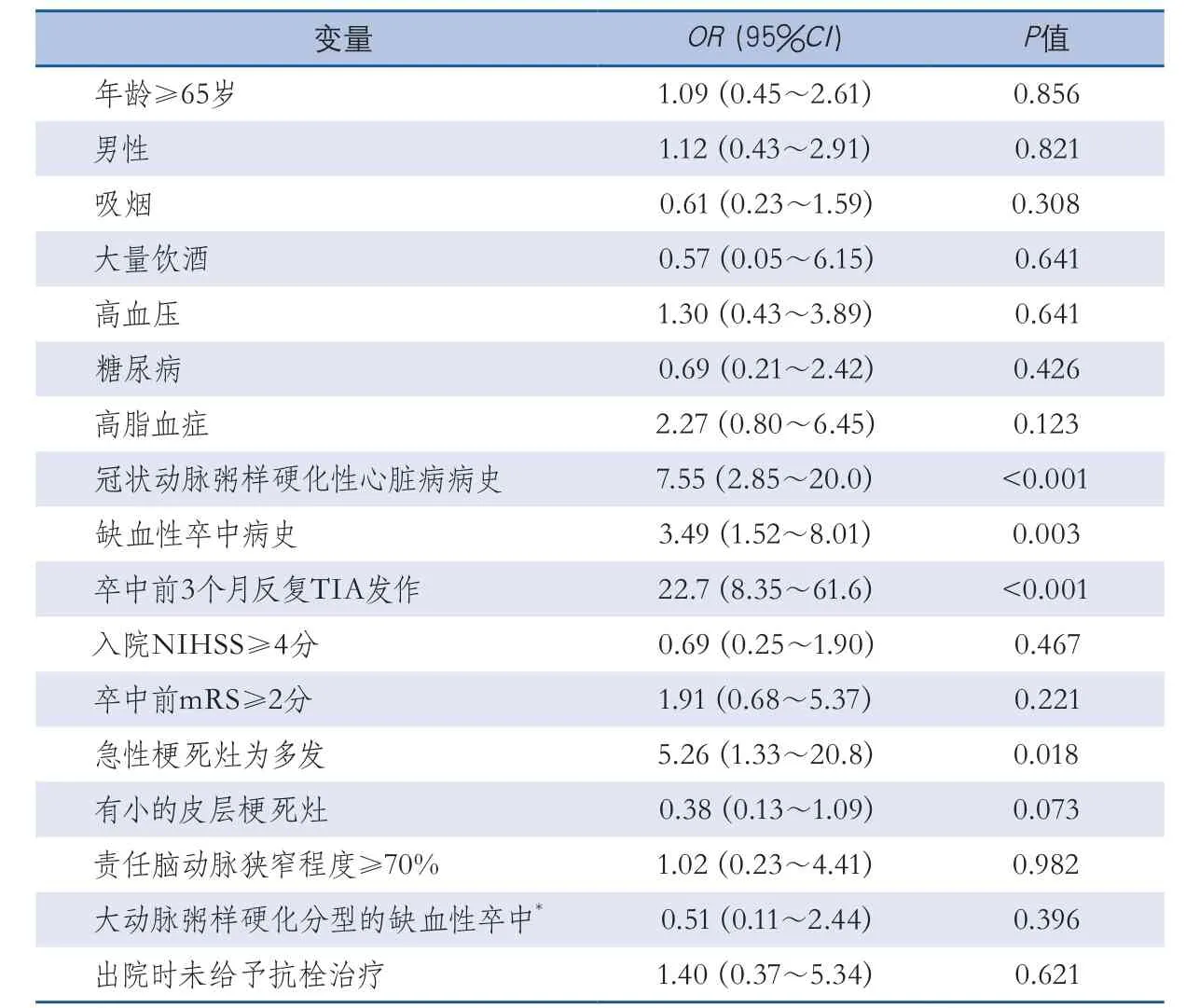
表4 1年内缺血性脑血管病复发危险因素的多因素Logistic回归分析结果
本研究尚有一些不足。首先,不是所有的患者都行经食道超声心动图和24 h心电Holter以除外心源性栓塞的可能。其次,该研究入选的全是医院住院的缺血性卒中患者,而且排除了那些临床症状较重、需要持续监护、发病前存在残障、不能配合头颅MRI检查的患者,这可能导致选择偏倚。
[1]PU Y,LIU L,WANG Y,et al. Geographic and sex difference in the distribution of intracranial atherosclerosis in China[J]. Stroke,2013,44(8):2109-2114.
[2]WHITE H,BODEN-ALBALA B,WANG C,et al. Ischemic stroke subtype incidence among whites,blacks,and Hispanics:the Northern Manhattan Study[J]. Circulation,2005,111(10):1327-1331.
[3]DANAEI G,FINUCANE M M,LIN J K,et al.National,regional,and global trends in systolic blood pressure since 1980:Systematic analysis of health examination surveys and epidemiological studies with 786 country-years and 5.4 million participants[J].Lancet,2011,377(9765):568-577.
[4]GORELICK P,WONG K S,LIU L. Epidemiology[J].Front Neurol Neurosci,2016,40(8):34-46.
[5]WANG J,ZHANG L,WANG F,et al. Prevalence,awareness,treatment,and control of hypertension in china:Results from a national survey[J]. Am J Hypertens,2014,27(11):1355-1361.
[6]WONG K S,LI H,CHAN Y L,et al. Use of transcranial Doppler ultrasound to predict outcome in patients with intracranial large-artery occlusive disease[J]. Stroke,2000,31(11):2641-2647.
[7]WEIMAR C,DIENER H C,ALBERTS M J,et al. The Essen stroke risk score predicts recurrent cardiovascular events:a validation within the REduction of Atherothrombosis for Continued Health(REACH)registry[J]. Stroke,2009,40(2):350-354.
[8]KERNAN W N,VISCOLI C M,BRASS L M,et al.The stroke prognosis instrument ii(spi-ii):A clinical prediction instrument for patients with transient ischemia and nondisabling ischemic stroke[J]. Stroke,2000,31(2):456-462.
[9]SUMI S,ORIGASA H,HOUKIN K,et al. A modi fi ed Essen stroke risk score for predicting recurrent cardiovascular events:development and validation[J]. Int J Stroke,2013,8(4):251-257.
[10]TAMURA A,YAMAMOTO Y,NAGAKANE Y,et al. The relationship between neurological worsening and lesion patterns in patients with acute middle cerebral artery stenosis[J]. Cerebrovasc Dis,2013,35(3):268-275.
[11]LEE D K,KIM J S,KWON S U,et al. Lesion patterns and stroke mechanism in atherosclerotic middle cerebral artery disease:early diffusionweighted imaging study[J]. Stroke,2005,36(12):2583-2588.
[12]Ay H,FURIE K L,SINGHAL A,et al. An evidence-based causative classi fi cation system for acute ischemic stroke[J]. Ann Neurol,2005,58(5):688-697.
[13]D'AMORE C,PACIARONI M. Border-zone and watershed infarctions[J]. Front Neurol Neurosci,2012,30(6):181-184.
[14]SZABO K,KERN R,GASS A,et al. Acute stroke patterns in patients with internal carotid artery disease:a diffusion-weighted magnetic resonance imaging study[J]. Stroke,2001,32(6):1323-1329.
[15]AY H,GUNGOR L,ARSAVA E M,et al. A score to predict early risk of recurrence after ischemic stroke[J]. Neurology,2010,74(2):128-135.
[16]WONG K S,GAO S,CHAN Y L,et al. Mechanisms of acute cerebral infarctions in patients with middle cerebral artery stenosis:a diffusion-weighted imaging and microemboli monitoring study[J]. Ann Neurol,2002,52(1):74-81.
[17]KIM J M,JUNG K H,SOHN C H,et al. Middle cerebral artery plaque and prediction of the infarction pattern[J]. Arch Neurol,2012,69(11):1470-1475.
[18]MOUSTAFA R R,IZQUIERDO-GARCIA D,JONES P S,et al. Watershed infarcts in transient ischemic attack/minor stroke with > or = 50% carotid stenosis:hemodynamic or embolic?[J]. Stroke,2010,41(7):1410-1416.
[19]CALVET D,TOUZE E,OPPENHEIM C,et al.DWI lesions and TIA etiology improve the prediction of stroke after TIA[J]. Stroke,2009,40(1):187-192.
[20]LAVALLEE P C,MESEGUER E,ABBOUD H,et al. A transient ischaemic attack clinic with round-theclock access(SOS-TIA):feasibility and effects[J].Lancet Neurol,2007,6(11):953-960.
[21]AMARENCO P,LAVALLEE P C,LABREUCHE J,et al. Coronary artery disease and risk of major vascular events after cerebral infarction[J]. Stroke,2013,44(6):1505-1511.

