StAR基因高表达对DEHP致MCF-7细胞凋亡作用的影响
彭 鹏 王潮岗 徐新云 * 夏俊杰黄海燕王 利黄奕钦杨 晨
(1.深圳市疾病预防控制中心毒理研究所,广东 深 圳 518055;2.深圳大学生命与海洋科学学院,广东 深 圳 518060;3.南华大学公共卫生学院,湖南 衡 阳 421001)
邻苯二甲酸酯类(phthalate acid esters,PAEs)化合物是常见的塑化剂,一般为无色油状黏稠液体,难溶于水,易溶于有机溶剂,常温下不易挥发。我国常用PAEs的品种包括邻苯二甲酸二(2-乙基己基)酯[di-(2-ethylhexyl)phthalate,DEHP]、邻苯二甲酸二辛酯(dioctyl phthalate,DOP)、邻苯二甲酸二异辛酯(diisooctyl phthalate,DIOP)、邻苯二甲酸二丁酯(dibutyl phthalate,DBP)等30多种化合物。DEHP属于环境内分泌干扰物之一,具有生殖毒性、胚胎发育毒性、遗传毒性、免疫毒性[1-7]。大量动物实验及体外实验研究表明,DEHP主要通过雌激素样作用、干扰内分泌调节而作用于生殖系统。类固醇合成急性调节蛋白(steroidogenio acute regulatory protein,StAR)是类固醇激素合成过程中的重要调节因素,StAR是一类胆固醇转运蛋白,可促进类固醇激素合成细胞中胆固醇自线粒体外膜转运至内膜,进而转化合成类固醇激素,是该类激素合成的限速步骤[8-10]。本实验室前期研究表明,DEHP染毒后动物睾丸和卵巢组织中StAR基因表达水平升高,StAR基因可能在DEHP致生殖毒性中发挥重要的作用[2-3]。为了深入研究DEHP的生殖内分泌毒性机制,本文通过分子克隆技术,应用慢病毒载体构建StAR基因高表达的细胞,研究StAR基因高表达对DEHP致细胞凋亡的影响,为进一步研究DEHP的生殖毒性机制提供科学依据。
1 材料与方法
1.1 主要试剂
限制性内切酶EcoR I、Xho I,T4 DNA连接酶,均购于美国Fermentas公司;DNA胶回收试剂盒RNeasy Mini试剂盒(德国QIAGEN公司),Prime Scrip RT reagent Kit和SYBR Primescript RT-PCR Kit(中国 TAKARA公司),质粒小量提取和无内毒素质粒小量提取试剂盒(美国OMEGA Bio-tek公司),J107大肠杆菌感受态(天根生物公司),真核表达载体pLVX-mCUV-ZSgreen-PGLC-Puro(以下简称pLVX载体,Biovector公司),包装辅助质粒PLVX-GFP和该质粒对应的慢病毒包装试剂盒 (美 国 Clontech公 司 ), 293FT细 胞 (美 国 Invitrogen公司),RPMI-1640培养基和胎牛血清(美国Gibco公司),人乳腺癌MCF-7细胞(中国上海细胞库),StAR基因PCR引物由上海生工合成,兔抗StAR(ab133657)一抗为美国Santa Cruz公司产品,羊抗鼠IgG-HRP和羊抗兔IgG-HRP均为美国Thermo Scientific 公司产品。
1.2 StAR cDNA的扩增及其克隆载体构建
根据GenBank的StAR基因序列对所需引物进行设计,序列如下:F,5´-GGAATTCCAGGAAACAATGCT GCTAG-3´(EcoR Ⅰ);R,5´-CCCTCGAGCAGGCTGGT CTTCAACAC-3´(Xho I)。按照Premix PrimeSTARHS的使用说明配置反应体系进行PCR,退火温度为72℃。PCR完成后进行琼脂糖凝胶电泳鉴定,然后用DNA胶回收试剂盒回收PCR产物,并再用ExTaq酶进行加A尾反应。按照pLVX载体的说明书,将加A尾产物与pLVX载体连接,转化J107感受态细菌。常规筛选鉴定,挑取小量培养的PCR鉴定阳性克隆的细菌菌液,送至生工生物工程(上海)有限公司测序确认。
1.3 慢病毒载体构建与包装
挑取测序正确的重组T载体,先进行Xho I酶切,用核酸共沉剂回收酶切产物后,再用EcoR I酶切。电泳鉴定后,用DNA胶回收试剂盒回收酶切产物,然后将其与经过相同处理的pLVX-GFP载体连接,转化J107感受态细菌。小量培养筛选出来的细菌,提取重组质粒进行PCR鉴定,并将菌液送至上海生工测序。挑取测序正确的重组pLVX-GFP载体,用pLVX-GFP载体对应的慢病毒包装试剂盒将pLVX-GFP载体和包装载体共转染到293FT细胞中,置于37 ℃培养48 h后将上清培养基用0.45 μmol/L滤膜过滤,收集病毒上清,使用Lenti-X GoStix金标试剂盒测定病毒滴度,然后保存于-80 ℃。
1.4 慢病毒转染MCF-7细胞
将3×105个MCF-7细胞接种于25 cm2的细胞培养瓶中,培养18 h后细胞汇合度达到50%,取病毒上清用RPMI-1640完全培养基按1∶1稀释后,再加入Polybrene至终浓度为6~10 μg/mL。去除培养瓶中原有的完全培养基,用PBS洗两遍后加人上述含慢病毒的RPMI-1640完全培养基。转染24 h,去除含慢病毒的RPMI-1640完全培养基,加入正常的RPMI-1640完全培养基再培养24 h,然后换用1 μg/mL嘌呤霉素对细胞进行筛选,每隔2 d换液1次,筛选时间为7 d。
1.5 StAR高表达细胞株的鉴定
1.5.1荧光定量PCR检测StAR mRNA表达水平分别接种MCF-7细胞和上述1.4转染StAR基因的MCF-7细胞(3×105个),培养细胞24 h后至细胞密度为80%。按照RNeasy Mini Kit说明书,提取细胞总RNA;用Prime Scrip RT reagent Kit将总RNA反转录为cDNA。分别取两种细胞的cDNA各1 μL为模板进行荧光定量PCR,检测StAR mRNA表达量的变化,确认StAR高表达细胞株。
1.5.2Western blot检测StAR蛋白表达水平 将正常MCF-7细胞、转染StAR基因的MCF-7细胞分别接种到25 cm2的细胞培养瓶(1×106个)。培养约24 h后待细胞汇合度达90%后去除培养基,吸弃细胞培养液,用冷PBS洗3次,加入细胞裂解液提取细胞总蛋白,100 ℃变性8 min;用二辛可宁酸法(bicinchoninic acid assay,BCA法)进行蛋白定量。总蛋白进行10% SDS-PACE电泳分离,接着将蛋白电转至PVDF膜上,5%脱脂奶粉室温封闭2 h。根据Marker和分子量将膜上含β-actin(43 kD),StAR蛋白(32 kD)的部分分别切下,加入相应的一抗,冰上孵育过夜;TBST缓冲液洗膜3次,每次10 min。加入对应的二抗,室温孵育1 h;TBST缓冲液洗膜3次,每次10 min。加入Western blot化学发光试剂后用冷CCD成像系统对其进行曝光拍照,所得图像用Image J软件进行条带灰度定量分析。以β-actin为内参,计算目的蛋白的相对表达量。
1.6 DEHP处理细胞
将正常MCF-7细胞和StAR基因高表达的MCF-7细胞分别接种到6孔板上,待细胞融合度达80%进行DEHP染毒,DEHP染毒浓度分别为0(溶剂对照)、0.05、0.10、0.20、0.40和0.80 mmol/L,染毒24 h,将6孔板中的染毒液去除干净,用PBS清洗细胞两次,提取细胞总RNA,用分光光度计测定RNA浓度,反转录后进行荧光定量PCR。
1.7 荧光定量PCR检测凋亡相关基因mRNA的表达
按1.6的方法用DEHP染毒MCF-7细胞后,分别提取各个剂量组细胞总RNA,反转录为cDNA。RT反应体系是:5×Prime Script缓冲液4 μL,Prime Script RT酶 Mix I 1.0 μL, Oligo dT引 物 (50 μmol/L)1.0 μL,Random 6 mers(100 μmol/L)1.0 μL,总RNA 1 μg,加RNase Freed H2O至20 μL。反转录条件:37 ℃、15 min,85 ℃、5 s,4 ℃、10 min,-20 ℃冰箱保存反转录样品。目的基因Bax,Caspase-3,Caspase-8的荧光PCR引物委托上海生工公司合成,引物序列如下:Bax,正向5´-GCCAGCAAACTGGTGCTCAA-3´,反向5´-ATGTCCAGCCCATGATGGTTC-3´; Caspase-3, 正向 5´-GACTCTGGAATATCCCTGGACAACA-3´, 反 向5´-AGGTTTGCTGCATCGACATCTG-3´; Caspase-8,正向5´-CAAATGCAAACTGGATGATGAC-3´,反向5´-AGCAGGCTCTTGTTGATTTGG-3´;GAPDH,正向5´-TCCTGCACCACCAACTGCTT-3´,反向5´-GTCTTCTGG GTGGCAGTGAT-3´。荧光定量PCR反应条件:95 ℃预变性30 s;95 ℃变性5 s,58 ℃退火延伸30 s,共40个循环。以GAPDH的CT值 为内参,目的基因CT值 采用2-ΔΔCT法计算后的比值即为各基因的相对表达量,此步骤由ABI 7900HT分析软件自动计算并直接给出结果。
1.8 Western blot检测StAR蛋白和凋亡蛋白的表达
DEHP染毒MCF-7细胞后,用细胞裂解液提取细胞总蛋白;用二辛可宁酸法(BCA法)进行蛋白定量。配制10%分离胶,5%浓缩胶,依次加入蛋白样品;浓缩胶于80 V条件下电泳30 min,分离胶于120 V条件下电泳50 min。SDS-PAGE凝胶电泳结束后,按0.8 mA/cm2胶面积设定转膜电流,恒流转膜100 min,将蛋白转移至PVDF膜;5%脱脂奶粉室温封闭2 h。将PVDF膜放在一抗(抗StAR、Bax、Caspase-3、Caspase-8)(1∶300)稀释液中4 ℃环境中过夜孵育,然后用TBST溶液洗3次,每次10 min。按1∶2 000比例稀释HPR标记的羊抗鼠二抗、HPR标记的羊抗兔二抗,室温下孵育1 h;TBST缓冲液洗膜3次,每次10 min。加入ECL发光试剂,在冷CCD成像系统里观察结果。
1.9 统计学分析
实验结果运用SPSS 20.0统计分析软件进行处理,StAR基因高表达组与对照组、DEHP实验组和对照组之间的比较采用单因素方差分析,两两比较采用LSD-检验,数据以x±s表示,以α=0.05为检验水准。
2 结果
2.1 StAR慢病毒载体测序鉴定结果
StAR基因高表达慢病毒载体的测序结果表明,外源基因插入位点正确,并且插入序列与GenBank上提供的信息完全相符,部分测序结果如图1所示。
2.2 StAR慢病毒重组载体构建与病毒包装鉴定
应用琼脂糖凝胶电泳分析StAR基因的PCR扩增产物,可见明显条带,大小约1 000 bp,与预期相符。将含PCR产物的重组pLVX载体经上海生工测序,与GenBank上该基因的序列完全相符。
图1 StAR慢病毒载体测序鉴定结果
图2 PCR扩增StAR基因电泳结果
2.3 荧光定量PCR检测StAR基因转染细胞株中StAR mRNA相对表达水平
将正常MCF-7细胞的StAR基因表达量作为对照,数值设为1,StAR基因转染MCF-7细胞的StAR mRNA表达量比正常MCF-7细胞提高591.9倍(p<0.01)。
2.4 Western blot检测StAR基因转染细胞株中StAR蛋白相对表达水平
以β-actin蛋白为内参,检测MCF-7细胞和StAR基因转染MCF-7细胞StAR蛋白表达水平,经归一化处理后的灰度分析结果显示,StAR基因转染MCF-7细胞中StAR蛋白含量比MCF-7细胞升高190%(p<0.01)。

图3 Western blot检测StAR蛋白表达水平
2.5 DEHP对StAR基因高表达细胞中凋亡基因mRNA表达水平的影响
0.10~0.8 mmol/L DEHP染毒MCF-7细胞后,Bax和Caspase-3 mRNA表达水平较对照组(0 mmol/L DEHP)显著升高;0.05~0.8 mmol/L DEHP染毒时Caspase-8 mRNA表达水平较对照组显著升高;不同浓度DEHP染毒StAR高表达细胞后,Bax和Caspase-8 mRNA表达水平在染毒浓度为0.05~0.8 mmol/L时显著升高,Caspase-3 mRNA在染毒浓度为0.1~0.8 mmol/L时表达水平显著升高,差异均有统计学意义(p<0.05或p<0.01),见图4。
2.6 DEHP对StAR基因高表达细胞中凋亡基因蛋白表达水平的影响
Western blot结 果 显 示 , DEHP染 毒 MCF-7细 胞后,0.2~0.8 mmol/L DEHP染毒组Bax蛋白质较对照组显著升高,差异有统计学意义(p<0.01);0.1~0.8 mmol/L DEHP染毒组Caspase-3蛋白较对照组显著升高,差异有统计学意义(p<0.05或p<0.01);0.2~0.8 mmol/L DEHP染毒组Caspase-8蛋白表达较对照组显著升高,差异均有统计学意义(p<0.01)。在DEHP 0.2 mmol/L剂量下,与同染毒剂量组的MCF-7细胞比较,StAR高表达细胞Caspase-3蛋白表达水平下降(p<0.01);DEHP其他剂量下,StAR高表达细胞Bax、Caspase-3和Caspase-8蛋白表达与同染毒剂量组的MCF-7细胞比较均显著升高,差异均有统计学意义(p<0.05或p<0.01),结果见图5~7。
3 讨论
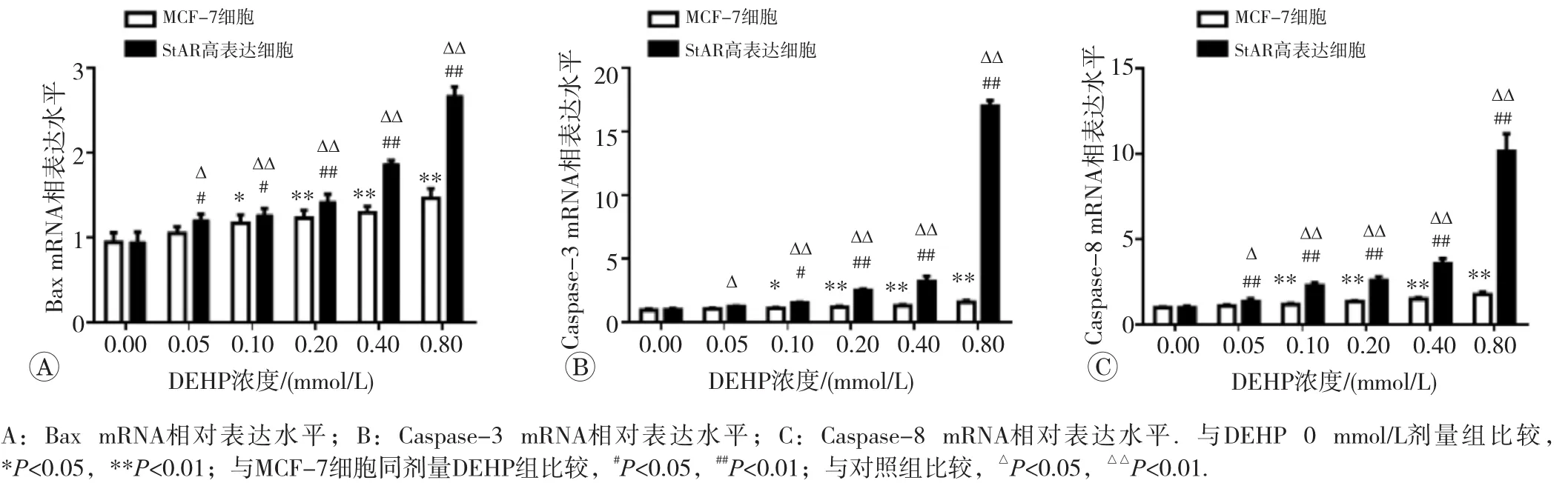
图4 不同剂量DEHP染毒对MCF-7细胞和StAR基因转染细胞凋亡相关基因表达水平的影响

图5 DEHP染毒对MCF-7细胞和StAR基因高表达细胞Bax蛋白表达水平的影响

图6 DEHP染毒对MCF-7细胞和StAR基因高表达细胞Caspase-3蛋白表达水平的影响
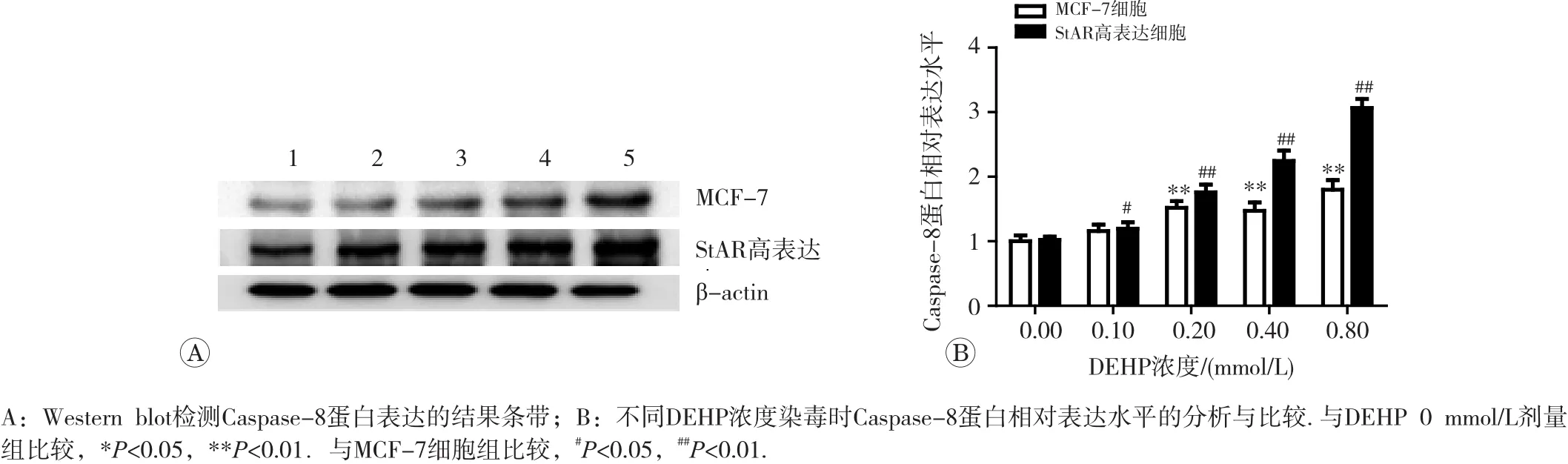
图7 DEHP染毒对MCF-7细胞和StAR基因高表达细胞Caspase-8蛋白表达水平的影响
近年来DEHP的生殖毒性已有明确结论[1-7],但是还存在很多没有解决的问题,比如DEHP究竟会引起哪些具体的基因及蛋白质的改变、DEHP是通过何种信号通路来启动它的损伤机制的,在损伤过程中会引起哪些激素水平的改变等。文献检索发现,国际上对于生殖有关的基因调控进行了许多研究,例如类固醇激素合成急性调节蛋白StAR基因与雄性激素合成调控密切相关,StAR基因位于8号染色体上,其编码的蛋白产物是StAR蛋白,StAR基因对睾酮的生物合成具有重要的意义,对整个雄激素合成过程至为关键[9,11]。StAR蛋白位于线粒体内,在线粒体外膜发挥作用。StAR基因表达调控是一个非常复杂的过程,包括多种激素和信号途径协调转录机制合作与互动,以及若干支配转录后的mRNA和蛋白表达机制[12]。研究表明StAR基因的表达紊乱会引起多囊卵巢综合征等在内的多种内分泌紊乱型疾病的发生发展。StAR基因是类固醇激素合成过程中的限速酶也是关键酶,其表达可受到机体应激状态的影响。所以本课题主要研究DEHP对乳腺癌细胞中StAR基因表达的影响。
Bax基因是Bcl-2基因家族中的一员,其表达产物可形成异源二聚体,进而导致细胞凋亡加速发生。在正常细胞中Bax蛋白通常存在于细胞质中,受到一系列死亡信号的刺激后会转移到线粒体内,一旦到达线粒体的外膜,就会导致线粒体功能异常并引发凋亡。Caspase-3是凋亡中发挥起始和执行作用的蛋白,也是最重要的凋亡执行者之一,是凋亡的主要效应因子,其活化意味着凋亡浸入不可逆阶段,Caspase-8则是凋亡的启动因子,在自我活化后能激活凋亡执行,因此3种凋亡基因表达水平的变化表明,DEHP染毒对StAR基因高表达细胞的凋亡基因有显著影响,并且与正常MCF-7细胞相比,DEHP对StAR基因高表达细胞的凋亡基因表达具有显著的促进作用。本文结果显示,StAR基因高表达细胞中凋亡基因Bax、Caspase-3、Caspase-8的表达水平随DEHP浓度增加而增加。当DEHP染毒剂量在中剂量和高剂量时,StAR基因高表达细胞和正常MCF-7细胞凋亡基因Bax、Caspase-3、Caspase-8的mRNA表达水平均显著高于未染毒的对照组,且StAR基因高表达细胞明显高于正常MCF-7细胞。该结果提示StAR基因促进了凋亡相关基因的表达,推测其原因可能是DEHP染毒后在StAR基因高表达细胞中具有促进凋亡基因活化的作用。
DEHP与我们生活环境密切相关,DEHP是当今社会非常关注的环境污染物之一,几乎存在于生活中的各个领域,包括塑料制品、食品包装袋、儿童玩具、血袋,透析袋以及医用导管中,其作用是增加塑料的可塑性和柔韧性,提高塑料强度,其含量可高达终产品的50%[13-14]。本文结果表明,DEHP具有显著促进凋亡基因表达的生物学作用,而且StAR基因高表达细胞比正常MCF-7细胞的凋亡基因表达水平更高,提示StAR基因高表达具有促进DEHP的致凋亡作用,为深入研究DEHP的生殖毒性提供了科学依据。
[1] WANG Y,YANG Q,LIU W,et al. DEHP exposure in utero disturbs sex determination and is potentially linked with precocious puberty in female mice[J]. Toxicol Appl Pharmacol,2016,307:123-129.
[2] 徐新云,秦逍云,谭琴,等. 邻苯二甲酸二(2-乙基己)酯对大鼠睾丸和卵巢组织激素相关蛋白表达的影响[J]. 癌变·畸变·突变,2015,27(3):225-229.
[3] 秦逍云,谭琴,徐新云,等. 邻苯二甲酸二(2-乙基己)酯对雄性大鼠激素相关基因表达水平的影响[J]. 癌变·畸变·突变,2014,26(5):365-368.
[4] ZONG T,LAI L,HU J,et al. Maternal exposure to di-(2-ethylhexyl) phthalate disrupts placental growth and development in pregnant mice[J]. J Hazard Mater,2015,297:25-33.
[5] LYCHE JL,GUTLEB AC,BERGMAN A,et al. Reproductive and developmental toxicity of phthalates [J]. J Toxicol Env Heal B,2009,12(4):225-249.
[6] WANG W,CRAIG Z R,BASAVARAJAPPA M S,et al. Di(2-ethylhexyl) phthalate inhibits growth of ovarian antral follicles through an oxidative stress pathway[J].Toxicol Appl Pharmacol,2012,258(2):288-295.
[7] INADA H,CHIHARA K,YAMASHITA A,et al.Evaluation of ovarian toxicity of mono-(2-ethylhexyl) phthalate(MEHP)using cultured rat ovarian follicles[J].J Toxicol Sci, 2012,37(3):483-490.
[8] KHALIL S R, AWAD A, ALI S A. Melamine and/or formaldehyde exposures affect steroidogenesis via alteration of StAR protein and testosterone synthetic enzyme expression in male mice[J]. E nviron T oxicol P harmacol,2017,50(1):136-144.
[9] MEN Y,FAN Y,SHEN Y,et al. The steroidogenic acute regulatory protein (StAR)[J]. Endocrinology, 2017,158(2):402-409.
[10] HUANG S,PANG Y,YAN J,et al. Fractalkine restores the decreased expression of StAR and progesterone in granulosa cells from patients with polycystic ovary syndrome[J]. Sci Rep,2016,6:26205.
[11] 逯晓波,于涛,马明月,等. 邻苯二甲酸二(2-乙基己基)酯对大鼠睾丸发育及StAR、CYP19a1、CYP11a1基因表达的影响[J]. 卫生研究,2010,39(3):263-267.
[12] DUARTE A, CASTILLO A F, Podestá E J, et al.Mitochondrial fusion and ERK activity regulate steroidogenic acute regulatory protein localization in mitochondria[J]. PLoS One,2014,9(6):el00387.
[13] LAI F N,LIU J C,LI L,et al. Di (2-ethylhexyl) phthalate impairs steroidogenesis in ovarian follicular cells of prepuberal mice[J]. Arch Toxicol,2017,91(3):1279-1292.
[14] SINGH S,LI S L. Bisphenol A and phthalates exhibit similar toxicogenomics and health effects[J]. Gene, 2012,494(1):85-91.

