晚松不同外植体腋芽诱导的初步研究
杨梦丽 高茜茜 刘苑秋 胡冬南 李佳俊 张志坚 邹贵武 黄国贤
(江西农业大学林学院森林培育重点实验室,南昌 330045)
晚松(Pinus serotina),松科松属,常绿乔木,原产于美国东南沿海平原、丘陵和低山区[1-2],是一种具有适应性强、耐干旱、耐贫瘠、生长快、热值高、耐平茬、轮伐期短等特点的速生树种。国内最早于上世纪60年代引进晚松,并进行规模化培育。至今,北至山东,南至浙江广东等地均有栽植,可见,晚松能够在中国大范围的引种栽植。由于晚松的热值高、生物量大,具有能源树种的优良特点,使得晚松发展成薪炭林的巨大潜力。但由于晚松球果常年宿存,种鳞不开裂,导致种子获取困难,制约了晚松种子繁殖,因此无性繁殖手段成为解决这一问题的重要途径。
目前,针对松科树种的繁殖技术有植物组织培养、扦插、嫁接等,由于植物组织培养繁殖速度快,繁殖系数大,且能够保持母本的优良性状,可以一年四季进行工厂化规模生产,因此成为晚松无性繁殖最佳选择。国内对晚松的组织培养研究开始于20世纪90年代末,1997年阙国宁等[2]以晚松的种胚为外植体,建立组织培养体系,研究发现:中盐度的培养基、3.0-5.0 mg/L的BAP较适合愈伤组织和不定芽的诱导和分化,活性炭对不定芽的分化和生长有一定的促进作用,将芽接种于添加NAA的中盐度的培养基上,10-15 d即可从愈伤组织长出3-5条根,移栽的成活率达95%;2002年张守英等[3]以晚松的种胚为外植体,进行悬浮细胞系的建立和原生质体的分离,在MS培养基+0.2 mg/L KT+2.5 mg/L 2,4-D的光培养条件下成功诱导出愈伤组织,建立了其悬浮细胞体系,并成功进行了原生质体的分离。到目前为止,国内关于晚松组织培养的研究报道仅有这两篇,且均以种胚为外植体。因此有必要在前人研究的基础上重点选择其他的材料进行晚松的组织培养,如新梢、种子顶芽等。范岳慧[4]对彰武松进行初步研究中采用的是封顶芽和新梢为外植体,研究了可行性的组培技术;朱丽华[5]以带子叶顶芽为外植体诱导丛生芽建立了湿地松组织培养的再生体系;暴甜等[6]以毛梾一年生实生苗的新梢为外植体成功得建立了组培体系;孙小兵[7]研究板栗的组培体系时发现,外植体的最佳取材时间是新梢的旺盛生长期到半木质化期;唐婷婷[8]研究马尾松优良种源的组培技术中采用种子萌发的顶芽为外植体,进行了组培的一系列研究;王喆[9]对引鸟花楸不同外植体进行组培繁殖的研究中表明,分化率最好的是顶芽,其次是腋芽、嫩枝和叶片;张娜[10]以毛梾幼嫩茎段作为外植体,研究灭菌方法、培养基、植物生长调节剂等对腋芽诱导的影响发现,MS培养基添加0.5-1.0 mg/L 6-BA、0.1 mg/L NAA与0.1 mg/L IBA时,腋芽诱导率最高,分别达85.5%和84.4%;胡燕梅[11]以蓝莓南高丛品种‘南大’为外植体,研究表明蓝莓‘南大’茎段的最佳消毒方式为75%酒精消毒120 s+0.1% HgCl2消毒10 min。而本研究在对晚松的外植体消毒所采用的是75%酒精和0.1%HgCl2联合使用,腋芽诱导所采用的激素为6-BA和NAA。
晚松具有萌发时间长,生长快,取材方便,数量多,春季新萌发的新梢分化能力强等优点。但其种子的数量有限,因此选取了少量的种子萌发后的顶芽为材料进行腋芽诱导。研究利用春梢和种子萌发后的顶芽进行组织培养,建立晚松离体培养体系。
1 材料与方法
1.1 材料
试验地概况:在江西农业大学科技园,位于江西省南昌市梅岭脚下,属亚热带季风气候,热量丰富,雨水充沛,光照充足;年降雨量1 600-1 700 mm,降水日为147-157 d,年平均暴雨日5.6 d,年平均气温17.0℃-17.7℃,极端历史最高气温40.9℃,极端历史最低气温-15.2℃;年日照时间1723-1820 h,日照率为40%,7、8月最多,2、3月最少,年平均相对湿度为78.5%,为植物的生长提供了有利的气象条件。
茎段来源:2016年5月,在阳光充足的中午采集一年生晚松新萌发的无次生叶的茎段,放于自封袋中带回江西农业大学组培实验室进行相应处理,每次试验取样40个左右,随采随用。
种子来源:供试种子为江西泰和十年生母树上多年宿存的球果,于60℃烘箱中烘干24 h,种鳞开裂后,取出种子于4℃冷藏备用,每次预处理前准备240粒种子。
1.2 方法
1.2.1 外植体预处理 春梢处理:每次采样约2个处理,即40个样,将刚采的新梢放在适量浓度的洗洁精水中浸泡30 min后,用流水冲洗30 min,放在超净工作台上备用。种子处理:每次选取完整、饱满、大小均匀的种子240粒左右,3个处理,用0.1%高锰酸钾浸泡12 h,流水冲洗1 h,放在超净工作台上备用。
1.2.2 无菌体系的建立 春梢:选择长势良好次生叶未萌发的新梢,带回实验室,除去针叶,基部留2-3 mm,将新梢分为上、中、下3个部位,长1-2 cm,先放在适当浓度的洗洁精水中浸泡30 min,然后在流水冲洗30 min,最后在超净工作台上备用。
消毒试验采用的双因素三水平的试验设计,因素A为春季新梢的上中下3个部位;因素B为用0.1%的升汞消毒的时间(4 min、7 min、10 min)。新梢先用75%的酒精消毒30 s,无菌水冲洗3次,然后用0.1%的升汞消毒,无菌水冲洗4-5次,用滤纸吸干外植体表面的水分,最后接种于已灭菌的MS培养基 + 3.0 mg/L 6-BA + 1.0 mg/L NAA,共9种处理,每种处理30瓶,重复3次,4周后统计其污染率并观察其生长状况,方差分析筛选出春季新梢的最佳消毒时间和部位。
种子:种子无菌体系的建立采用单因素的试验设计。在超净工作台上将种子先用75% 的酒精处理30 s,无菌水冲洗3次,然后用0.1%的升汞处理(3 min、4 min、5 min),无菌水冲洗4-6次,滤纸吸干种子表面的水分,接种于已灭菌的无任何激素添加的MS基本培养基,每个培养瓶中接种5粒种子,不易过分密集,以免感染相互影响,共3种处理,每种处理15瓶,重复3次,4周之后统计污染率,方差分析选出种子消毒所需要的最佳时间。
1.2.3 春梢茎段腋芽诱导基本培养基的选择 无菌苗除去芽下端少量的愈伤组织,在超净工作台上分别接种于适合松类组培的3种基本培养基:MS、GD、DCR,每个处理接种20瓶,重复3次,3周后统计芽的分化系数和诱导率,并观察芽的生长状态,筛选出适合春梢茎段无菌苗腋芽诱导的最佳基本培养基。
1.2.4 春梢茎段腋芽诱导激素浓度的选择 将茎段无菌苗转移到添加不同浓度的NAA与6-BA的培养基上,采用双因素试验设计,具体的试验设计如表1所示,6-BA为4个水平,分别为1.0 mg/L、2.0 mg/L、2.5 mg/L、4.0 mg/L,NAA为3个水平,分别为0 mg/L、0.1 mg/L、0.2 mg/L,共12种处理,每个处理接种20瓶,重复3次,4周后观察芽的分化系数,选出最适合腋芽诱导的激素浓度组合。
1.2.5 种子顶芽腋芽的诱导基本培养基及激素的选择 对种子顶芽腋芽诱导基本培养基及激素的选择采用的L9(34)正交试验设计(表2)。选择松类植物组培常用的MS、GD、DCR作为基本培养基,然后添加不同激素进行腋芽的诱导,每种处理30瓶,4周后观察芽的分化系数和诱导率,并观察芽的生长质量,有无褐化,死亡等现象,筛选出诱导种子顶芽腋芽生长的最佳培养基和激素浓度。
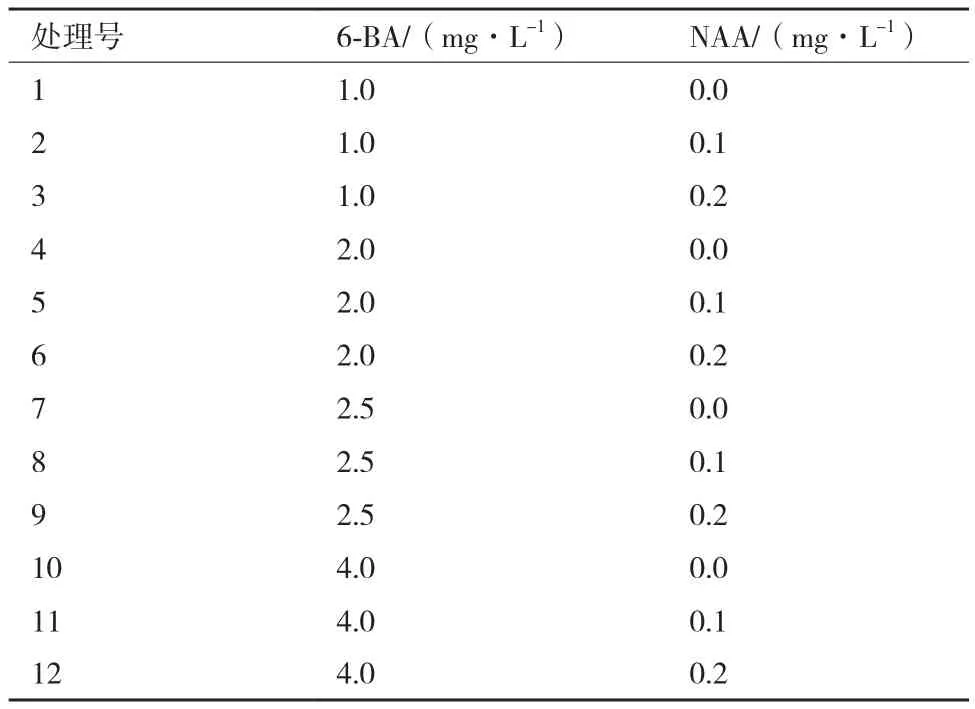
表1 不同浓度的6-BA和NAA的试验组合
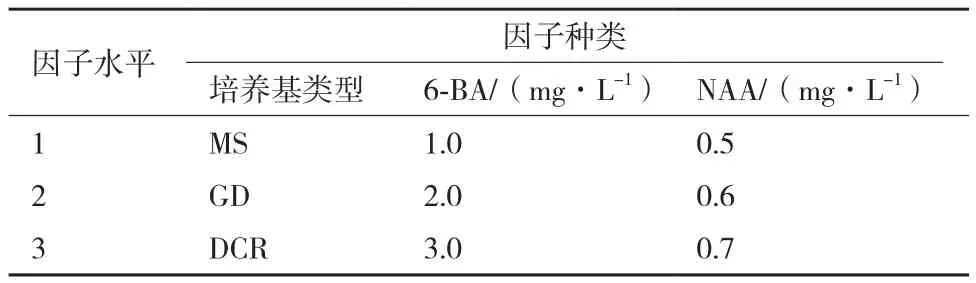
表2 种子顶芽腋芽诱导L9(34)正交试验设计
1.2.6 培养条件 上述所有培养基均添加30 g/L蔗糖和7 g/L琼脂粉,pH 5.8-6.2,培养间的温度为23±3℃,湿度在55%左右,光照时间为12 h/d,光照强度1 500-2 000 Lx。
1.2.7 数据处理 数据是使用Excel2003和SPSS17.0软件进行分析,使用Origin8.1进行图形绘制。百分比的数据用反正弦变化后进行方差分析,将分析得到的有关于污染率的数据再转换为百分比。
污染率(%)=污染的瓶数(包括死亡)/接种总数×100%
诱导率(%)=(诱导出芽的瓶数/接种的总数)×100%
分化系数=分化后芽的个数/接种总数
2 结果
2.1 升汞消毒时间对春梢无菌体系建立的影响
将春梢茎段的上、中、下三个部位经过0.1%升汞不同时间的消毒后分别接种于MS培养基+3.0 mg/L 6-BA + 1.0 mg/L NAA培养基上,4周后统计污染率并进行多重比较,结果如表3和图1所示。升汞的消毒时间对春季茎段的污染率有显著差异,而春季茎段的不同部位对污染率的影响不显著,但二者的交互作用显著。将不同茎段和不同时间的9个处理进行多重比较可知,春季上部茎段消毒7 min与春季中部茎段消毒10 min、春季下部茎段消毒7 min均存在显著差异。且处理组合中污染率最低的是春季中部茎段消毒10 min,污染率仅为0.8%。
对于春季上、中、下3个部位的茎段,春季中部茎段的消毒效果最好,污染率的均值都最低为6.12%,下部茎段最差,污染率达16.5%,是上部和中部污染率的2倍多。对于上部茎段,污染率随着消毒时间的增长而增高,但是它们之间并无显著差异;对于中部茎段,在消毒4 min与消毒10 min时存在显著差异,随着消毒时间的增加,污染率呈降低的趋势,在消毒10 min时,污染率仅为0.8%;对于下部茎段,消毒时间之间无显著差异,且污染率随着消毒时间的增加先升高后降低,在10 min时污染率最低为3.0%。因此选择春季茎段中部在消毒10 min后进行离体培养最为合适。
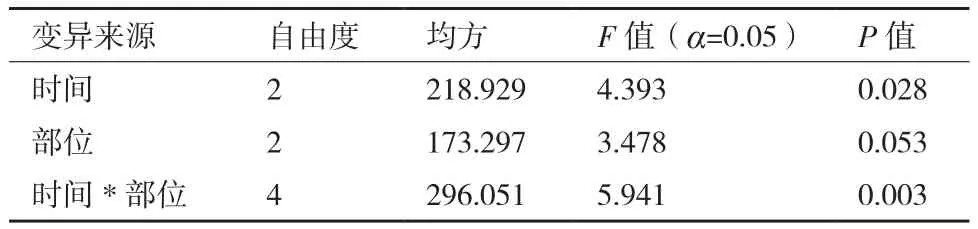
表3 升汞消毒时间和春季不同茎段部位对茎段污染率的方差分析(α=0.05)

图1 春季不同茎段部位和不同消毒时间的组合处理的多重比较
2.2 消毒时间对种子污染率的影响
将种子接种于已灭菌的无任何添加的MS培养基上,4周之后统计污染率,结果如图2-A所示。种子接种2周内几乎无污染,子叶逐渐长出,4周之后子叶完全突破种皮,种皮逐渐脱落(图2-B)。0.1%升汞的消毒时间对种子污染率有显著的影响(P=0.011);随着消毒时间的增加,污染率呈现先降低后升高的趋势;消毒时间4 min与消毒时间3 min、5 min均存在显著差异;且消毒时间为4 min时,污染率最低为2.4%;所以种子用0.1%升汞消毒的最佳时间为4 min。
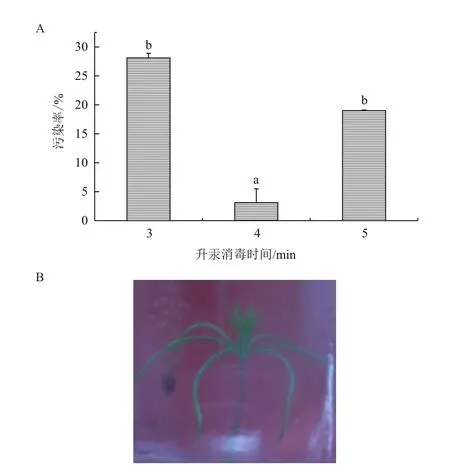
图2 升汞消毒时间对种子污染率的影响(A)及种子萌发的顶芽(B)
2.3 茎段腋芽诱导基本培养基的选择
将无污染的茎段接种于不同培养基上进行腋芽的诱导,培养3周后,统计分化系数和诱导率进行方差分析,接种1周之后,春梢茎段基部愈伤组织较多,腋芽逐渐长出,但是并不是所有的春梢茎段腋芽均有长出,在接种前已有腋芽的腋芽逐渐变大(图 3-B)。
由表4和图3-A可知:不同培养基对晚松茎段腋芽分化系数和诱导率均存在显著差异。对于腋芽分化系数和诱导率,MS基本培养基与GD和DCR培养基均存在显著差异,且在MS培养基上腋芽的分化系数和诱导率均最高,分别为2.10和77.8%。在MS基本培养基上腋芽的分化系数是GD基本培养基的1.4倍;对于腋芽的诱导率,MS培养基的诱导率比DCR高21.8%。培养基对茎段腋芽诱导大小的排列顺序为:MS>GD>DCR;培养基对于腋芽分化系数高低的排列顺序为:MS>DCR>GD。综上,茎段腋芽诱导和分化最佳的培养基为MS培养基。
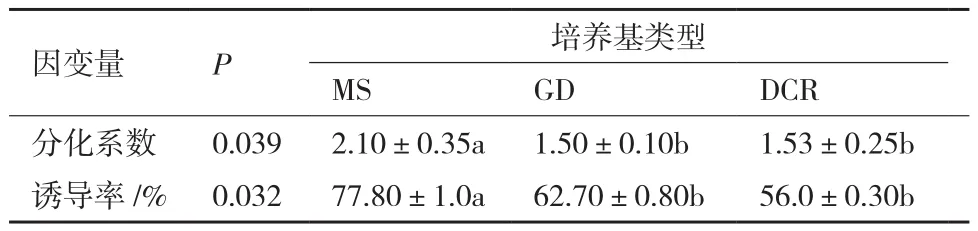
表4 培养基的类型对芽分化系数和诱导的方差分析及多重比较(α=0.05)

图3 培养基类型对腋芽诱导率和分化系数的影响(A)及春梢茎段诱导腋芽(B)
2.4 激素浓度组合对腋芽诱导的影响
培养4周之后统计芽的分化系数,方差分析的结果如表5所示:6-BA和NAA不同浓度的组合对腋芽的分化存在极显著差异(P<0.01),二者的交互作用也存在显著差异。根据F值的大小,对茎段腋芽诱导影响大小的顺序依次为:6-BA浓度>NAA浓度>6-BA浓度*NAA浓度。因此,对于腋芽的诱导起主要作用的是6-BA,其次是NAA。
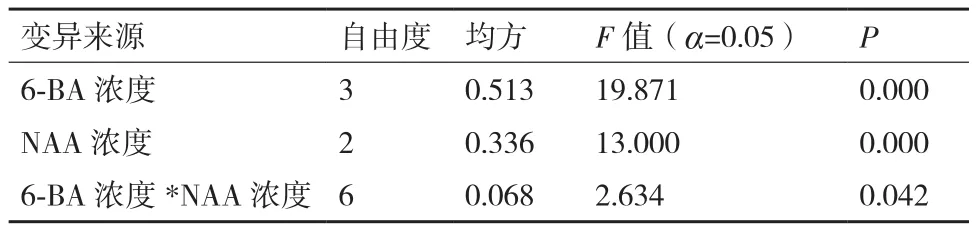
表5 6-BA和NAA不同浓度之间的组合对芽分化系数影响的方差分析
图4为6-BA和NAA组合对腋芽分化系数的多重比较。组合依次为1、2、3、4、5、6、7、8、9、10、11和12。处理6与处理1和处理9存在显著差异;处理9的腋芽分化系数最大,是2.27。当6-BA为2.5 mg/L时,腋芽的分化系数均值最高为1.79;当NAA为0.2 mg/L时,腋芽的分化系数最高均值为1.89。当6-BA浓度在1.0-4.0 mg/L时,腋芽分化系数最高均是NAA浓度为0.2 mg/L,分别为1.67、1.93、2.27和1.7。当NAA为0.0mg/L时,6-BA浓度中的1.0 mg/L与2.0 mg/L、2.5 mg/L、4.0 mg/L存在显著差异,且当6-BA为2.0 mg/L时,腋芽的分化系数最高,为1.8;当NAA为0.1 mg/L时,6-BA浓度中的1.0 mg/L与2.5 mg/L存在显著差异,且当6-BA为2.5 mg/L时,腋芽的分化系数最高为1.9;当NAA为0.2 mg/L时,6-BA 浓度中的2.0 mg/L与2.5 mg/L存在显著差异,当6-BA为2.5 mg/L时,腋芽的分化系数最高为2.27。综上可知:最适合腋芽诱导的激素组合为:2.5 mg/L 6-BA + 0.2 mg/L NAA。在这个阶段,腋芽的生长状态较在基本培养基中生长良好,腋芽的数量和质量较好(图4-B)。
2.5 种子顶芽腋芽的诱导
将种子萌发后,截取顶芽,接种于不同培养基类型、不同激素浓度组合的培养基上培养4 d后统计分化系数,并进行极差分析和方差分析,结果如表6和表7。接种前2周,顶芽逐渐健壮,基部膨大有愈伤组织,在顶芽与茎之间会有腋芽产生,或者在顶芽的上段逐渐会抽出长的新芽(图5),培养基的类型、6-BA的浓度和NAA的浓度对种子顶芽的分化系数差异均不显著。根据极差R值的大小可知:对种子顶芽分化系数影响最大的是6-BA,其次是培养基的类型,效果最差的是NAA;当6-BA为1.0 mg/L时,诱导芽分化的效果最佳是2.6,随着6-BA浓度的升高,芽的分化系数逐渐降低,且出芽率低;MS培养基诱导芽分化的效果最佳,分化系数为1.7,其次为DCR培养基,最差的是GD培养基;当NAA为0.7 mg/L时,芽的分化效果最好为2.3,随着NAA浓度的增加,芽的分化系数逐渐增大。综上可知:诱导种子顶芽分化最适合的培养基组合为A1B3C1,即MS培养基+0.7 mg/L NAA + 1.0 mg/L 6-BA。
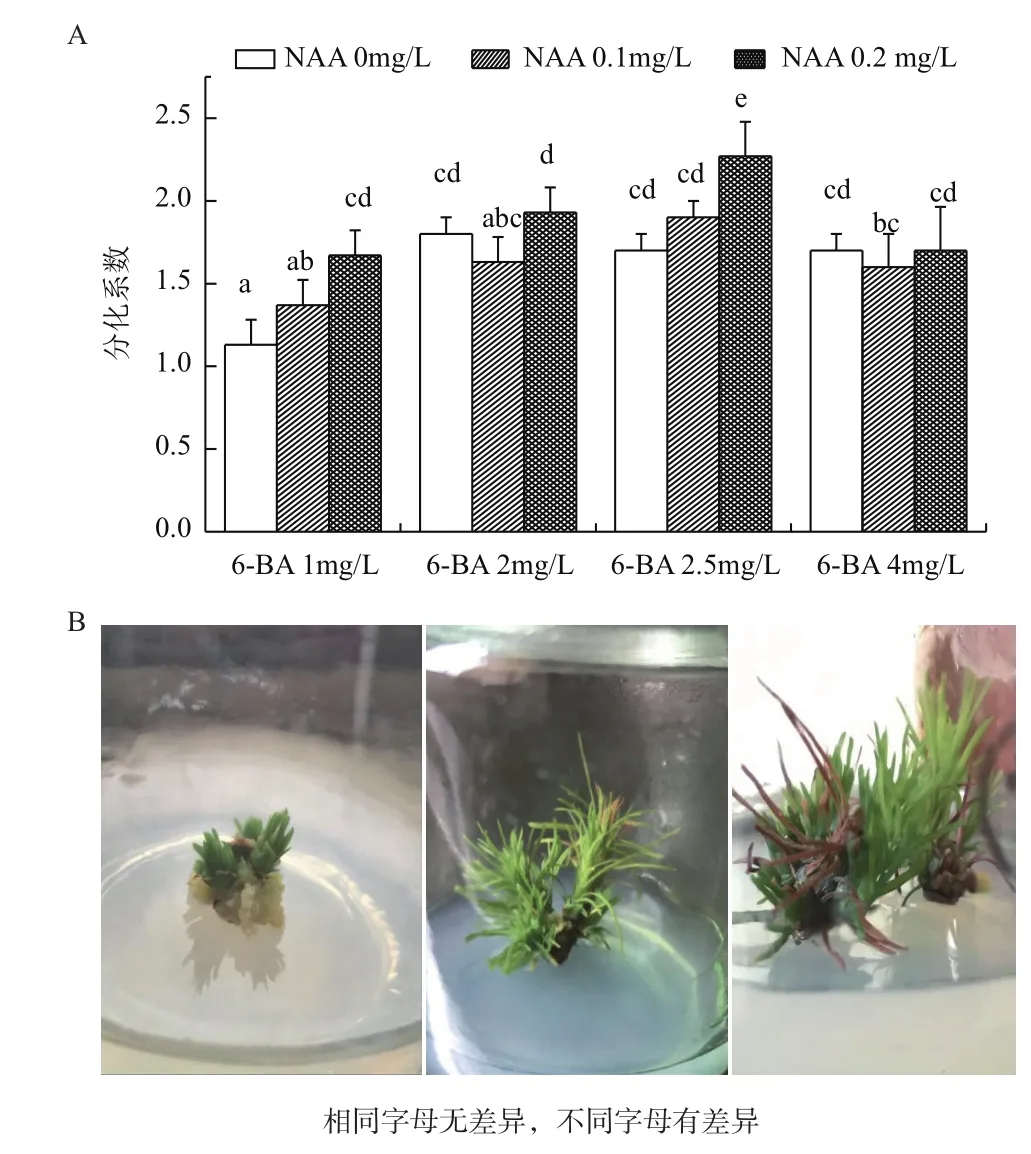
图4 6-BA和NAA组合对腋芽分化系数的多重比较(A)及春梢茎段腋芽诱导的状态(B)

表6 不同培养类型、6-BA和NAA对腋芽分化系数的极差分析
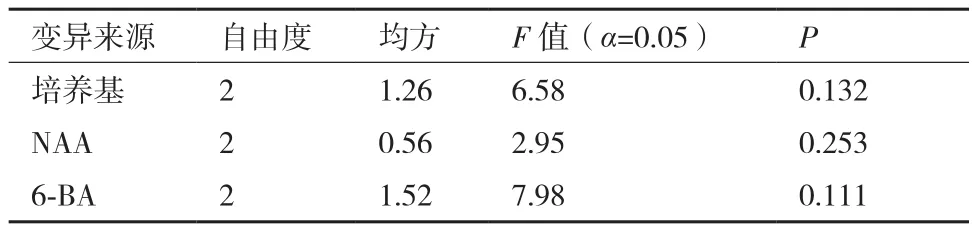
表7 不同培养类型、6-BA和NAA对腋芽分化系数的方差分析

图5 种子顶芽诱导腋芽的不同状态
3 讨论
植物组织培养第一步,无菌体系的建立,通常使用的消毒剂有:0.01%-1%升汞、2%-5%次氯酸钠、70%-75%酒精等。不同的植物在自然生长的条件下,自身所携带的菌有所不同,所采用的消毒剂和消毒时间的选择很重要[12]。消毒剂杀死微生物的同时也会对外植体产生一定的伤害,因此,使用时应当考虑消毒剂的浓度与杀毒的时间。对于松科树种的茎段消毒中,最常用的消毒剂0.1%升汞消毒6-10 min[13]。升汞作为最常用的消毒剂,杀菌能力最强,一般浓度控制在0.01%-1%。2006年方丽娟[14]对湿地松茎段进行消毒采用的方法是:75%的酒精浸泡10-15 s,0.1%升汞消毒4 min。2010年何月秋[15]对湿地松茎段消毒采用酒精先浸泡30 s,然后升汞灭菌10 min。2010年常金财[16]以2年生的湿加松的茎尖为外植体进行组织培养体系的建立,最佳消毒处理是70%消毒10 s+0.1%升汞消毒6.5 min。吴丽君[17]建立湿地松和火炬松离体培养再生技术时候,选用的75%的酒精和0.1%升汞或者是次氯酸钠进行消毒;因此,本试验阶段消毒所选用的消毒剂为75%酒精和0.1%升汞相结合。2017年Huang[18]以北美秋海棠为材料,进行脱菌优化试验,在MS培养基中添加250 mg/L羧苄青霉素和50 mg/L卡那霉素,效果最好。在后期的试验中可以借鉴此方法对茎段进行内生菌和外生菌的消毒。本试验对春季茎段进行消毒以筛选晚松春季最佳部位及最佳消毒时间,其中最佳部位为中部茎段,消毒方案是酒精先消毒30 s,0.1%升汞消毒7 min,污染率最低,为0.8%。种子消毒采用的也是酒精和升汞结合,由于种子有保护组织且细胞分裂旺盛,所以消毒时间缩短到3-5 min,最佳的时间为4 min,污染率仅为2.4%。
基本培养基的类型和激素对植物组培体系的建立都起着关键作用。适合松类的组培有:DCR培养基、GD培养基和MS培养基,其中MS培养基是适合多种植物组培的最普遍的培养基之一。这3种培养基之间最大的区别在于大量元素中盐分的含量不同,其中MS培养基中大量元素N、P的含量明显高于GD和DCR培养基,有文献表明,高盐度的培养基对大多数松类器官的分化有毒害作用[2,14,19-20],而2003年陈顺伟[21]对11个树种的耐盐性研究发现:晚松的抗盐性仅次于木荷和杜英;2006年程磊[22]以不同浓度的氯化钠溶液对晚松盆栽苗进行胁迫试验,测定分析质膜透性,发现晚松针叶的质膜系统能忍耐100 mmol/L以下的盐胁迫;说明晚松的抗盐能力较强,因此MS培养基是晚松的最佳培养基。
植物激素主要包括植物天然激素和人工合成激素,通过外源激素的添加来改变内源激素的平衡进而定向调控植物的花、果实、根和叶的良好生长,主要有以下5类:细胞分裂素、生长素、赤霉素、脱落酸和乙烯;组培中调控外植体的愈伤、芽的诱导以及生根主要是通过添加生长素和分裂素,生长素主要促进细胞的伸长生长,种类有很多,例如,NAA(萘乙酸)、IAA(吲哚乙酸)等;分裂素主要促进细胞的分裂、诱导芽的形成和分化,主要包括6-BA(6-苄基氨基嘌呤)、ZT(玉米素)、KT(激动素);二者之间的浓度比例与诱导外植体发芽或生根有着密切的联系,生长素与分裂素比值高,有利于根的形成;比值低,则有利于芽的形成;比值适中有利于愈伤组织的形成。有关文献报道,6-BA对茎段的腋芽诱导效果最好,与生长素中的NAA配合的效果也较好[23],低浓度的6-BA及6-BA与NAA比值低都不利于诱导腋芽;NAA对芽的诱导有协同作用,当只用6-BA或高浓度的6-BA会导致植物脆化、矮化,无丛生芽的产生,但添加适量浓度 NAA,则有较好的诱导效果,也对芽的生长促进作用非常明显[24-25]。2017 年 Li[26]研究香樟(Cinnamomum camphora)组织培养和快繁技术时,发现在MS培养基中添加2.0 mg/L 6-BA和0.2mg/L NAA 时,腋芽生长约为0.5-1.0 cm。2017年Yang[27]在研究红冠桉(Corymbia ptychocarpa)组织培养时发现,经过灭菌的带腋芽的茎尖在添加 6-BA 和 NAA 的MS培养基中培养30 d,诱导率达93.3%。所以本研究在初期的试验中选用 6-BA 和 NAA,这二种激素都可以高温灭菌,结构稳定,试验表明对于春季茎段,随着6-BA浓度的升高,芽的分化系数先升高后降低;同时随着NAA浓度的升高,对芽的诱导有一定的促进作用;当6-BA为2.5 mg/L,NAA为0.2 mg/L时,春季茎段芽分化系数达2.27。对于种子顶芽,当6-BA浓度在1-3 mg/L时,芽的分化系数逐渐降低,NAA的添加促进芽分化,芽基部在7 d左右会产生愈伤组织,但是随着NAA浓度的增加,芽的分化系数逐渐升高,适合种子顶芽分化的最佳培养基为MS +0.7 mg/L NAA + 1.0 mg/L 6-BA,分化系数为2.6。
4 结论
本实验研究了晚松春季茎段、种子诱导腋芽的过程,成功地筛选最适合的培养基类型、激素的浓度。对于春梢茎段,0.1%的升汞消毒处理10 min的春梢中部茎段最佳,污染率最低,为0.8%,其腋芽诱导的最佳培养基和激素浓度为:MS + 2.5 mg/L 6-BA + 0.2 mg/L NAA。而对于种子,最佳消毒时间为4 min,污染率为2.4%,在含有0.7 mg/L NAA和 1.0 mg/L 6-BA的MS培养基中诱导效率最高。
[1] 杨克美, 张均, 田惠珍. 晚松萌发力试验初报[J]. 林业科技通讯. 1997(7):26-28.
[2]阙国宁, 房建军, 葛万川, 等. 火炬松、湿地松、晚松组培繁殖的研究[J]. 林业科学研究, 1997, 10(3):4-9.
[3] 张守英, 阙国宁. 晚松悬浮细胞系的建立和原生质体的分离[J].林业科学研究, 2002, 15(2):247-251.
[4]范岳霞. 彰武松组织培养初步研究[D]. 太原:山西大学,2013.
[5]朱丽华. 湿地松、火炬松和黑松的组培繁殖技术研究[D]. 南京:南京林业大学, 2004.
[6]暴甜, 苏淑钗, 高赫, 等. 毛梾优良无性系组培体系建立[J].中南林业科技大学学报, 2017(6):70-74.
[7]孙小兵, 郭素娟. 成龄板栗组培快繁体系的建立及影响因素的研究[J]. 中南林业科技大学学报, 2015(4):51-55.
[8]唐婷婷. 马尾松优良种源桐棉松组培技术的研究[D]. 南宁:广西大学, 2015.
[9] 王喆, 卢正茂. 不同外植体激素对引鸟花楸组培繁育的影响[J].防护林科技, 2014(9):21-22.
[10]张娜. 毛梾腋芽诱导关键因子研究与培养体系优化[J]. 山西农业大学学报:自然科学版, 2017(9):635-639.
[11]胡燕梅, 方中明. ‘南大’蓝莓试管苗快速繁殖体系的建立[J].江西师范大学学报:自然科学版, 2017(3):234-237.
[12]汪腾越, 周再知, 裘珍飞, 等. 土沉香组织培养外植体消毒方法的研究[J]. 中南林业科技大学学报, 2012, 32(3):44-48.
[13] 李林. 白皮松和美国黄松组织培养及快繁技术研究[D]. 杨凌:西北农林科技大学, 2004.
[14]方利娟. 杂交松组织培养技术研究[D]. 南宁:广西大学,2006.
[15] 何月秋. 湿地松茎段组织培养及植株再生[J]. 林业实用技术,2010(6):28-29.
[16]常金财, 宗亦臣, 郑勇奇等. 湿加松外植体消毒及初始培养基筛选研究[J]. 中国农学通报, 2010, 26(3):129-133.
[17]吴丽君. 湿地松、火炬松离体培养植株再生技术的研究[D].南京:南京林业大学, 2008.
[18] Huang J, Liu Y. Optimization of technology for north American begonia taking off bacteria by tissue culture[J]. Northern Horticulture, 2017.
[19]周微, 黄健秋, 卫志明, 等. 云南松成熟胚的不定芽诱导及植株再生(简报)[J]. 植物生理学通讯, 1995, 31(5):351-353.
[20]普晓兰, 林萍, 李乡旺. 五针白皮松离体胚培养初步研究[J].西南林学院学报, 1997, 17(1):18-21.
[21]陈顺伟, 高智慧, 岳春雷, 等. 盐雾胁迫下杜英等树种生理特性的变化[J]. 南京林业大学学报:自然科学版. 2003, 27(5):11-14.
[22]程磊, 刘苑秋, 文娟. 盐胁迫对晚松生理特性的影响[J]. 江西农业大学学报, 2006, 28(3):382-385.
[23]朱建华, 彭士勇编著. 植物组织培养实用技术[M]. 北京:中国计量出版社, 2002.
[24]李杰. 几种名贵洋兰转基因受体系统的建立及遗传转化[D].南京:南京林业大学, 2005.
[25]张兆功, 邵登魁, 李莉, 等. NAA、6-BA对不同熟性甘蓝子叶期愈伤组织诱导的影响及其丛生芽发生[J]. 西北农业学报,2011, 20(1):128-132.
[26] Li Y, Wu X. Tissue culture and fast propagation techniques of Cinnamomum camphora[J]. South China Forestry Science,2017, 45(1):5-9.
[27] Yang Y, Wang R. Multiplication of Corymbia ptychocarpa subsp.aptycha via tissue culture[J]. Australian Forestry, 2016, 79(1):59-62 .

