微囊藻毒素-LR的定量荧光纳米微球免疫层析检测
张艺 丁新良 张珏 周彬 郭明明 黄飚
(江苏省原子医学研究所 卫生部核医学重点实验室 江苏省分子核医学重点实验室,无锡 214063;无锡市疾病预防控制中心,无锡 214023)
微囊藻毒素(MC)是一种环状七肽物质,是古生物蓝藻的代谢释放产物,有多种异构体,对动物和人有强烈的肝毒性[1-2]。其中最常见、水体含量高、毒性最大的是MC-LR,能诱发肝癌,低剂量的MC-LR还能损伤神经细胞、生殖细胞,甚至危害肾、肺等器官[2-8]。在淡水水体富营养化的今天,蓝藻爆发事件时有发生,代谢产物MC-LR对人类的健康构成了严重威胁,而此毒素在水体中自然降解缓慢,使用现行自来水处理工艺难以去除[9-14]。鉴于此,我国制定标准《GB5749-2006》要求对饮用水、湖泊水、河水和地表水的MC-LR含量进行定期监测。
因为检测手段的便利程度和准确程度,关系到各水厂和环保单位,关系到对蓝藻水华的控制、对水环境的综合治理,关系到居民饮用水安全和经济发展,意义重大。因此,建立符合我国实际情况,快速、准确、现场检测MC-LR的方法,必要而且迫切,具有良好的应用前景和推广价值。
目前常用的MC-LR检测方法包括:高效液相色谱法和酶联免疫法[15-18],这些方法各自的特点如下:前者测得结果准确,但采用的仪器昂贵、操作繁琐、成本高;以后者为代表的免疫分析方法价格低、操作相对简单,但存在或仅能定性、准确度欠佳,或不能单样本检测等缺点,因此上述方法不能实现准确、快速、定量测定MC-LR。因此,本研究拟解决上述问题,运用试纸条层析的优势,建立可快捷、定量、简单检测该毒素的一种方法,并研制相应的试剂。
1 材料与方法
1.1 材料
1.1.1 实验样品 水样源于无锡太湖水域,由无锡市疾控中心采样、收集。检测前,样品用0.45 μm膜过滤后,取澄清。
1.1.2 试剂与耗材 MC-LR标准品、MC-LR-牛血清白蛋白(MC-LR-BSA)、抗MC-LR多克隆抗体、MC-LF,均由无锡市疾病预防控制中心提供。羊抗鼠IgG由武汉华美提供。含有荧光染料异硫氰酸的高分子纳米微球,购自biodot公司。样品垫、硝酸纤维素膜、吸水纸和卡壳,购自杰一公司。碳二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS)由Sigma公司提供。MC-LR ELISA试剂盒,由江苏省苏微微生物研究有限公司提供。其他试剂均为沪试分析纯。1.1.3 仪器 免疫层析定量分析仪,上海互帼公司;ELX800酶标仪,美国BioTek公司;5417R离心机,美国Eppendorf 公司;超声仪,深圳洁康公司;喷金划膜仪和切条机,杭州赛凯生物公司。
1.2 方法
1.2.1 试纸条的制备
1.2.1.1 MC-LR抗体的预处理 将MC-LR单克隆抗体、MC-LR-BSA和羊抗鼠IgG,分别用0.05 mol/L(pH 7.2)的磷酸盐缓冲液在4℃下透析过夜。
1.2.1.2 结合垫的制备 在高分子纳米微球溶液中加入碳二亚胺(EDC)(终浓度为20 mmol)和预处理过的MC-LR抗体,室温反应2 h,离心,去除上清液后,加入样品稀释液(含有1%BSA的0.05 mol/L,pH 7.2的磷酸盐缓冲液)至微球浓度为1.0 g/L,待用。用喷金划膜仪以3 μL/cm-5 μL/cm的量将制备好的微球喷涂于聚酯膜形成的结合垫上,避光的条件下于35-38℃烘干1 h,加入干燥剂封存备用。
1.2.1.3 硝酸纤维素膜的制备 使用含1%蔗糖的0.02 mol/L,pH 7.4的磷酸盐缓冲液,分别将透析过的MC-LR-BSA抗原和1 g/L的羊抗鼠IgG抗体,使用定量喷膜仪以1 μL/cm的量将两者以一定的间隔喷于硝酸纤维素膜上,35-38℃烘干1 h,加入干燥剂封存备用。
1.2.1.4 试纸条的组装 在底板中间先铺设硝酸纤维素膜,然后在与质控线相临近的一端铺吸水纸,使吸水纸与硝酸纤维素膜部分重叠;在与检测线相临近的一端铺结合垫,使硝酸纤维素膜与结合垫部分重叠;最后贴样品垫。试纸条结构如图1所示。用切条机切按0.4 cm宽度斩切后,装入塑料卡壳中。
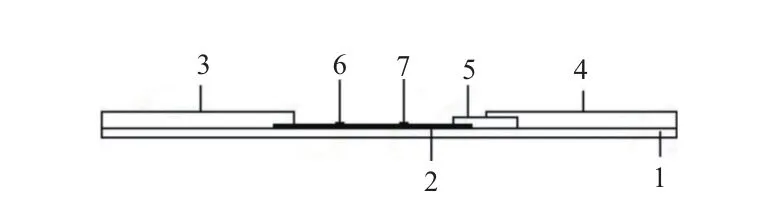
图1 MC-LR-POCT试纸条结构
1.2.2 反应过程 使用前,先将试纸条和其他试剂室温放置15 min。将10 μL样品或者MC-LR标准品与50 μL样品缓冲液,滴加入试纸条的样品垫上,室温放置一定时间后,将试纸条卡壳放入检测仪器中读数,仪器可根据测定荧光值自动计算出样品的MC-LR浓度值。
1.2.3 统计学分析 每个样品均检测3次,对应数据用均值(X)或X±变异系数(X±SD)表示。用Origin 8.0软件绘制曲线。
2 结果
2.1 反应原理
MC-LR-荧光纳米免疫层析采用竞争型反应,经毛细管作用,样品中的MC-LR向结合垫方向移动,然后,带动了结合垫处耦联着MC-LR抗体的荧光微球向硝酸纤维素膜方向移动。当混合物到达检测线时,游离抗原、固定相人工抗原与荧光微球表面的抗体竞争结合,最终在检测线处形成抗原-抗体复合物。未被检测线捕获的微球,将与质控线上的羊抗鼠二抗,形成免疫复合物。其中,样品中MC-LR的含量与检测线上的荧光强度呈反比,荧光信号的强弱由数值显示,这使得样品浓度的定量成为可能。
2.2 检测线抗原浓度的选择
检测线抗原的浓度与抗体结合的效率决定了反应的信号强度,因此本研究率先探讨了检测线上MC-LR人工抗原的含量。使用1 μg/mL微球喷涂与结合垫,针对空白样品做检测,结果见图2。由图所示,0.5 g/L的MC-LR人工抗原适合喷涂在检测线上,此时可以在检测线获得较高的荧光信号。
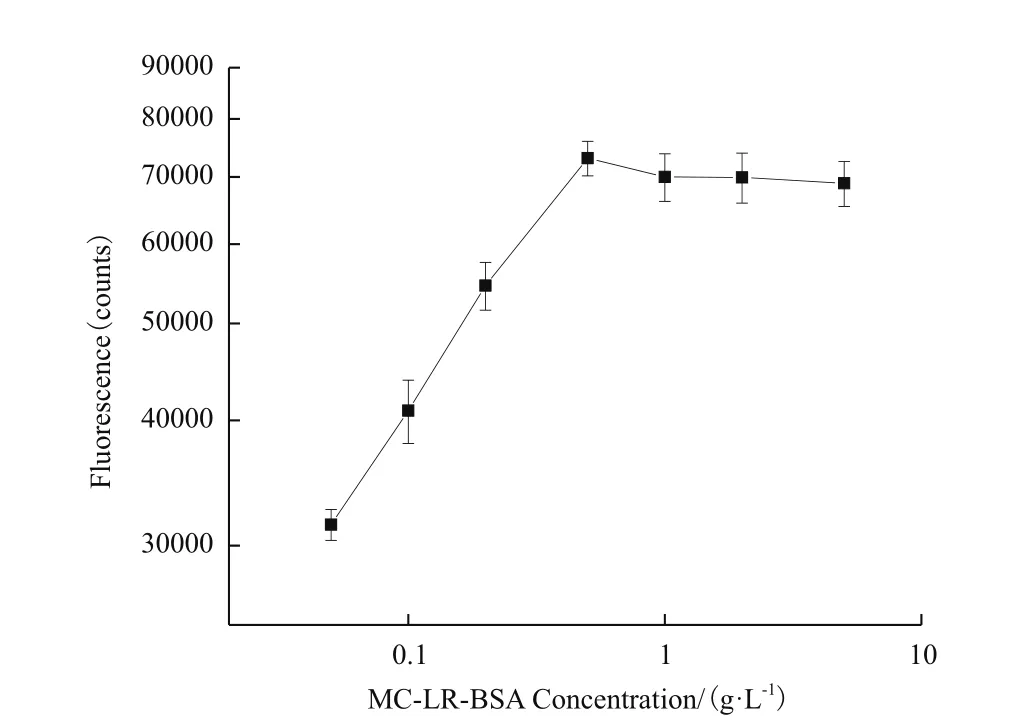
图2 检测线上MC-LR-BSA含量与荧光信号强度的关系
2.3 微球标记量的选择
预处理过的MC-LR抗体和微球按照不同的质量比1∶200-1∶10,与EDC混合反应。获得的微球按照1 μg/L喷涂在结合垫上。用0和1 μg/L的MC-LR标准品作为样品,考察按照不同质量比标记的微球对反应结果的影响。测0 μg/L浓度样品时,有最高荧光值B0;1 μg/L与0 μg/L的比值B0/B1作为竞争反应效率的反映,比值越大,说明1 μg/L与空白浓度的区分度越大。结果见图3,可知抗体与微球反应比率为1∶50(wt∶wt)时,免疫反应竞争结合效率较高,空白样本的荧光值也相当较高,因此选为本研究的工作比率。

图3 微球标记量对结果的影响
2.4 结合垫微球浓度的选择
将微球用含有1%BSA,0.1%NaN3的0.05 mol/L,pH7.2的磷酸盐缓冲液稀释到0.12 μg/mL,0.25 μg/mL,0.5 μg/mL,1.0 μg/mL 等不同的浓度,并进行喷涂等处理,然后按前述方法反应检测。结果见表1,从上面的数据可以看到,喷涂不同的微球浓度,检测结果误差不同。当微球浓度较低时,标记抗体量不足,导致检测结果偏低,误差过大。当喷涂浓度为0.5 μg/L或以上时,误差降低,可控制在10%以内,从成本考虑,0.5 μg/mL的喷涂浓度合适。
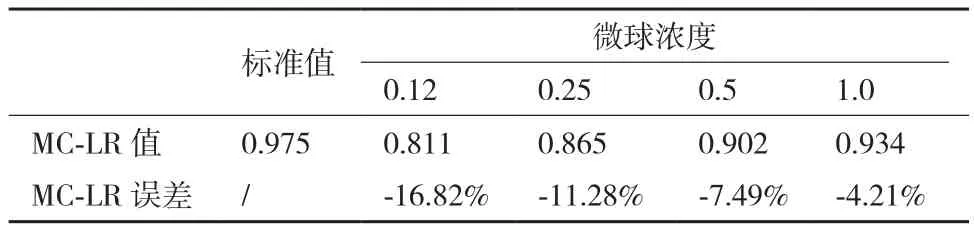
表1 微球浓度对检测结果的影响(μg/mL)
2.5 标准曲线的获得
根据优化的条件制备MC-LR免疫层析试纸条,即以0.5 g/L的MC-LR人工抗原喷涂检测线,抗体与微球反应比率为1∶50,使用该微球以0.5 μg/L的浓度喷涂于结合垫上。在试纸条的加样区加入不同浓度的MC-LR标准品(取6个不同的浓度,分别为0 μg/L、0.5 μg/L、1 μg/L、2 μg/L、5 μg/L,每个浓度做5个平行样)。膜层析反应 15 min后,仪器读取T、C线信号,以检测的样品荧光值信号为纵坐标,MC-LR标准品浓度为横坐标,建立方程并拟合得到标准曲线y= 730.42x2- 6158.4x+ 14665(R2= 0.985),见图4,然后通过该标准曲线得到标准卡,作为对样品中所含MC-LR浓度进行定量分析的基础。
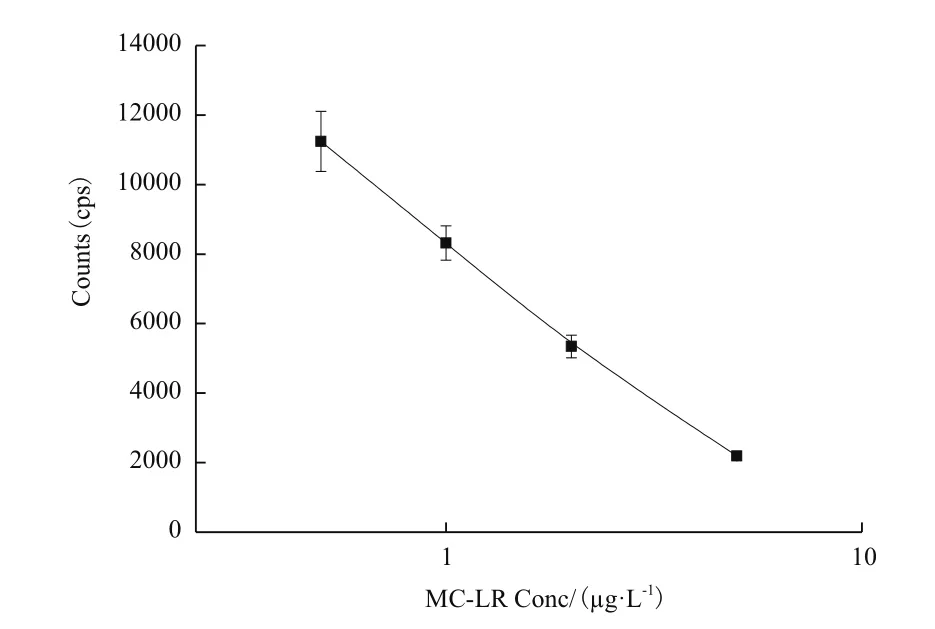
图4 MC-LR荧光纳米免疫层析法的工作曲线
2.6 性能的评估
2.6.1 灵敏度 采用重复测定10孔空白标准品荧光值,以X-2SD计算,再带入标准曲线获得对应的浓度值,即为本研究测定MC-LR的灵敏度0.195 μg/L。2.6.2 准确性 本方法的准确性由添加回收率反映,即向空白水样中添加0.5、2 μg/L低、高浓度的标准物质,对应的MC-LR浓度分别为0.517±0.041和1.906±0.095 μg/L。回收率分别为103.4%和95.3%,平均回收率99.4%。方法回收率于90%-110%内,说明本研究的检测结果准确。
2.6.3 可靠性与精密度 取试纸和市售的MC-LR酶联免疫试剂盒(ELISA),分别测试同一样品,重复3次,验证试纸的检测结果准确性。表2结果说明:用该试纸和市售试剂盒检测的误差均小于10%,本方法的变异系数(SD/X)小于10%,该试剂的检测结果准确可靠。
2.6.4 特异性 MC-LF为MC-LR的异构体,三孔测定2 μg/L 的MC-LF对应的MC-LR含量,结果交叉反应率为1.75%,说明本方法采用的单克隆抗体特异性较好。
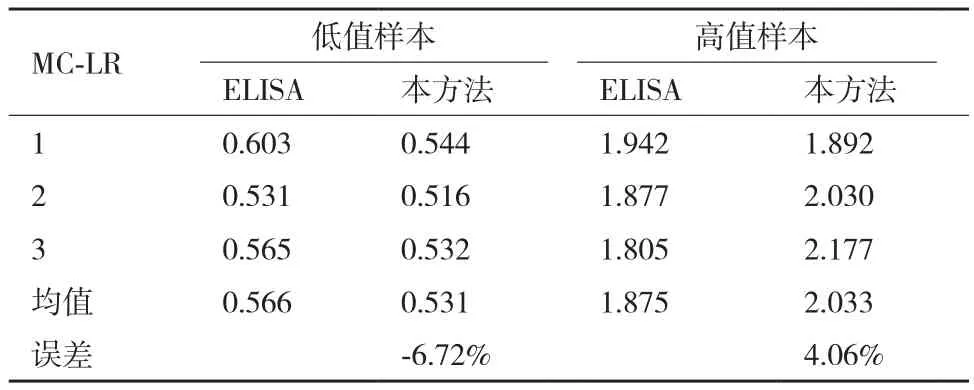
表2 不同浓度样本的MC-LR测定结果(μg/L)
2.6.5 稳定性 在加速稳定性试验中,将试剂于37℃放置6 d若稳定,则代表该试剂可在2-8℃保存6个月。将市售的MC-LR-ELISA试剂与37℃放置6 d的试剂比较,标准品系列的荧光强度下降幅度低于10%,说明试剂在2-8℃可以保存6个月,可满足实际使用的需要。
3 讨论
随着生物传感技术的发展,以及设备的小型化、便捷化,免疫层析技术得到进一步发展和快速推广应用。采用这一方法研发的试剂,一般情况下,加样15 min后,即可读取检测结果[19]。常见的免疫层析标记物为胶体金,对应的试纸条不需外部检测仪器,只需裸眼即可读取检测结果,可用于定性分析,区分阴阳性结果[18,20-21]。但这种标记物不能用于精确定量检测,也很难将弱阳性结果区分开来。因此,尤其对MC-LR这样需要定量分析的小分子物质,传统的免疫层析技术尚不能完全满足监测要求。
本实验所述定量检测MC-LR的纳米荧光免疫层析试剂将纳米荧光免疫技术、竞争法测抗原与具体试纸结构相结合,形成了一种可用于单次、定量检测MC-LR含量的试纸条,解决了现有纳米荧光荧光分析技术中MC-LR试剂不适合单样本、小批量检测的问题,也解决了现有的免疫层析技术仅能定性,不能准确定量的问题。本方法所述MC-LR高分子纳米微球,解决了荧光染料发光效率低从而造成检测不准确的问题,进而提高了检测灵敏度,达到0.195 μg/L,远低于1 μg/L的国家标准。方法的线性工作范围达到5 μg/L,特异性强,与市售商品化试剂盒一致性好,因此可以满足实际使用需求。
4 结论
本研究开发的定量检测MC-LR的纳米荧光免疫层析试纸,由荧光免疫层析试纸条和外壳组成,简单操作,性能稳定,对试剂长期存储有利;采用的仪器小,对工作环境要求低,便于推广使用。所述MC-LR检测试纸条灵敏度高,准确性好,操作快捷,具有实用性和良好的应用前景。
[1] 郁晞, 高红梅, 彭丽霞, 等. 淀山湖微囊藻毒素-LR的污染状况及居民肝功能的调查[J]. 环境与职业医学, 2010, 27(3):153-155.
[2] Dietrich D, Hoeger S. Guidance values for microcystins in water and cyanobacterial supplement products(blue-green algal supplements):a reasonable or misguided approach ?[J].Toxicology & Applied Pharmacology, 2005, 203(3):273-289.
[3] Covaci O I, Sassolas A, Alonso G A, et al. Highly sensitive detection and discrimination of LR and YR microcystins based on protein phosphatases and an artificial neural network[J]. Analytical &Bioanalytical Chemistry, 2012, 404(3):711-720.
[4] Li Y, Han X. Microcystin-LR causes cytotoxicity effects in rat testicular Sertoli cells[J]. Environmental Toxicology &Pharmacology, 2012, 33(2):318.
[5] 周珏, 刘冉, 李晓波, 等. 微囊藻毒素-LR对PC12细胞氧化性损伤作用的实验研究[J]. 癌变突变畸变, 2012, 24(5):349-351.
[6] He S, Liang XF, Sun J, et al. Induction of liver GST transcriptions by tert -butylhydroquinone reduced microcystin-LR accumulation in Nile tilapia(Oreochromis niloticus)[J]. Ecotoxicology &Environmental Safety, 2013, 90(3):128-135.
[7] Wang J, Lin F, Cai F, et al. Microcystin-LR inhibited hippocampal long-term potential via regulation of the glycogen synthase kinase-3β pathway. [J]. Chemosphere, 2013, 93(2):223-229.
[8] Xu P, Zhang XX, Miao C, et al. Promotion of melanoma cell invasion and tumor metastasis by microcystin-LR via phosphatidylinositol 3-kinase/AKT pathway. [J]. Environmental Science & Technology,2013, 47(15):8801-8808.
[9] 夏商周, 杨朝晖. 微囊藻毒素的检测及危害研究进展[J]. 四川环境, 2012, 31(3):90-93.
[10] Li D, Yu Y, Yang Z, et al. The dynamics of toxic and nontoxic Microcystis during bloom in the large shallow lake, Lake Taihu,China[J]. Environmental Monitoring & Assessment, 2014, 186(5):3053-3062.
[11] 胡新梅, 农清清, 赵惠柳, 等. 广西地区原发性肝癌患者血清微囊藻毒素-LR水平研究[J]. 中国全科医学, 2017, 20(11):1330-1334.
[12] 万翔, 邰义萍, 王瑞, 等. 洱海水华期间饮用水源区产毒微囊藻和微囊藻毒素-LR的分布特征[J]. 环境科学学报, 2017,37(6):2040-2047.
[13] 王阳, 徐明芳, 耿梦梦, 等. 基于Monte Carlo模拟法对水源水体中微囊藻毒素的健康风险评估[J]. 环境科学, 2017, 38(5):1842-1851.
[14] 姜蕾. 不同工艺给水厂对典型微囊藻毒素的去除研究[J].给水排水. 2017, 53(9):11-15.
[15] Poon KF, Lam MH, Lam PK, et al. Determination of microcystins in cyanobacterial blooms by solid-phase microextraction-highperformance liquid chromatography[J]. Environ Toxicol Chem,2001, 20(8):1648-1655.
[16] Mountfort DO, Holland P, Sprosen J. Method for detecting classes of microcystins by combination of protein phosphatase inhibition assay and ELISA :comparison with LC-MS[J]. Toxicon, 2005,45(2):199-206.
[17] 沈强, 李嗣新, 胡俊. 微囊藻毒素HPLC快速检测方法研究[J].环境科学与技术, 2017(2):103-106.
[18] Liu L, Xing C, Yan H, et al. Development of an ELISA and immunochromatographic strip for highly sensitive detection of microcystin-LR[J]. Sensors, 2014, 14(8):14672.
[19] 刘鑫. 荧光免疫层析分析仪的设计分析[J]. 生命科学仪器,2015(3):23-26.
[20] Zhang GP, Guo JQ, Wang XN, et al. Development and evaluation of an immunochromatographic strip for trichinellosis detection[J].Veterinary Parasitology, 2006, 137(3):286-293.
[21] Wen-de W, Min L, Ming C, et al. Development of a colloidal gold immunochromatographic strip for rapid detection of Streptococcus agalactiae in tilapia[J]. Biosensors & Bioelectronics, 2016, 91 :66-69.

