智能放射吸收法的临床应用
——人体手臂骨骨密度的测量及其骨质疏松的评估
陈建锋,范运洲,李鹏,黄松正
1.西北大学医学院 放射科,美国 伊利诺州 芝加哥 60611;2.浙江康源医疗器械有限公司 研发部,浙江 杭州 310051
引言
骨质疏松症是一种常见、多发病,它严重地威胁着中老年人的身体健康,由此引发的骨折等并发症,除了给患者本人造成极大的痛苦外,对社会和家庭带来了沉重的负担。骨质疏松症最初是由欧洲病理学家Pommer[1]于1885年提出,但是直到1993年“共识发展会议”上[2],骨质疏松症才有一个明确的定义:原发性骨质疏松症是以骨量减少、骨的微观结构退化为特征的,致使骨的脆性增加以及容易发生骨折的一种全身性骨代谢性疾病。
诊断骨质疏松症的主要依据是测量骨骼的骨密度值(Bone Mineral Density,BMD)的下降,以及/或低能量外伤出现的骨折(脆性骨折)[3-7]。骨密度值是直接对骨骼的量化诊断指标,常用于诊断骨质疏松症、预测骨折风险和评定治疗效果。由于受不同地域、不同种族、不同测量部位的影响,在骨量上表现各有不同,再加上临床所使用的骨密度测量仪器也有可能不尽相同[8-9],因此,临床骨密度的测量值往往各有差异。为了统一评估诊断标准,世界卫生组织(WHO)于1994年发布以双能量X-射线吸收法(Dual X-ray Absorptiometry,DXA)为基础的T-值作为诊断骨质疏松症的诊断标准[10]。临床上通常采用T-值来判断人体的骨骼是否正常,这里T-值是一个相对的数值,是被检测者的骨密度值与健康年轻人的骨密度值作比较,以得出高出(+)或低于(-)健康年轻人的标准方差数(表1)。

表1 依据T-值,世界卫生组织对骨质疏松诊断进行以下标准分级
目前市场上已有多种多样的骨密度检测方法及产品[6,9,11],按原理分类主要有单光子吸收法(Single Photon Absorptiometry,SPA)、双光子吸收法(Dual Photon Absorptiometry,DPA)、放射吸收法(Radiographic Absorptiometry,RA)、DXA、定量CT法(Quantitative Computed Tomography,QCT)、定量磁共振法(Quantitative Magnetic Resonance Imaging,QMRI)和定量超声法(Quantitative Ultrasound,QUS),其中DXA是WHO建议的已用于临床诊断骨质疏松的金标准方法,但是其存在着设备相对昂贵、维修成本高、需要经过专门培训的专业人士操作的等诸多弱点。在这种情况下,人工智能与传统检测技术的结合,使得其他新的检测技术不断地被人们所关注、开发。本文介绍一种新的骨密度测量方法,称为智能放射吸收测量法(简称i-RA测量法),通过普通的数字X-射线影像设备(Digital Radiography,DR)来采集人体非优势侧前臂骨投影的图像,然后采用智能计算与X-射线放射吸收原理[12]相结合的方法来对该前臂骨的图像进行定量分析处理,计算出该前臂桡骨感兴趣的骨骼区域的骨密度值。由于它与传统的DXA方法相比较,具有测量精度高、便于操作等优点,因此它有望成为最具有发展前景的诊断骨质疏松症的技术之一。
1 材料与方法
1.1 测量方法
智能RA测量法是以普通数字X-射线影像设备为图像采集平台,见图1。首先采集被测量的非优势侧前臂骨(桡骨、尺骨)投影的图像(图2),接下来将该图像输入到图像处理工作站进行降噪预处理,并采用GVF Snake自动分割算法[13]将预处理后的手臂骨骼图像进行分割处理,有效地分割出感兴趣的骨骼和其周围的软组织区域。Snake模型是由一组控制点首尾以曲线相连构成轮廓线。

其中s是描述边界的自变量s∈[0,1]。在Snake的控制点上定义能量函数,其公式如下:
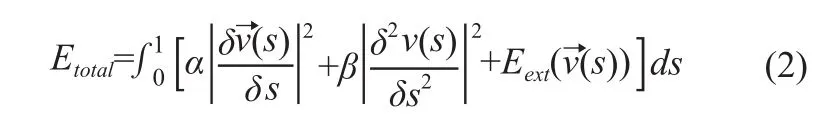
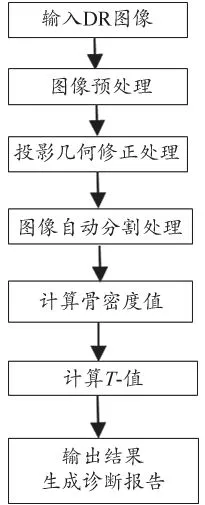
图1 采用i-RA法测量骨密度值的算法流程图
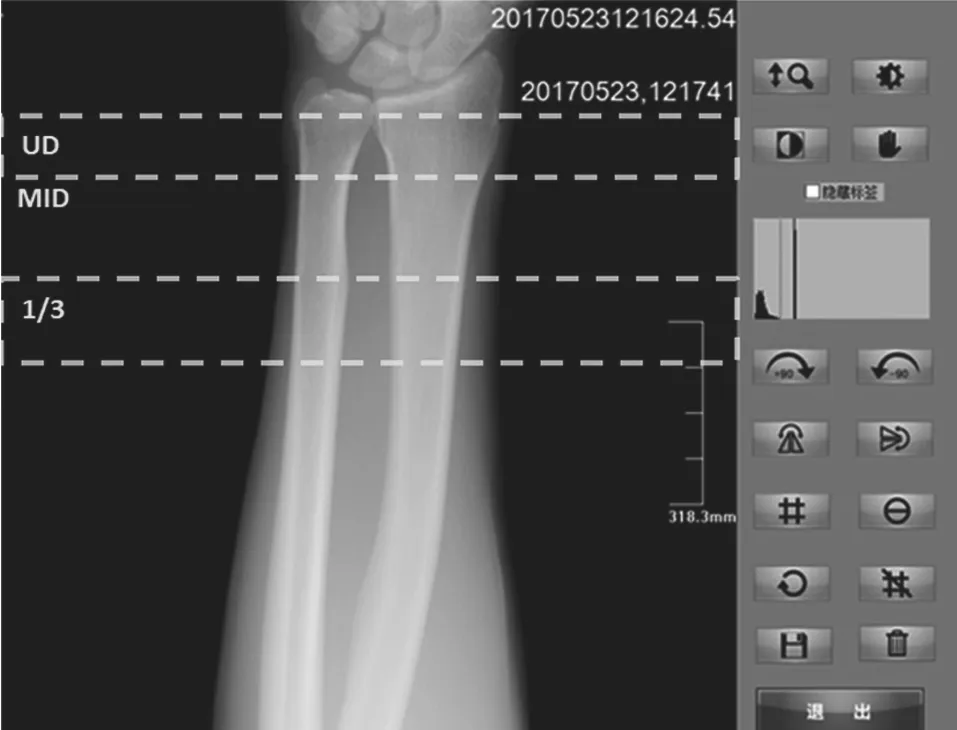
图2 DR所获取的典型前臂骨(桡骨+尺骨)图像
依据X-射线的衰减特性,透过被照骨骼区域后,探测器接收到的图像灰度信号I(x,y)可表示为:
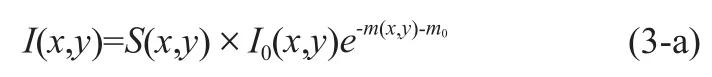
或
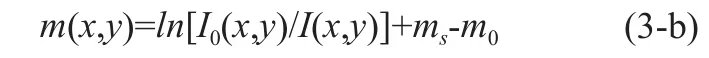
其中m(x,y)是人体被照部位的骨骼衰减因子,I0(x,y)是X-射线探测器在没有经过任何物体衰减所接受到的图像信号强度,S(x,y)是射线锥形束散射修正因子,通常该修正因子大于1.0,ms=lnS(x,y)是射线散射修正值,m0则是软组织吸收的修正值。最后,我们采用参考模块法,把上述m(x,y)值与一个已知等效骨密度值的参考模块(该参考模块包含有一系列不同等效骨密度值的规则区域)所成的影像中具有相同的m(x,y)值的区域相对应,对应的参考模块区域的等效骨密度值为我们被测骨骼部位的骨密度值。为了能与金标准测量结果进行直接比较,我们选取距离非优势侧前臂超远端(称为Ultra-Distal,UD)1/3桡骨长处的桡骨区域(简称1/3区域)为我们测量骨密度的区域[14]。进一步地我们可以依据中国人人群非优势侧前臂桡骨1/3部分处的骨密度值数据库,得出高出(+)或低于(-)健康年轻人的标准方差数作为骨质疏松症诊断的参数,即T-值。
1.2 临床试验设计
临床试验分别在浙江省人民医院和浙江邵逸夫医院进行,临床试验方案分别得到这两家医院伦理委员会的审查和批准。我们分别采用DXA法和i-RA测量法对包含不同年龄段的228位男女受试者的非优势手前臂桡骨1/3部位处进行骨密度测量(其中浙江省人民医院、浙江邵逸夫医院分别有127位和101位受试者参加),他们的年龄范围是在23~87岁之间,平均年龄为62岁,其中男性98人,女性130人。两家医院分别采用美国GE Healthcare公司生产的DXA Prodigy骨密度仪(GE Healthcare,Madison,WI),分析软件为13.31版本。在进行临床测试之前,依据设备使用的要求,操作医师首先采用厂家所提供的质控模块分别对各自的DXA设备进行设备的矫正测量,以确保DXA设备处于正常的临床工作运行状态,并且确认所使用的DXA设备的测量偏差小于1%。类似地,在采用i-RA法进行临床骨密度测量之前,我们也需要对我们的工作站测量系统做相应的图像矫正和系统矫正,在确认矫正结果准确的前提下,再进行具体的临床测试。
1.3 统计学分析
准确度[11]是反映实际骨密度测量值与骨密度真值之间的差异,准确度可用相对偏差表示,其定义为:
而精确度[11]则是指骨密度测量值的可重复性[9],精确度可以用变异系数来定量描述:

其中xi是第i次骨密度测量值,则是总共为n次测量的平均值,μ是骨密度真值。只有在检测结果满足即准确又精确的条件下,临床专家、医生才能基于单次测量的结果来作为临床诊断的依据,并且进一步地通过分析同一病人随时间变化的骨密度检测结果,来有效地分析、跟踪骨质疏松病情的演化。
Pearson相关系数[11]是用来反映DXA测量法和i-RA测量方法所测得的骨密度值之间的线性相关程度的统计量,r定义为:
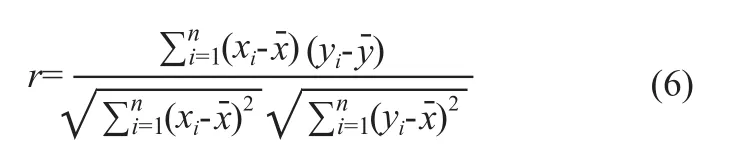
其中xi是采用i-RA法的第i次骨密度测量值,yi则是采用DXA法的第i次骨密度测量值,,则分别是它们n次测量的平均值。r描述的是两个变量间线性相关强弱的程度。r的绝对值越大表明相关性越强。
受试者工作特征曲线(Receiver Operating Characteristic Curve,ROC曲线)[11]是根据一系列不同的二分类方式(分界值或决定阈),以真阳性率(灵敏度)为纵坐标,假阳性率(1-特异度)为横坐标绘制的曲线。这里我们以DXA测量法所获得的结果来定义受试者为阳性或阴性,以i-RA测量法所获得的结果来定义受试者为真性或假性。ROC曲线越靠近左上角,试验的准确性就越高。最靠近左上角的ROC曲线的点是错误最少的最好阈值,其假阳性和假阴性的总数最少。亦可通过分别计算各个试验的ROC曲线下的面积(AUC)来进行定量评估试验的诊断价值。ROC曲线下的面积值在1.0和0.5之间。在AUC>0.5的情况下,AUC越接近于1,说明诊断效果越好,结果越接近DXA的测量结果。AUC在0.5~0.7时有较低准确性,AUC在0.7~0.9时有一定准确性,AUC在0.9以上时有较高准确性。
2 结果
2.1 模块测量精确度、准确度分析
i-RA测量法是以浙江康源医疗器械有限公司的DR6000C数字X-射线影像设备为图像采集平台,采用对已知等效骨密度值的手臂骨模块进行10次重复测量的实验来对i-RA测量法的准确度和精度进行分析[15],同时对比Hologic和GE的DXA测量仪对欧洲脊椎骨模块的测量结果[16],见表2。这结果表明,相对于传统DXA骨密度仪的测量,采用i-RA法所测得的骨密度值的精确度和准确度更高,而且测量所需的时间也更为短。

表2 i-RA法与DXA法的测量结果的精确度和准确度、及测量所需时间的比较
2.2 临床测量结果的相关性、ROC分析
分别采用DXA法和i-RA法所测得的骨密度值和T-值的结果显示,见表3。参加两家医院临床试验的受试者的非优势侧前臂1/3部位处的桡骨具有类似的骨密度值和T-值特征。具体测得的骨密度值和T-值的结果分别见图3、图4。我们还对采用这两种方法所获得的骨密度值和T-值分别进行Pearson相关性计算,得出它们的相关系数分别是:r=0.984(基于BMD值),及r =0.979(基于T-值)。统计结果表明,对于人体非优势侧前臂1/3部位处的桡骨,这两种方法所测得的骨密度值及其T-值都具有非常强的相关性。
表3 受试者的骨密度值和T-值测量的结果 (±s)

表3 受试者的骨密度值和T-值测量的结果 (±s)
浙江省人民医院浙江邵逸夫医院合计DXA法BMD值(g/cm2)0.774±0.1790.758±0.1840.767±0.181 DXA法T-值-1.4±1.6-1.5±1.7-1.4±1.6 i-RA法BMD值(g/cm2)0.732±0.2070.707±0.2220.721±0.214 i-RA法T-值-1.4±1.6-1.6±1.6-1.4±1.6
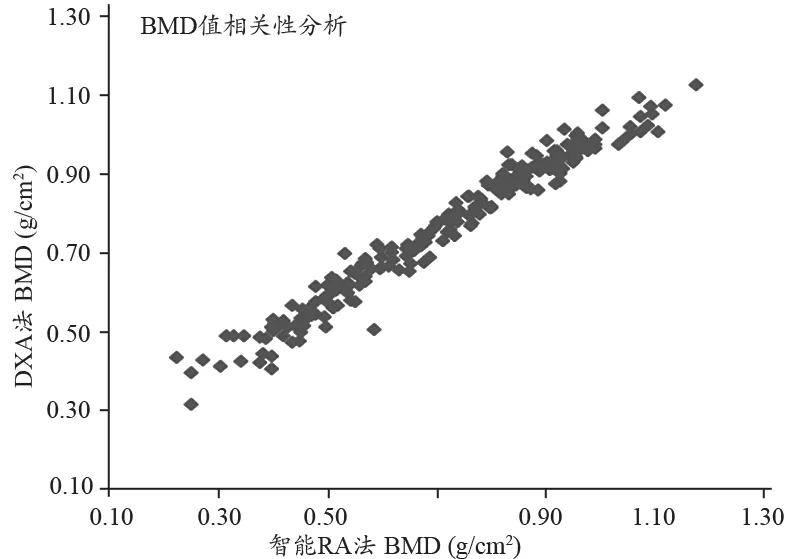
图3 分别采用i-RA法与DXA法的所获得的骨密度值具体测量结果
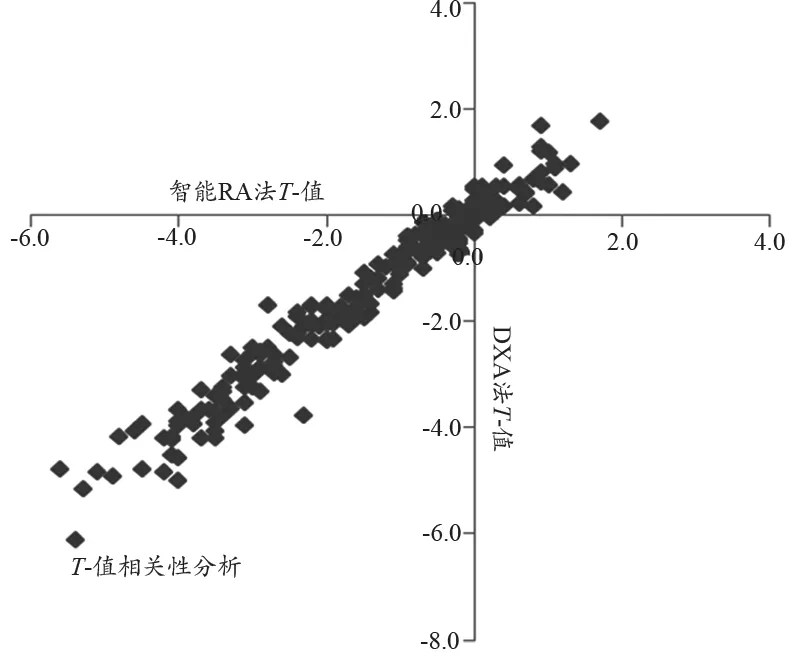
图4 分别采用i-RA法与DXA法的所获得的T-值具体测量结果
我们接下来采用ROC曲线分析方法来进一步评估i-RA测量法用于临床诊断的有效性[11],其中以GE Lunar Prodigy的DXA骨密度仪测得的测量结果作为金标准来定义受试者的阴阳性。对于i-RA测量法用于诊断骨质疏松的有效性分析,我们以T≤-2.5定义骨质疏松为阳性,T >-2.5定义骨质疏松为阴性,具体测量结果,见表4及图5。结果显示i-RA测量法的灵敏度为98.5%,同时特异度为98.2%,ROC曲线下的面积为0.998。类似地,我们也可以对i-RA测量法用于诊断骨质疏松或骨量减少的有效性来进行分析。

表4 对于228位受试者,分别采用i-RA法和DXA法所获得的骨质疏松的阴阳性结果(例)
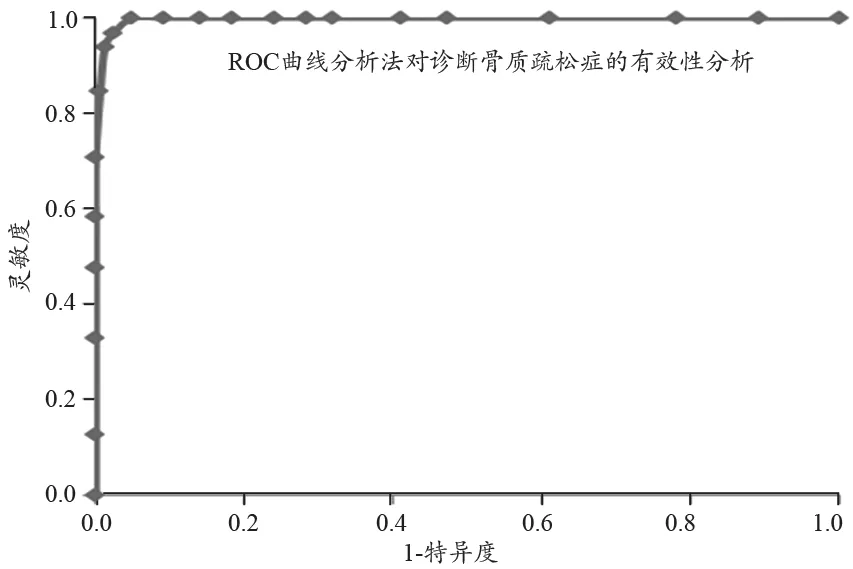
图5 采用ROC曲线分析法,对i-RA法用于诊断骨质疏松症有效性的统计分析
这时,我们以T<-1.0定义骨质疏松或骨量减少为阳性,T≥-1.0定义骨质疏松或骨量减少为阴性,具体测量结果,见表5和图6。结果显示i-RA测量法的灵敏度为99.1%,同时特异度为96.5%,ROC曲线下的面积为0.999。这些统计分析的结果进一步表明,对于人体非优势侧前臂桡骨1/3部位处,采用i-RA骨密度测量方法和DXA测量仪测得的骨密度值具有极高的统计相关性,i-RA测量法可替代传统的双能X-射线吸收法DXA的骨密度仪,来对人体非优势侧前臂桡骨1/3部位处骨密度进行临床检测。
2.3 射线辐射安全
i-RA测量法是采用数字X-射线影像设备来拍摄并获取前臂骨的图像。由于前臂部位所接受的射线辐射剂量远低于辐射的确定效应的临界值,因此这里我们只分析、评估辐射的随机效应[17-18]。例如,采用i-RA骨密度测量方法来对前臂骨部位进行拍片(拍片的曝光技术参数设置为:55 kVp、10 mAs、射线源到平板探测器表面的距离SID=108 cm),拍摄一次的平均前臂入射表面辐射剂量约为DT,R=200~250 μGy,所对应的辐射有效剂量为:
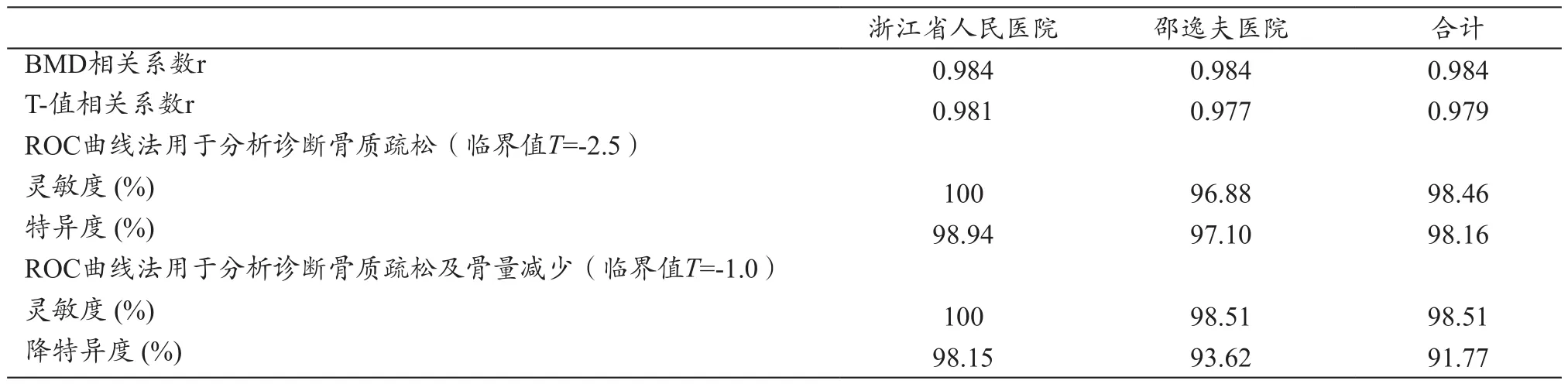
表5 对于228位受试者,分别采用i-RA法和DXA法,所获得的骨密度值和T-值结果的统计分析
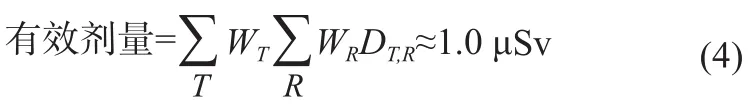
这里WR=1,为X-射线的辐射权重因数;WT≈0.005,为人体四肢的组织权重因数[17-18]。由于其辐射的有效剂量只是一次常规体检X-射线胸片的辐射有效剂量的2%(常规X-射线胸片的平均辐射的有效剂量约为50 μSv),因此采用i-RA测量方法对前臂骨进行骨密度测量,在不考虑射线散射影响的假设条件下,被检测者所接受到的辐射的有效剂量将是在常规影像检测的允许剂量范围内,他们的辐射安全能得到有效地保障。
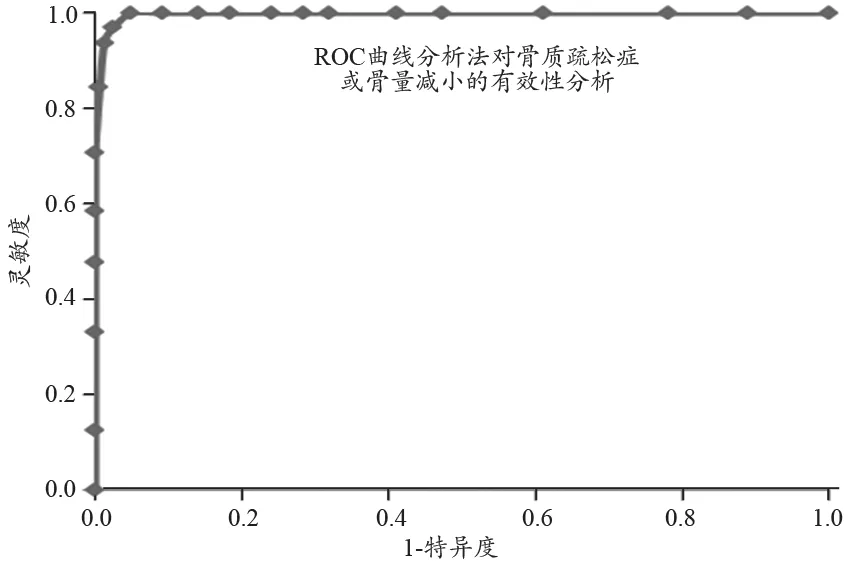
图6 采用ROC曲线分析法,对i-RA测量法用于诊断骨质疏松症或骨量减少的有效性的统计分析
3 讨论
临床试验结果显示,i-RA测量法具有以下几个主要特点:
(1) 对于人体非优势侧前臂桡骨1/3部位处的骨密度测量,i-RA法的测量精确度和准确度均优于传统的DXA法。
(2) 采用i-RA法测量前臂桡骨骨密度,被检测者所接受到辐射的有效剂量只是常规胸片所接受到的平均辐射的有效剂量的2%左右。
(3) i-RA法具有操作简捷的特点,测量所需的时间从5~10 min减少到1~2 min。由于在选取、定位相关骨骼图像区域的操作过程中采用了自动分割算法,少量的人工干预,使得人为操作误差被降到了最低。同时由于优质的DR图像的采集通常是采用一次瞬间的锥形束曝光的方式来完成的,而传统的DXA骨密度仪则是采用一系列扇形或笔形线扫描曝光的方式来实现,因此i-RA测量法能有效地防止在采集图像的过程中人体手臂本身的移动所产生的测量错误,从而提高了检测的成功率和临床检测的效率。
(4) 由于医院无需投资采购、维护测量骨密度所需的专业设备、专门的场地、配备专业的技师,而只需利用医院已有的DR影像设备,配上本文所介绍的骨密度测量软件系统,就可以完成精准的骨密度的临床诊断服务,因此降低了检测成本。
4 结论
通过对上述采用i-RA法与DXA法对人体非优势侧前臂桡骨1/3部位处所测得的骨密度值,以及所对应的T-值的一系列统计分析,我们得出结论,采用这两种方法的所获得的测量结果具有很强的统计相关性,对于人体前臂桡骨1/3部位处的骨密度的临床测量和骨质疏松的评估,我们可用本文所介绍的i-RA测量法来替代传统的DXA测量法。
[参考文献]
[1] Marcus R,Feldman D,Dempster D,et al.Osteoporosis[R].2013.
[2] Consensus A.Consensus development conference: diagnosis,prophylaxis, and treatment of osteoporosis[J].Am J Med,1993,94(6):646-650.
[3] 中国老年学学会骨质疏松委员会.中国人群骨质疏松症防治手册2012版[A].国际骨矿研究学术会议[C].2012.
[4] 中华医学会骨质疏松和骨矿盐疾病分会.原发性骨质疏松症诊疗指南(2017)[J].中华骨质疏松和骨矿盐疾病杂志,2017,10(5):413-443.
[5] Keen RW.Burden of osteoporosis and fractures[J].Curr Osteoporos Rep,2003,1(2):66.
[6] Claus-C Glüer.30 years of DXA technology innovations[J].Bone,2017.
[7] Reginster JY,Burlet N.Osteoporosis: a still increasing prevalence[J].Bone,2006,38(2):4-9.
[8] John ASPD,Cheng XG,Lu Y,et al.Universal standardization of forearm bone densitometry[J].J Bon Min Res,2002,17(4):734.
[9] Dhainaut A,Hoff M,Syversen U,et al.Technologies for assessment of bone re fl ecting bone strength and bone mineral density in elderly women: An update[J].Wom Heal,2016,12(2):209-216.
[10] Listed N.Assessment of fracture risk and its application to screening for postmenopausal osteoporosis:Report of a WHO study group[J].Osteoporos Int,1994,4(6):368-381.
[11] Kalender W,Engelke K,Fuerst TP,et al.Quantitative aspects of bone densitometry (ICRU Report 81)[J].J ICRU, 2009,9(1):1-130.
[12] Ross PD.Radiographie absorptiometry for measuring bone mass[J].Osteoporos Int,1997,7:103-107.
[13] Kass M,Witkin A,Terzopoulos D.Snakes:Active contour models[J].Int J Comr Vis,1988,1(4):321-331.
[14] Shepherd JA,Schousboe JT,Broy SB,et al.Executive Summary of the 2015 ISCD position development conference on advanced measures from DXA and QCT: Fracture prediction beyond BMD[J].J Clin Densitom, 2015,18(3):274-286.
[15] 国家食品药品监督管理局.康源医疗宽频多能X-射线骨密度检测软件[R].Z-Y-2421-2016,2016.
[16] Kolta S,Ravaud P,Fechtenbaum J,et al.Accuracy and precision of 62 bone densitometers using a European spine ohantom[J].Osteop Int,1999,10(1):14-19.
[17] International Commission on Radiological Protection(ICRP).The 2007 recommendations of the International commission on radiological protection[R].2007.
[18] US Nuclear Regulatory Commission.Methods for measuring effective dose equivalent from external exposure[R].2009.

